胰腺癌立體定向放療中腹部危及器官解剖變化對劑量學的影響
滕 峰,朱夫海,任 剛★
(1.中日友好醫院放射腫瘤科,北京 100029;2.空軍特色醫學中心放射治療科,北京 100142)
胰腺癌惡性程度高,5年生存率9%[1],放射治療是其基本的治療方式之一,但因胰腺周圍臨近胃腸道,傳統放療技術難以給予胰腺病灶高劑量放療。立體定向放療劑量模式通過增加單次劑量、減少治療次數,提高腫瘤照射劑量、減輕醫療負擔,更有利于聯合全身系統治療[2,3]。本研究通過評估胰腺癌立體定向放療分次放療間腹部危及器官解剖變化,及變化影響的實際受照劑量,判斷在治療期間修改放療計劃的必要性,為臨床行離線自適應放療(adaptive radiation therapy,ART)提供依據。
1 材料與方法
1.1 模擬定位
2017年4月~9月,連續收集空軍總醫院10例局部晚期期胰腺癌病例,患者取仰臥位,雙手頭上握固定桿,采用熱塑體膜配合碳纖維體部固定架固定,固定范圍為腹部,采用西門子16 排75 cm 孔徑定位CT,掃描范圍為肝頂部至髂骨上緣。定位前15min 口服3%碘帕醇250ml,平靜呼吸狀態下行腹部CT 增強掃描,層厚5mm,掃描后重建4mm。將掃描圖像數據經網絡系統傳至Elekta Focal 勾畫系統。
1.2 制作治療計劃
由同一放療科主治醫師勾畫腫瘤靶區及周邊危及器官。大體腫瘤靶區(gross tumor volume,GTV)為影像學上可見腫瘤,臨床靶區(clinical target volume,CTV)在GTV 基礎上各方向外擴5mm,計劃靶區(planning target volume,PTV)在CTV 基礎上頭腳方向外擴10mm,其余方向各擴5mm,根據腫瘤與胃腸道關系適當調整靶區范圍。危及器官包括:胃、十二指腸、回結腸、肝、腎及脊髓。GTV、CTV 及PTV 劑量分別設定為70Gy、60Gy、50Gy,共計15 次,3 周完成。傳輸至Elekta Monaco 計劃系統,同一物理師制定容積旋轉調強放療(volumetric-modulated arc therapy,VMAT)計劃,在相同物理參數條件及正常器官限制劑量限定下制作物理計劃,胃腸D1≤55Gy,D3≤50Gy,D5≤45Gy,D10≤40Gy,脊髓Max≤40Gy,腎臟:V20≤30%,肝臟:V30≤30%。
1.3 放療實施與驗證圖像獲取
放療1 次/d,5 次/周,3 周完成。計劃經物理師、高級職稱醫師共同討論確定后,患者在Elekta Synergy 設備上接受立體定向放療,每次放療前接受千伏級錐形束CT 掃描,實施圖像引導放療(image guide radiation therapy,IGRT)。在每5 次放療后行1 次診斷平掃CT 驗證,每例患者3 次驗證,共計30 套驗證CT 圖像,傳至勾畫系統中。
1.4 獲取解剖變化及劑量數據
由同一位高年資醫師在勾畫系統中勾畫胃、腸道、肝、腎、脊髓的正常組織輪。在計劃系統中按照原計劃相同物理參數要求制作放療計劃。獲得定位原計劃及驗證計劃共40 套,記錄腹部正常器官的體積及受照劑量參數。計算驗證時危及器官的得分指數(dice scored index,DSI)來分析器官的解剖變化。采用平均數算法模擬出實際正常器官的受照劑量參數。
1.5 統計學方法
應用SPSS20.0 軟件進行統計學分析,運用配對t 檢驗比較各危及器官在模擬實際照射劑量與定位計劃劑量之間的統計學差異。
2 結果
2.1 解剖學變化
十二指腸、胃、腸、肝、腎、及脊髓的平均DSI分別是0.56、0.70、0.65、0.88、0.84 及0.94,見表1。
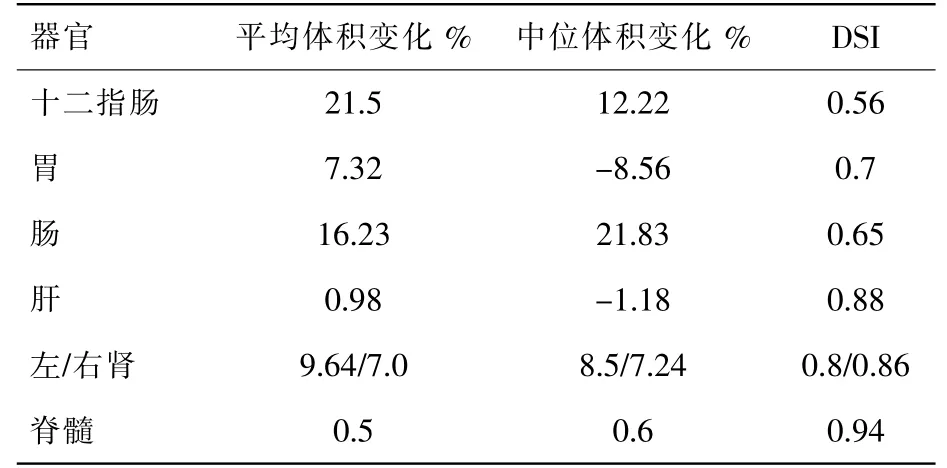
表1 腹部正常器官解剖變化
2.2 劑量學變化
模擬實際受照劑量與定位計劃劑量相比,在肝(Dmean、V30)、左右腎(Dmean、V20)、脊髓(D1cc)、胃(D1cc、D5cc)、腸(D1cc、D5cc)方面均未見統計學差異,其中胃D1cc 平均增加3.9Gy,D5cc 平均增加2.4Gy,腸D1cc 平均增加3.0Gy,D5cc 平均增加2.0Gy。模擬實際受照劑量與定位計劃在十二指腸D1cc、D5cc 有統計學差異,分別平均增加4.2Gy(P=0.007)和2.7Gy(P=0.025),詳見表2。圖1 為某例患者原計劃劑量分布圖與3次驗證的比較(見彩插一);圖2 為劑量體積直方圖比較。
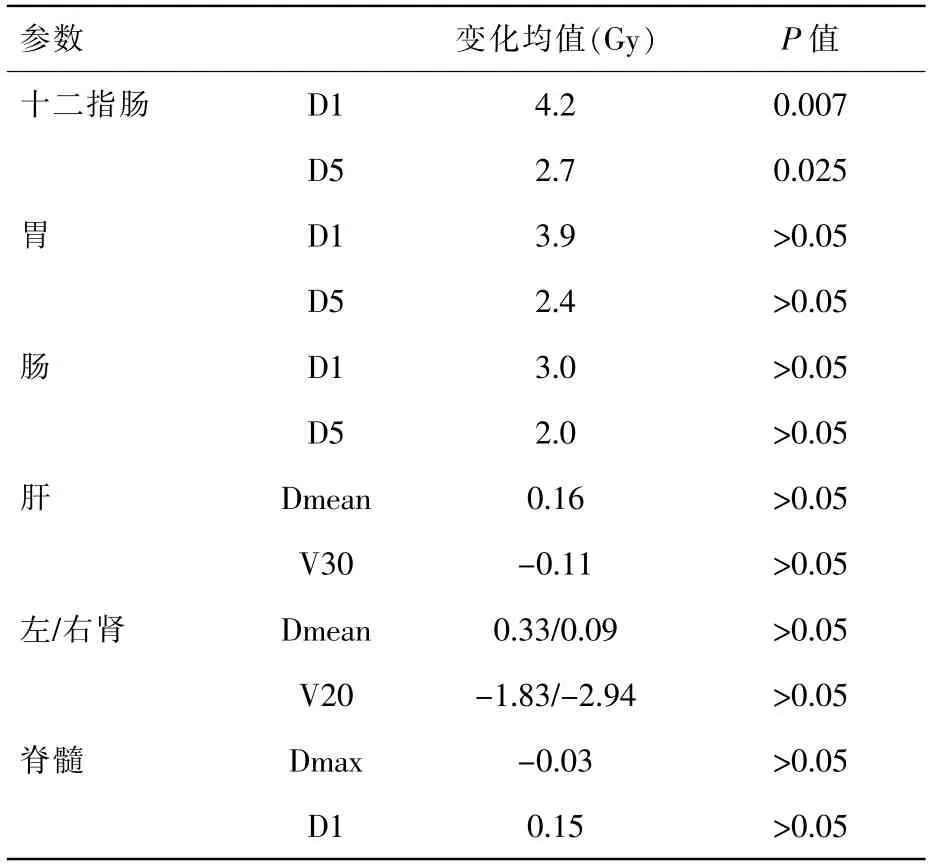
表2 腹部正常器官劑量學變化
圖1 某例患者原計劃劑量分布圖與3次驗證的比較(注:該例患者驗證圖像中的胃腸道解剖與定位圖像間差別較大。)
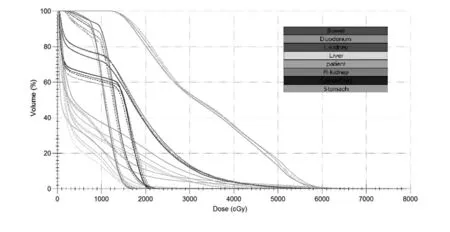
圖2 劑量體積直方圖比較
3 討論
相對傳統放療,精準放療的劑量梯度陡峭,放療分次間的腹部臟器因體位、體重變化、胃腸蠕動及腫瘤大小等因素,導致治療時的腹部器官解剖結構、腫瘤位置出現變化,這些變化導致腫瘤、危及器官的實際受照劑量與原計劃劑量產生差異,這在胰腺癌高劑量放療中可能影響更大。課題組之前對鼻咽癌放療期間分次間危及器官腮腺組織變化做了深入研究,發現隨著放療次數的增加,腮腺體積逐漸縮小,受照劑量逐漸增加[4,5]。IMRT 廣泛應用于胰腺癌治療中,也使胰腺癌立體定向放療成為可能[6~9],胰腺癌放療不同于頭頸部腫瘤,胰腺癌更適合立體定向放療,由于腫瘤及其周圍器官形狀改變、呼吸運動以及擺位誤差等因素影響,解剖結構及位置分次間會出現變化,而精準放療模式下的立體定向放療劑量梯度較大,會加重周圍危及器官的損傷,尤其是胃腸道的損傷,嚴重時可出現出血、穿孔,甚至危及生命[10]。
因體位固定技術的不斷改進和圖像引導技術出現,使擺位誤差明顯減小[11],呼吸門控、金標追蹤等技術使呼吸運動得到一定的控制[12,13],但治療分次間解剖學變化所引起的計劃照射劑量與實際劑量之間的差異仍然存在。Van der Horst 等采用放療前千伏級錐形束CT 的影像,分析9 例胰腺癌患者放療分次間腫瘤覆蓋率差異,因腫瘤位置會發生變化,靶劑量覆蓋率會明顯下降,D98%從95.9%降至85.8%[14]。Loi 等觀察胰腺癌放療劑量40Gy/5F 模式下,因分次間解剖結構變化所導致的胃腸道劑量變化,發現胃腸實際劑量的D2、D5、D10 和Dmax 中位數分別增加了4.4%、2.3%、3.3%和12.0%,差異均有統計學意義[15]。
目前關于胰腺癌立體定向放療分次放療間腹部危及器官解剖變化及劑量學的研究罕有報道,本研究采用診斷CT 作為驗證方式,較加速器自帶的圖像引導CT 圖像清晰,更有利于危及器官的勾畫。較其他報道,本研究不僅把胃腸道分開統計分析,而且也同時計算了肝、腎及脊髓在分次間的體積變化及受照劑量。胃腸道每個部位的放射敏感性是不同的,從十二指腸、胃、小腸、結腸到直腸,放射敏感性逐漸降低。十二指腸因包繞胰腺,使它成為胰腺癌放療中最受關注的危及器官。本研究結果發現分次間十二指腸的DSI 值最低,模擬實際受照劑量在十二指腸D1cc、D5cc 分別平均增加4.2Gy 和2.7Gy,明顯高于定位計劃。因此,建議在胰腺癌立體定向放療期間,檢測患者腹部解剖變化,必要時修改放療計劃,以免患者接受到額外的放療損傷。
本研究尚有些不足,因目前缺乏有效、便利的方法計算危及器官的位置,所以沒有對各危及器官的位置變化做詳細計算,自然無法獲取其位移規律。另外,采用平均數算法模擬出實際正常器官的受照劑量參數,與真正的危及器官受照劑量仍可能出現偏差。相信變形配準技術方法的不斷進步,必將解決這些難題。

