miR-363-3p對(duì)非小細(xì)胞肺癌細(xì)胞遷移與侵襲能力的影響
殷玉,王亞紅,許志亮,劉剛
1 廣東醫(yī)科大學(xué)附屬醫(yī)院呼吸內(nèi)科,524000;2 廣東醫(yī)科大學(xué)附屬醫(yī)院臨床研究中心
大多數(shù)支氣管肺癌患者是非小細(xì)胞肺癌(NSCLC),患者被診斷為NSCLC 時(shí)通常為疾病晚期,腫瘤細(xì)胞已經(jīng)發(fā)生淋巴結(jié)及其他器官的轉(zhuǎn)移,患者5 年生存率僅為14%[1-2]。研究顯示,未發(fā)生轉(zhuǎn)移的NSCLC 患者5 年生存率可達(dá)83%[3]。因此,腫瘤細(xì)胞是否發(fā)生轉(zhuǎn)移對(duì)于NSCLC 患者的預(yù)后至關(guān)重要。肺癌生物標(biāo)志物的鑒定有助于NSCLC 的早期診斷、治療以及預(yù)后判斷。越來(lái)越多的研究證明,微小RNA(miRNA)參與調(diào)控細(xì)胞分化、增殖和存活的各種信號(hào)通路,在多種類(lèi)型的腫瘤細(xì)胞中表達(dá)異常。研究發(fā)現(xiàn),miR-363-3p 參與調(diào)控膽囊癌[4]、胃癌[5-6]和膠質(zhì)瘤[7]等多種腫瘤細(xì)胞的遷移與侵襲。但目前關(guān)于miR-363-3p 在發(fā)生淋巴結(jié)轉(zhuǎn)移的NSCLC組織及細(xì)胞中的表達(dá)變化,以及是否對(duì)高轉(zhuǎn)移性的NSCLC 細(xì)胞遷移與侵襲有直接調(diào)控作用尚不明了[8-9]。為此,我們于2020 年1 月—2021 年6 月進(jìn)行了如下研究。
1 材料與方法
1.1 材料 細(xì)胞:人NSCLC 細(xì)胞株A549 及高轉(zhuǎn)移性NSCLC 細(xì)胞株H441 均購(gòu)自美國(guó)ATCC。主要試劑:TRIzol 試劑、細(xì)胞培養(yǎng)基、胎牛血清、Lipofectamine 2000 轉(zhuǎn)染試劑盒均購(gòu)自美國(guó)Invitrogen 公司,miRcute miRNA First-Strand cDNA Syntnesis Kit反轉(zhuǎn)錄試劑盒、Real-time PCR 試劑均購(gòu)自北京天根生物科技有限公司,蛋白提取試劑盒購(gòu)自上海碧云天生物科技有限公司,GAPDH 抗體購(gòu)自上海生工生物工程科技有限公司,E-鈣黏蛋白(E-cadherin)、波形蛋白(Vimentin)、基質(zhì)金屬蛋白酶9(MMP-9)、基質(zhì)金屬蛋白酶3(MMP-3)抗體均購(gòu)自美國(guó)Cell Signaling Technology 公司,細(xì)胞遷移測(cè)試盒購(gòu)自美國(guó)BD 公 司。miR-363-3p mimics 和miR-363-3p inhibitor由上海吉瑪制藥技術(shù)有限公司設(shè)計(jì)合成。
1.2 發(fā)生和未發(fā)生淋巴結(jié)轉(zhuǎn)移的NSCLC 組織miR-363-3p 表達(dá)檢測(cè) 采用實(shí)時(shí)熒光定量PCR 法。選取2013年1月—2014年3月廣東醫(yī)科大學(xué)附屬醫(yī)院保存的、發(fā)生和未發(fā)生淋巴結(jié)轉(zhuǎn)移的NSCLC 組織樣本各26、21 例份。加入組織裂解液,使用TRIzol 試劑提取總RNA,并使用miRcute miRNA First-Strand cDNA Syntnesis Kit 反轉(zhuǎn)錄試劑盒合成cDNA。以GAPDH為內(nèi)參,進(jìn)行PCR反應(yīng)。miR-363-3p引物序列:上 游 引 物5′-TGGGGTGAGAGGTGATAGAGG-3′,下 游 引 物5′-CGGCGTCTGCTGAACAAATAC-3′;U6 引物序列:上游引物5′-CTCGGTTCGGCAGCACA-3′,下游引物5′-AACGCTTCACGAATTTGCGT-3′。 PCR 反應(yīng)體系10 μL:1×SYBR Premix Ex Taq?Ⅱ5.0 μL,上、下游引物各0.4 μL,DNA 模板1.0 μL,滅菌蒸餾水(dH2O)3.2 μL。PCR 反應(yīng)條件:95 ℃預(yù)變性30 s,95 ℃變性5 s,60 ℃退火30 s,共40 個(gè)循環(huán)。采用2-ΔΔCt法計(jì)算miR-363-3p 相對(duì)表達(dá)量。
1.3 A549、H441 細(xì)胞miR-363-3p 表達(dá)檢測(cè) 將A549、H441 置于含10% 胎牛血清的低糖DMEM 中,37 °C、5% CO2培養(yǎng)箱中培養(yǎng)。使用TRIzol試劑提取細(xì)胞總RNA,并使用miRcute miRNA First-Strand cDNA Syntnesis Kit反轉(zhuǎn)錄試劑盒合成cDNA。以U6為內(nèi)參,參照1.2 采用實(shí)時(shí)熒光定量PCR 法檢測(cè)miR-363-3p相對(duì)表達(dá)量。
1.4 H441 細(xì)胞分組處理 將對(duì)數(shù)生長(zhǎng)期的H441細(xì)胞接種于培養(yǎng)皿中,待細(xì)胞生長(zhǎng)密度達(dá)70% 時(shí)分為三組,即對(duì)照組、miR-363-3p mimics 組、miR-363-3p inhibitor 組,分別使用Lipofectamine 2000 轉(zhuǎn)染試劑盒轉(zhuǎn)染對(duì)照miRNA、miR-363-3p mimics、miR-363-3p inhibitor。轉(zhuǎn)染6 h,細(xì)胞換液繼續(xù)培養(yǎng)24 h。
1.5 H441 細(xì)胞遷移或侵襲能力觀察 采用Transwell 法。取三組細(xì)胞,以2×104接種于聚碳酸酯Transwell 小室中(侵襲實(shí)驗(yàn)需使用基質(zhì)膠預(yù)處理Transwell 小室),在下室添加含10% 胎牛血清的培養(yǎng)基作為化學(xué)引誘劑,37 ℃、5% CO2細(xì)胞培養(yǎng)箱中孵育24 h。用棉簽從上孔中擦除非侵入細(xì)胞,70%乙醇固定侵入細(xì)胞30 min,0.2% 結(jié)晶紫染色10~30 min。隨機(jī)選擇5個(gè)視野,在倒置光學(xué)顯微鏡下對(duì)穿過(guò)小室的細(xì)胞進(jìn)行計(jì)數(shù),取平均值,計(jì)算遷移或侵襲細(xì)胞數(shù)。
1.6 H441 細(xì)胞E-cadherin、Vimentin、MMP-9、MMP-3 蛋白表達(dá)檢測(cè) 采用Western blotting 法。收集各組細(xì)胞,PBS 沖洗后,加入裂解液冰上裂解30 min,超聲破碎細(xì)胞,低溫離心后收集上清蛋白。采用BCA 法測(cè)定蛋白濃度,制備蛋白樣品上樣,進(jìn)行十二烷基硫酸鈉—聚丙烯酰胺凝膠電泳(SDS-PAGE)凝膠配制及電泳;PVDF 轉(zhuǎn)膜,室溫條件下脫脂牛奶封 閉1 h,洗 滌2 次。 加 入E-cadherin、Vimentin、MMP-9、MMP-3 及內(nèi)參GAPDH 一抗(稀釋比例為1∶1 000),4 ℃搖床過(guò)夜孵育;洗膜后加入二抗(稀釋比例為1∶5 000),室溫孵育1 h。洗滌3 次,拍照顯影,Image J軟件分析條帶灰度值,以目的蛋白與內(nèi)參蛋白條帶灰度值的比值計(jì)算目的蛋白相對(duì)表達(dá)量。
1.7 統(tǒng)計(jì)學(xué)方法 采用GraphPad Prism 5統(tǒng)計(jì)軟件。計(jì)量資料以±s表示,多組間比較采用方差分析,兩組間比較采用t檢驗(yàn)。P<0.05為差異有統(tǒng)計(jì)學(xué)意義。
2 結(jié)果
2.1 發(fā)生和未發(fā)生淋巴結(jié)轉(zhuǎn)移的NSCLC 組織miR-363-3p 表達(dá)比較 發(fā)生和未發(fā)生淋巴結(jié)轉(zhuǎn)移的NSCLC 組織miR-363-3p 相對(duì)表達(dá)量分別為1.091 ±0.153、0.128 ± 0.336,二者比較P<0.01。
2.2 A549、H441 細(xì) 胞miR-363-3p 表 達(dá) 比 較A549、H441 細(xì) 胞miR-363-3p 相 對(duì) 表 達(dá) 量 分 別 為1.02 ± 0.039、31.45 ± 1.158,二者比較P<0.01。
2.3 三組細(xì)胞遷移和侵襲能力比較 miR-363-3p inhibitor 組、對(duì)照組、miR-363-3p mimics 組遷移細(xì)胞數(shù)、侵襲細(xì)胞數(shù)均依次升高,兩組間比較P均<0.05。見(jiàn)表1。
表1 三組遷移細(xì)胞數(shù)、侵襲細(xì)胞數(shù)比較(個(gè),± s s)
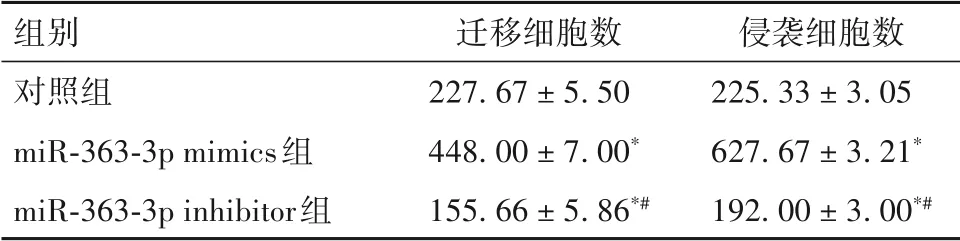
表1 三組遷移細(xì)胞數(shù)、侵襲細(xì)胞數(shù)比較(個(gè),± s s)
注:與對(duì)照組比較,*P<0.05;與miR-363-3p mimics 組比較,#P<0.05。
組別對(duì)照組miR-363-3p mimics組miR-363-3p inhibitor組遷移細(xì)胞數(shù)227.67 ± 5.50 448.00 ± 7.00*155.66 ± 5.86*#侵襲細(xì)胞數(shù)225.33 ± 3.05 627.67 ± 3.21*192.00 ± 3.00*#
2.4 三組細(xì)胞E-cadherin、Vimentin、MMP-9、MMP-3蛋白表達(dá)比較 miR-363-3p inhibitor 組、對(duì)照組、miR-363-3p mimics組Vimentin、MMP-9、MMP-3蛋白相對(duì)表達(dá)量均依次升高、E-cadherin蛋白相對(duì)表達(dá)量依次降低,兩組間比較P均<0.05。見(jiàn)表2、圖1。
表2 三組細(xì)胞E-cadherin、Vimentin、MMP-9、MMP-3蛋白相對(duì)表達(dá)量比較(± s s)

表2 三組細(xì)胞E-cadherin、Vimentin、MMP-9、MMP-3蛋白相對(duì)表達(dá)量比較(± s s)
注:與對(duì)照組比較,*P<0.05;與miR-363-3p mimics組比較,#P<0.05。
組別對(duì)照組miR-363-3p mimics組miR-363-3p inhibitor組E-cadherin 1.00 ± 0.06 0.33 ± 0.08*1.34 ± 0.05*#Vimentin 1.00 ± 0.07 4.01 ± 0.04*0.93 ± 0.03*#MMP-9 1.00 ± 0.03 3.45 ± 0.04*0.84 ± 0.07*#MMP-3 1.00 ± 0.05 1.51 ± 0.06*0.85 ± 0.03*#
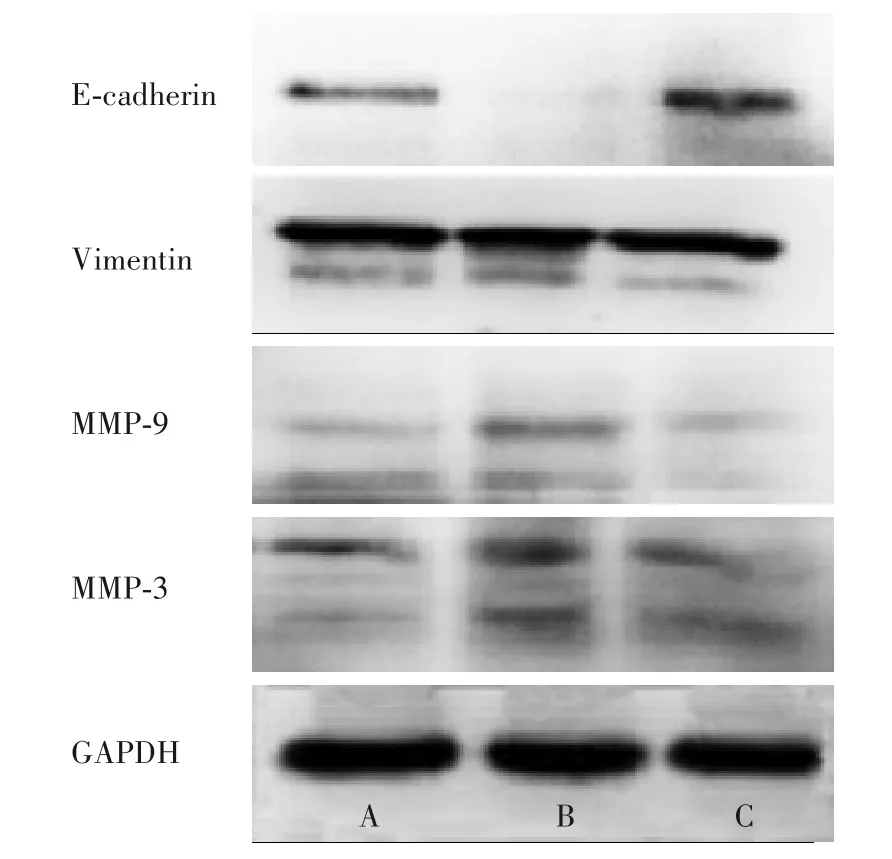
圖1 三組細(xì)胞E-cadherin、Vimentin、MMP-9、MMP-3蛋白表達(dá)條帶圖(Western blotting法)
3 討論
腫瘤細(xì)胞遷移和侵襲能力升高是腫瘤轉(zhuǎn)移及病情惡化的重要機(jī)制之一。研究表明,miR-363-3p 在胃癌中與LINC00858 存在相互作用,并靶向叉頭盒P4 蛋白(FOXP4),進(jìn)而調(diào)控細(xì)胞增殖、遷移和侵襲[5]。同樣的,miR-363-3p 可靶向FEZF1-AS1 基因,通過(guò)FEZF1-AS1/miR-363-3p/HMGA2 軸在胃癌進(jìn)展中發(fā)揮關(guān)鍵調(diào)控作用[6]。在腎細(xì)胞癌中,lncRNA SNHG5 與miR-363-3p-Twist1 的直接相互作用可調(diào)控細(xì)胞侵襲和凋亡過(guò)程[11]。在膠質(zhì)瘤中,miR-363-3p通過(guò)靶向丙酮酸脫氫酶B(PDHB)的表達(dá),參與調(diào)節(jié)細(xì)胞生長(zhǎng)、凋亡和侵襲,最終介導(dǎo)腫瘤轉(zhuǎn)移[7]。另外,miR-363-3p 可通過(guò)介導(dǎo)SNAI2/CDH1 軸在體外促進(jìn)胃腸道間質(zhì)瘤細(xì)胞的轉(zhuǎn)移[12]。以上研究提示,miR-363-3p 在不同腫瘤的轉(zhuǎn)移中均具有重要作用。然而,miR-363-3p 在NSCLC 細(xì)胞轉(zhuǎn)移中的作用還尚未明確。
本課題組早期研究結(jié)果顯示,miR-363-3p 表達(dá)水平與NSCLC 患者淋巴結(jié)轉(zhuǎn)移情況呈正相關(guān)關(guān)系[9]。此外,本課題組還證實(shí)了miR-363-3p 通過(guò)靶向PCNA 調(diào)控NSCLC 增殖[8-10]。以上說(shuō)明,miR-363-3p 表達(dá)可能與肺癌細(xì)胞的轉(zhuǎn)移和侵襲能力密切相關(guān)。 本研究發(fā)現(xiàn),發(fā)生淋巴結(jié)轉(zhuǎn)移的NSCLC 組織miR-363-3p 相對(duì)表達(dá)量明顯高于未發(fā)生淋巴結(jié)轉(zhuǎn)移的NSCLC 組織,高轉(zhuǎn)移性H441 細(xì)胞中的miR-363-3p 相對(duì)表達(dá)量明顯高于A549 細(xì)胞;提示miR-363-3p 可能參與了NSCLC 細(xì)胞的遷移與侵襲,但其是否直接參與調(diào)控NSCLC 的轉(zhuǎn)移還有待進(jìn)一步證實(shí)。
E-cadherin 主要介導(dǎo)細(xì)胞間的黏附,其表達(dá)下降會(huì)使細(xì)胞間黏附能力降低,更加有利于腫瘤細(xì)胞向細(xì)胞基質(zhì)外擴(kuò)散。Vimentin 與癌細(xì)胞的強(qiáng)侵襲性和易轉(zhuǎn)移性密切相關(guān),Vimentin 表達(dá)升高提示細(xì)胞遷移能力增強(qiáng)[13]。基質(zhì)金屬蛋白酶(MMPs)對(duì)細(xì)胞外基質(zhì)重塑、傷口愈合和血管生成至關(guān)重要,MMPs是基質(zhì)相關(guān)蛋白,可通過(guò)直接切割或從細(xì)胞外基質(zhì)結(jié)合體中釋放[14]。MMP-3 通過(guò)激活Ⅱ型肺泡上皮細(xì)胞中的Wnt/β-catenin 信號(hào)通路,增加裂解肺上皮細(xì)胞中的E-cadherin 活性,從而誘導(dǎo)上皮間質(zhì)轉(zhuǎn)化[14]。以MMPs 為代表的降解細(xì)胞外基質(zhì)蛋白酶廣泛參與到腫瘤細(xì)胞侵襲轉(zhuǎn)移過(guò)程中,MMP-9 在ECM重塑和膜蛋白切割中起重要作用[15]。研究顯示,MMP-9 在腫瘤侵襲、轉(zhuǎn)移、血管生成以及介導(dǎo)腫瘤微環(huán)境中均發(fā)揮作用[16-17]。同時(shí),MMP-9 是NSCLC診斷的潛在生物標(biāo)志物[18]。目前大量研究表明,MMP-9、MMP-3 與腫瘤細(xì)胞的侵襲性有關(guān)[18-20]。本研究結(jié)果顯示,過(guò)表達(dá)miR-363-3p 可促進(jìn)H441 細(xì)胞的遷移和侵襲,同時(shí)能夠顯著抑制E-cadherin 表達(dá)和促進(jìn)Vimentin、MMP-3、MMP-9表達(dá)。
綜上所述,miR-363-3p 可能通過(guò)升高Vimentin、MMP-9、MMP-3 蛋白表達(dá)及降低E-cadherin 蛋白表達(dá)而促進(jìn)NSCLC 細(xì)胞的遷移和侵襲。本研究為肺癌轉(zhuǎn)移的發(fā)病機(jī)制和靶向治療提供了科學(xué)依據(jù),但是miR-363-3p 在調(diào)控NSCLC 細(xì)胞遷移與侵襲進(jìn)程中的靶向基因及具體的分子機(jī)制還需進(jìn)一步研究證實(shí)。
- 山東醫(yī)藥的其它文章
- 慢性鼻竇炎患者功能性鼻竇內(nèi)鏡手術(shù)后糖皮質(zhì)激素經(jīng)鼻腔脈沖霧化與口服給藥效果比較
- 徒手淋巴引流技術(shù)聯(lián)合沖擊波治療腦卒中后肩手綜合征Ⅰ期的療效觀察
- 傳統(tǒng)凝血功能試驗(yàn)和血栓彈力圖在彌散性血管內(nèi)凝血診斷中的一致性分析
- 骨質(zhì)疏松性椎體壓縮性骨折患者PKP治療后發(fā)生鄰近椎體骨折的危險(xiǎn)因素分析
- ADHD 共患TS 患兒定量腦電圖參數(shù)與血清Cor、IL-8、IFN-γ、T淋巴細(xì)胞亞群變化及意義
- 智能手機(jī)上傳手持設(shè)備顯示心電圖異常的危險(xiǎn)因素分析

