微炎癥環境中腸上皮細胞與巨噬細胞共培養后MAPK、NF-κB通路改變及意義
陳玉嬌,晏杰
1 連云港市第二人民醫院檢驗科,江蘇連云港222023;2 廣州醫科大學附屬第二醫院過敏反應與免疫重點實驗室
腸上皮屏障和黏膜巨噬細胞是腸道固有免疫的重要組成部分,在腸道穩態與炎癥反應之間維持重要的平衡作用。正常狀態下,免疫系統對腸道分布的共生菌群免疫耐受,對侵入到腸道的微生物能及時產生免疫應答;而炎癥性腸病(IBD)患者對腸道共生微生物等無害抗原呈現出異常過激的免疫應答,導致黏膜耐受崩潰[1]。一直以來對IBD 的研究主要關注于炎癥狀態下過度的免疫反應,而固有免疫抗原提呈系統產生免疫耐受、維持腸道穩態的機制研究甚少。因此,探究腸上皮細胞和單核巨噬細胞之間的相互作用機制對于揭示腸道穩態的機制至關重要[2]。HYUN 等[3]發現,巨噬細胞和腸道上皮細胞之間存在相互交流,可以促進白細胞介素10(IL-10)分泌,但這種細胞間的交流具體通過什么方式、由哪個或哪些分子介導目前尚不明確。人結腸腺癌上皮細胞株Caco2、HCA7 具備分化的小腸上皮細胞結構和功能,具有與體內細胞相同的細胞極性和緊密連接,且較易在Transwell 孔上形成連續的極化單層腸上皮細胞的特性,在腸道上皮屏障功能、腸道穩態以及腸上皮細胞與腸黏膜下免疫細胞相互作用機制等研究領域得到廣泛使用[4-6]。2018 年10 月—2020 年5 月,本研究觀察了上皮細胞與單核巨噬細胞共培養時對彼此MAPK 和NF-κB 通路的影響,為探究固有免疫系統在維持黏膜免疫平衡中的機制提供依據。現報告如下。
1 材料與方法
1.1 材料 細胞:人結腸腺癌上皮細胞株Caco2、HCA7 及人白血病單核巨噬細胞株THP1 均購自中國科學院細胞生物學研究所。主要試劑:胎牛血清、DMEM(高糖、低糖)、RPMI 1640、無血清培養基、BCA 蛋白定量試劑盒、SYBR qPCR 試劑盒均購自美國Thermo 公司,腫瘤壞死因子α(TNF-α)細胞因子購自美國R&D 公司,蛋白轉運抑制劑(BFA)購自美國MCE 公司,磷酸化細胞外信號調節激酶(p-ERK)、磷酸化絲裂原活化蛋白激酶(p-p38)、NF-κB抑制蛋白α(IκBα)、磷酸化NF-κB 抑制蛋白α(p-IκBα)、磷酸化核蛋白(p-p65)、內參β-tubulin一抗及辣根過氧化物酶(HRP)標記的二抗均購自美國CST公司;逆轉錄cDNA 合成試劑盒購自中國Transgen公司,RT-PCR 引物由中國擎科公司設計合成,帶熒光標記的單抗白細胞介素8(IL-8)-FITC、CC 亞族趨化性細胞因子(CCL)-APC、細胞內因子染色固定破膜試劑盒購自美國BD 公司。主要儀器:12 孔Transwell小室購自美國Corning公司,流式細胞儀購自美國BD 公司,酶標儀、細胞培養箱均購自美國Thermo公司,q-PCR儀購自德國羅氏公司,PowerPac 3000型蛋白電泳儀購自美國Bio-Red 公司,細胞電阻儀購自美國Millipore公司。
1.2 細胞培養和極化 使用高糖DMEM 完全培養基(含10% 胎牛血清及1% 雙抗)培養Caco2細胞,使用低糖DMEM 培養HCA7 細胞,使用RPMI 1640 培養THP1 細胞,均置于37 ℃、5% CO2培養箱中培養。取對數 生 長 期的Caco2、HCA7,以2×105/孔鋪在Transwell 上室,使Transwell 上室和下室充盈細胞培養基,培養1周待上皮細胞極化,電阻儀測量電阻達到1 000 Ωm2時進行下一步共培養。
1.3 微炎癥環境中極化的上皮細胞與THP1 單獨及共培養后MAPK、NF-κB通路改變的觀察
1.3.1 細胞培養及TNF-α 刺激 取對數生長期的THP1 細胞,以2×106/孔鋪于12 孔板,給1.2 中Transwell 上室內極化的上皮細胞Caco2、HCA7 換液,并置于THP1 細胞懸液上,以模擬腸道上皮組織內上皮細胞和單核巨噬細胞的空間分布,培養箱共孵育過夜。第2 天加入TNF-α(5 ng/mL)于Transwell 下室中,設置同等條件下Caco2、HCA7 單獨培養的Transwell 上室和THP1 單獨培養的下室作為單獨培養對照,同時給予TNF-α(5 ng/mL)刺激。
1.3.2 細胞MAPK 通路(p-ERK、p-p38)及NF-κB通路(IκBα、p-IκBα、p-p65)相關蛋白表達檢測 采用Western blotting 法。取1.3.1 中分別單獨及共培養后的Caco2、HCA7、THP1,在梯度時間點刺激后收集細胞(根據兩種上皮細胞信號通路激活快慢不同,Caco2 的TNF-α 刺激時間分別為0、15、30、90 min,HCA7的TNF-α刺激時間分別為0、15、30、120 min)。分別提取Transwell 下室和上室細胞總蛋白,蛋白定量后取40 μL 樣品,加入上樣緩沖液和β-巰基乙醇煮樣10 min。常規電泳、轉膜,5% 脫脂奶粉封閉后,依次加入p-ERK、p-p38、p-IκBα、p-p65 一抗(稀釋比例均為1∶1 000)及內參β-tubulin 一抗(稀釋比例為1∶2 500),4 ℃搖床孵育過夜。 次日PBST 漂洗10 min×3 次,加入二抗(稀釋比例為1∶5 000),室溫孵育1 h。ECL 顯影液在凝膠成像儀上曝光成像,計算目的蛋白相對表達量。
1.4 微炎癥環境中經Caco2 條件培養基孵育后的THP1 細胞MAPK、NF-κB 通路及細胞因子表達變化的觀察
1.4.1 THP1細胞分組處理及TNF-α刺激 在細胞培養箱正常培養Caco2 細胞1~2 d 后,收集培養上清,即Caco2 條件培養基。取對數生長期的THP1 細胞,分為Caco2 培養基組和DMEM 培養基組,離心后分別重懸于Caco2 條件培養基和DMEM 完全培養基。將兩組細胞以2×106/孔均勻鋪于12 孔板,孵育過夜后加入TNF-α(5 ng/mL),分別刺激0、15、30、120 min。
1.4.2 細胞MAPK 通路及NF-κB 通路相關蛋白表達檢測 參照1.3.2 采用Western blotting 法檢測兩組細胞p-ERK、p-p38、p-IκBα、p-p65 等蛋白表達。
1.4.3 細胞TNF-α 相關細胞因子(IL-8、IL-6、IL-1β)和趨化因子(CCL2、CCL3)mRNA 表達檢測 采用RT-PCR 法。兩組細胞經TNF-α 刺激0、60 min時,采用TRIzol 試劑提取總RNA,用逆轉錄cDNA 合成試劑盒合成cDNA。PCR 引物序列見表1。PCR反應條件:95 ℃預變性2 min,95 ℃變性15 s,55 ℃退火15 s,72 ℃延伸1 min,40個循環。

表1 TNF-α相關細胞因子和趨化因子引物序列
1.5 統計學方法 采用SPSS22.0 統計軟件。計量資料以-x± s 表示,組間和組內比較分別采用成組t檢驗和配對t檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 TNF-α 刺激下單獨或共培養后的Caco2、THP1細胞MAPK、NF-κB 通路相關蛋白表達比較 見表2、3。
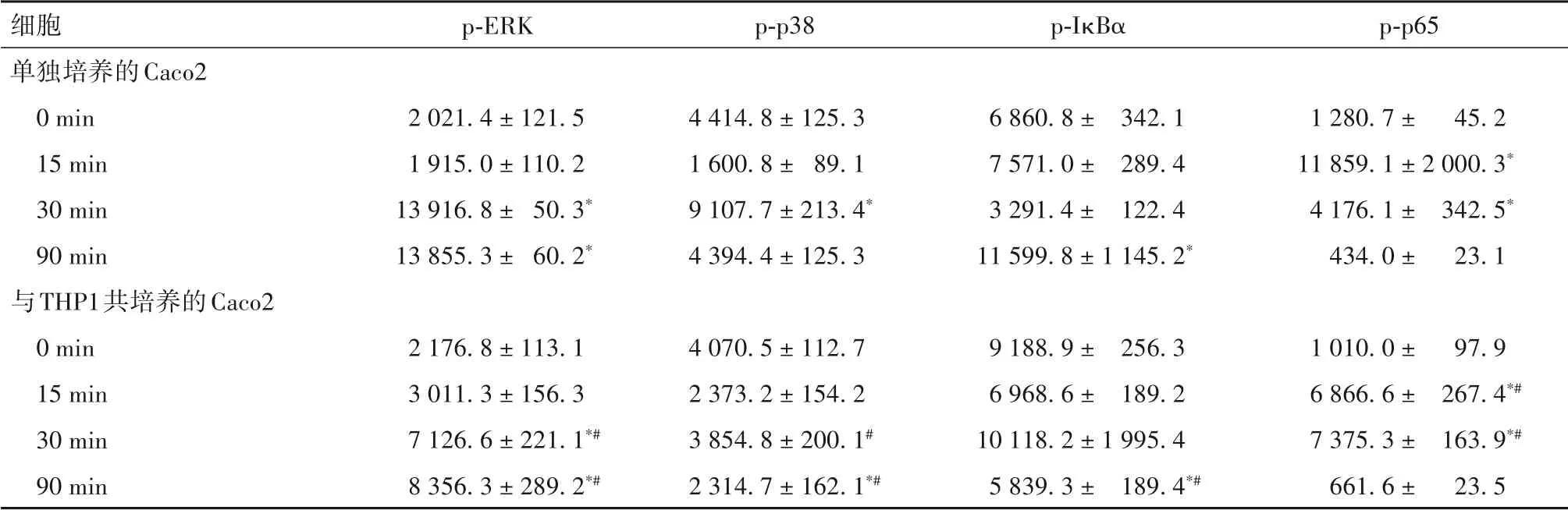
表2 TNF-α刺激下單獨或與THP1共培養后的Caco2細胞MAPK、NF-κB通路相關蛋白表達比較(-x ± s)
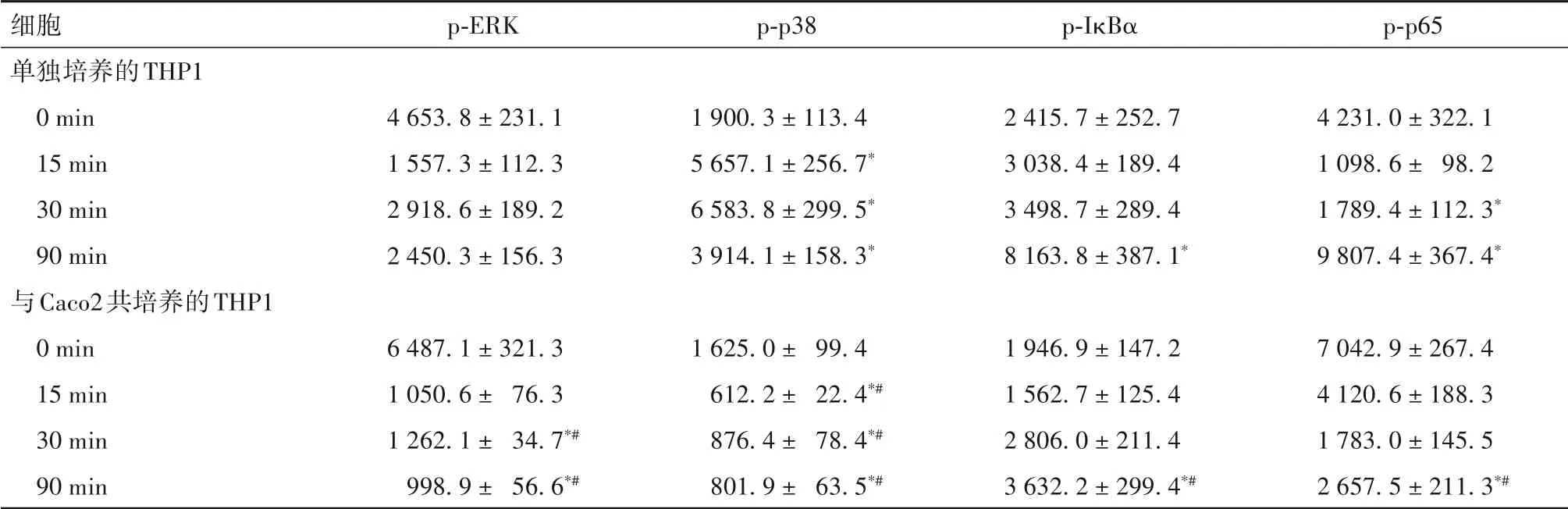
表3 TNF-α刺激下單獨或與Caco2共培養后的THP1細胞MAPK、NF-κB通路相關蛋白表達比較(-x ± s)
2.2 TNF-α刺激下單獨或共培養后的HCA7、THP1細 胞MAPK、NF-κB通路相關蛋白表達比較 見表4、5。
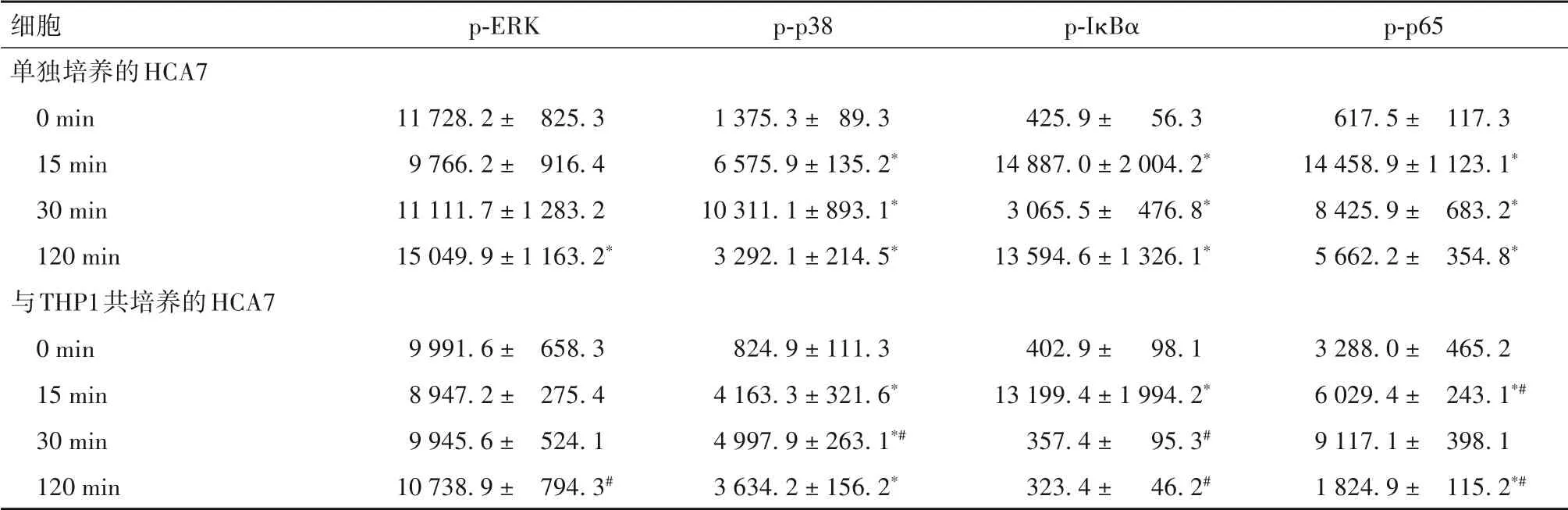
表4 TNF-α刺激下單獨或與THP1共培養的HCA7細胞MAPK、NF-κB通路相關蛋白表達比較(-x ± s)
2.3 兩組細胞MAPK、NF-κB 通路相關蛋白表達比較 見表6。
表6 兩組細胞MAPK、NF-κB通路相關蛋白表達比較(± s )
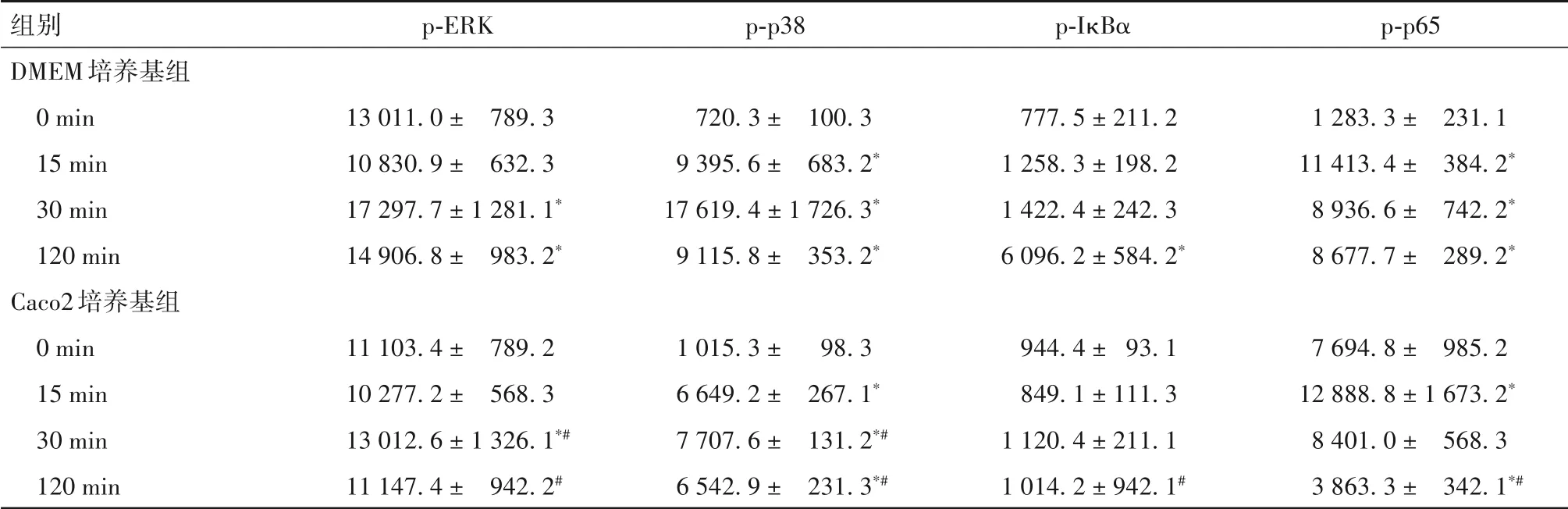
表6 兩組細胞MAPK、NF-κB通路相關蛋白表達比較(± s )
注:與同組刺激0 min比較,*P<0.05;與DMEM培養基組刺激相同時間比較,#P<0.05。
組別DMEM培養基組0 min 15 min 30 min 120 min Caco2培養基組0 min 15 min 30 min 120 min p-ERK 13 011.0 ± 789.3 10 830.9 ± 632.3 17 297.7 ± 1 281.1*14 906.8 ± 983.2*11 103.4 ± 789.2 10 277.2 ± 568.3 13 012.6 ± 1 326.1*#11 147.4 ± 942.2#p-p38 720.3 ± 100.3 9 395.6 ± 683.2*17 619.4 ± 1 726.3*9 115.8 ± 353.2*1 015.3 ± 98.3 6 649.2 ± 267.1*7 707.6 ± 131.2*#6 542.9 ± 231.3*#p-IκBα 777.5 ± 211.2 1 258.3 ± 198.2 1 422.4 ± 242.3 6 096.2 ± 584.2*944.4 ± 93.1 849.1 ± 111.3 1 120.4 ± 211.1 1 014.2 ± 942.1#p-p65 1 283.3 ± 231.1 11 413.4 ± 384.2*8 936.6 ± 742.2*8 677.7 ± 289.2*7 694.8 ± 985.2 12 888.8 ± 1 673.2*8 401.0 ± 568.3 3 863.3 ± 342.1*#
2.4 兩組細胞IL-8、IL-6、IL-1β、CCL2、CCL3 mRNA表達比較 見表7。
表7 兩組細胞IL-8、IL-6、IL-1β、CCL2、CCL3 mRNA相對表達量比較(± s )
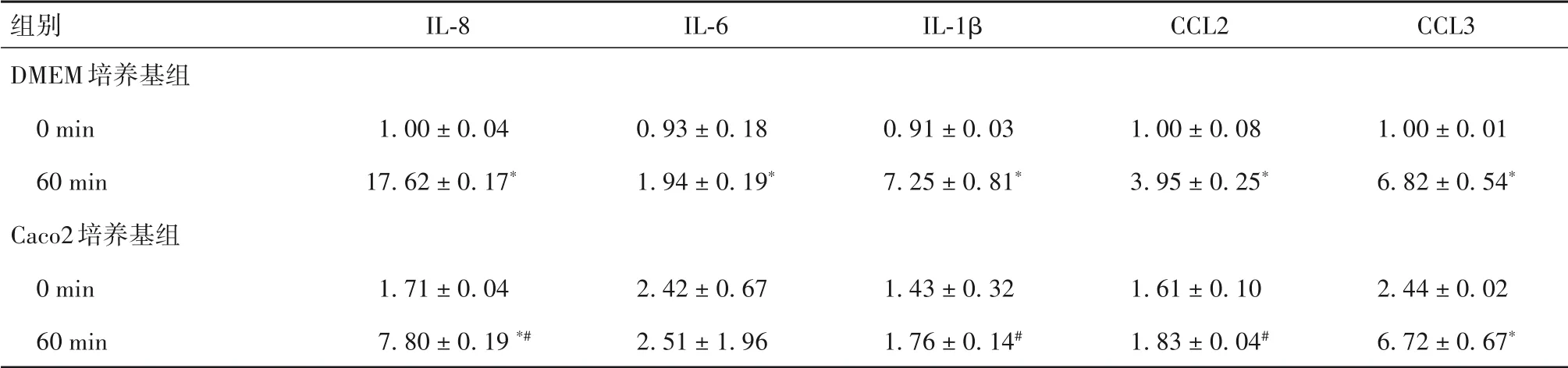
表7 兩組細胞IL-8、IL-6、IL-1β、CCL2、CCL3 mRNA相對表達量比較(± s )
注:與同組刺激0 min比較,*P<0.05;與DMEM培養基組刺激相同時間比較,#P<0.05。
組別DMEM培養基組0 min 60 min Caco2培養基組0 min 60 min IL-8 1.00 ± 0.04 17.62 ± 0.17*1.71 ± 0.04 7.80 ± 0.19 *#IL-6 0.93 ± 0.18 1.94 ± 0.19*2.42 ± 0.67 2.51 ± 1.96 IL-1β 0.91 ± 0.03 7.25 ± 0.81*1.43 ± 0.32 1.76 ± 0.14#CCL2 1.00 ± 0.08 3.95 ± 0.25*1.61 ± 0.10 1.83 ± 0.04#CCL3 1.00 ± 0.01 6.82 ± 0.54*2.44 ± 0.02 6.72 ± 0.67*
3 討論
目前關于IBD、類風濕關節炎(RA)等自身免疫性疾病的研究大多關注于炎癥反應嚴重階段,治療手段僅起到抑制炎癥、緩解癥狀的作用,并不能根治疾病[7]。在正常健康的腸道中,由于抗原負荷巨大,接觸抗原的腸道上皮和黏膜抗原提呈細胞(APC)在穩定狀態下維持一種致敏或低反應狀態,從而維持黏膜穩態[8]。尋找上皮細胞和巨噬細胞在維持黏膜穩態這一過程中發揮調節作用的關鍵分子或許能給治療IBD、RA等自身免疫性疾病帶來新的希望。
TNF-α主要由活化的巨噬細胞分泌,與RA、IBD等多種疾病的發生發展密切相關[9-10]。研究表明,某些藥物可以通過作用于TNF-α 下游的MAPK 和NFκB 通路,而發揮抑制巨噬細胞活化的抗炎作用[11]。本研究通過低劑量TNF-α 刺激,模擬腸道穩態中的微炎癥反應狀態,同時模擬體內兩種細胞空間分布,構建共培養體系,以探究此環境下細胞內相關信號通路的激活機制。結果發現,TNF-α 刺激單獨培養的上皮細胞Caco2、HCA7后,MAPK和NF-κB通路相關蛋白均在對應時間點上調;與HCA7 互相作用的THP1細胞中檢測的NF-κB通路蛋白是IκBα、p-p65,IκBα 是p-IκBα 的前體蛋白,單獨培養時IκBα 在120 min 表達降低,提示有相當一部分轉化為p-IκBα;而將Caco2、HCA7和THP1在Transwell體系中共培養后,Caco2、HCA7 細胞中代表通路激活的磷酸化關鍵蛋白表達均被抑制,與HCA7 共培養的THP1細胞IκBα 在120 min時的表達并未降低,提示IκBα轉化為p-IκBα的過程受抑制;以上均提示上皮細胞和巨噬細胞能相互交流,并可通過某種方法抑制對方MAPK、NF-κB 通路的激活。腸上皮細胞與黏膜免疫細胞間的交流方式包括可溶性介質介導、胞間直接接觸及胞間連接等[12],探究細胞間溝通方式,有助于尋找它們相互調節的靶點。因此,在下一階段試驗中,我們收集了Caco2 條件培養基與THP1
共培養,結果發現MAPK 和NF-κB 兩條通路的激活仍被抑制;這說明Caco2 在正常狀態下能分泌一種或多種可溶性介質,以抑制微炎癥狀態下巨噬細胞的免疫應答,實現對無害抗原的耐受。
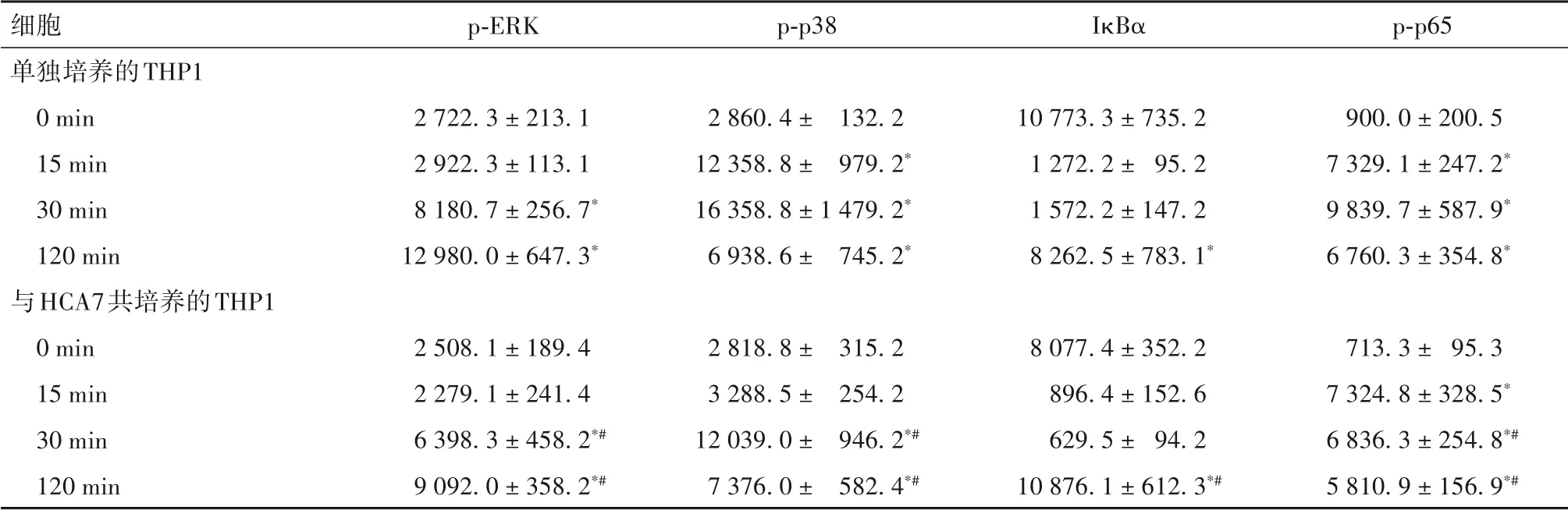
表5 TNF-α刺激下單獨或與HCA7共培養后的THP1細胞MAPK、NF-κB通路相關蛋白表達比較(-x ± s)
IL-8、CCL2、IL-1β、IL-6 及CCL3 均是由巨噬細胞、上皮細胞等分泌的,可以募集炎癥細胞浸潤的趨化因子或者促進炎癥的細胞因子[13]。IBD 患者腸組織中巨噬細胞數量明顯增加,且分泌大量細胞因子及生物活性物質,如IL-1、IL-6 等。腸道巨噬細胞能夠介導炎癥反應,其過度活化會引起炎癥反應的調控失衡[14-15]。MCP1 即單核細胞趨化蛋白1,又稱CCL,包括CCL2、CCL3 等,與趨化性細胞因子、IL-8均可由炎癥介質刺激的單核巨噬細胞、成纖維細胞、黏膜上皮細胞分泌,主要功能是引起由巨噬細胞介導的慢性炎癥,在黏膜感染、急慢性炎癥和超敏反應中發揮重要作用[16]。本研究結果顯示,DMEM 培養基組在TNF-α 刺激60 min 后細胞IL-8、IL-6、IL-1β、CCL2、CCL3 mRNA 相對表達量均升高,但Caco2 培養基組在TNF-α 刺激60 min 后細胞IL-8、IL-1β、CCL2 mRNA 相對表達量較DMEM 培養基組均明顯降低。上述結果提示,上皮細胞可以分泌可溶性介質抑制巨噬細胞分泌促炎因子,減少募集其他免疫細胞。本研究中,Caco2 培養基組在TNF-α 刺激60 min 后 細 胞IL-6、CCL3 mRNA 相 對 表 達 量 與DMEM 培養基組比較均無明顯差異。最新研究發現,肌細胞可分泌IL-6調控肌動蛋白,肌肉收縮時IL-6可起到抗炎效果[17-18],腸上皮內包含平滑肌纖維,可能是導致本研究兩組IL-6表達無差異的原因之一。
綜上所述,微炎癥環境中腸上皮細胞Caco2、HCA7 和巨噬細胞THP1 共培養后各細胞MAPK 和NF-κB 通路激活及促炎因子分泌均被抑制,從而實現對腸道無害抗原的耐受;該抑制作用不依賴于細胞間直接接觸,而是通過分泌可溶性介質介導。本研究對固有免疫系統維持腸道穩態的免疫耐受機制提供了新的見解,下一步擬用超濾管對條件培養基中不同大小的可溶性介質進行篩選,為臨床治療自身免疫性疾病提供新方法。

