齒科研磨粉塵致大鼠肺組織損傷的實驗研究
劉 名,王 蔚*,侯玉明,艾紅軍
(1.中國醫科大學口腔醫學院 附屬口腔醫院,遼寧省口腔疾病重點實驗室,沈陽 110002;2.紹興市中心醫院,浙江 紹興 312000)
近年來粉塵污染越來越引起人們的關注,長期接觸粉塵的作業人員,當吸入的粉塵量達到一定數量時即可引發塵肺病、鼻炎、咽炎、支氣管炎、皮疹、眼結膜損害等[1-2]。粉塵污染同時也存在于口腔行業,診療過程中牙體組織的切除、修復材料的調磨,氣槍、水槍、高速手機及低速手機產生的氣霧、飛沫、塵埃等均會對周圍環境造成污染[3]。
鈷鉻鉬合金(商品名:維他靈Vitallium)、二氧化鋯(zirconiumdioxide, ZrO2)全瓷、PMMA(polymethyl methacrylate)樹脂等修復材料在口腔領域廣泛應用,Vitallium主要應用于可摘局部義齒金屬支架,ZrO2全瓷主要應用于單冠、嵌體冠及固定橋的修復,而PMMA樹脂為全口義齒及基托的重要組成部分,修復體材料在制作及調磨過程中會產生不同形狀及大小的粉塵。Vitallium粉塵顆粒主要由鈷、鉻、鉬、鐵組成,其中鈷鉻鉬的合金含量高達97%以上,研究表明,長期的鈷鉻鉬暴露會引起以化痰、流涕為主的呼吸道疾病及肺組織損傷甚至肺纖維化[4-6]。ZrO2組粉塵顆粒的主要元素為硅、氧、鉀、鋁、鈉,主要成分為二氧化硅,長期吸人二氧化硅粉塵會引起肺部組織的慢性疾病,有研究表明口腔修復診室中飾面瓷粉塵的時間加權平均容許濃度為0.393 mg/m2,超出國家安全范圍[2];且已有齒科二氧化硅致矽肺、肺部多發性肉芽腫伴淀粉樣沉積的病例報道[7-9]。PMMA組的粉塵顆粒主要元素為碳和氧,為有機粉塵,長期暴露于PMMA環境下可導致機體產生皮膚炎癥、刺激眼睛或粘膜、過敏性皮炎、哮喘、中樞和周圍神經系統疾病及過敏性肺炎等呼吸系統損傷[10-12]。
目前關于齒科研磨粉塵對健康影響的研究多局限于病例報道及流行病學調查,針對口腔修復診室,調磨、修改義齒過程中產生的粉塵污染問題研究較少,尚缺乏建立統一的動物模型進行系統的定性定量的分析研究,本研究使用掃描電鏡(scanning electron microscope,SEM)及激光粒度分析儀(particulate size description analyser,PSDA)作為檢測手段分析齒科研磨粉塵及精細研磨粉塵顆粒的表面形態及粒徑大小,通過非暴露式氣管染塵法建立齒科粉塵大鼠染塵模型,用吉姆薩染色(Giemsa)及酶聯免疫吸附測定法(ELISA)檢測染塵大鼠支氣管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)中炎癥細胞的數量變化及白細胞介素-6(interleukin-6,IL-6),白細胞介素-16(interleukin-16,IL-16)水平的變化,同時應用HE染色觀察肺組織切片病理改變,旨在探討齒科粉塵對大鼠肺組織是否產生潛在影響,為今后進一步研究齒科粉塵暴露對機體健康影響提供理論基礎,同時也為齒科臨床防塵保護提供依據。
1 材料和方法
1.1 實驗動物
雄性SPF級Wistar大鼠,8周齡,63只,體重(250±10)g,由沈陽陸軍總院實驗動物中心提供[SCXK(遼)2015-0001],飼養于沈陽陸軍總院實驗動物中心[SYXK(遼)2018-0008],實驗研究過程遵守“3R”原則,并通過沈陽軍區總醫院實驗動物倫理委員會倫理審查(2015042)。
1.2 主要試劑與儀器
甲苯(國藥公司,中國);蘇木精(國藥公司,中國);曙紅Y,醇溶(國藥公司,中國);大鼠白介素酶聯免疫分析試劑盒(上海臥宏,中國)。Ⅱ型自凝模型粉及義齒基托樹脂液劑(上海珊瑚齒科材料有限公司,中國);Vitallium金屬(登氏柏公司,美國);ZrO2體瓷(VITA公司,德國);SSX-550掃描電子顯微鏡(島津公司,日本);電子顯微鏡(LUMPUS公司,日本);能量分散光譜儀(島津公司,日本);Master sizer Macro激光粒度分析儀(Malvern公司,英國);-30℃恒冷低溫切片機(Cleica,德國)。
1.3 實驗方法
1.3.1 齒科研磨粉塵的制備
將Vitallium金屬、ZrO2體瓷、PMMA樹脂制備成14 mm×14 mm×3 mm的實驗模塊,用金剛砂車針調磨處理,收集調磨后的粉塵顆粒各10 g,平均分為兩組,隨機選取其中一組粉塵,分別在瑪瑙研缽中研磨2 h致粉塵顆粒變小。
1.3.2 掃描電子顯微鏡觀察
取齒科研磨粉塵顆粒各樣本,分別固定于載物臺上真空中噴鍍金膜,應用SEM對各組樣本進行觀察檢測。
1.3.3 激光粒度分析儀檢測
取齒科研磨粉塵顆粒各樣本,分別置于激光粒度分析儀的樣品槽內,在網兜處加入鋼球后進行PSDA測量分析。
1.3.4 實驗動物分組
將大鼠隨機分成7組,每組又分為三個時間點共9只:對照組(N,不染塵,生理鹽水組)、實驗組齒科材料顆粒未研磨PMMA組(A1)、未研磨Vitallium組(B1)、未研磨ZrO2組(C1)、和精細研磨PMMA組(A2)、精細研磨Vitallium組(B2)、精細研磨ZrO2組(C2),每組的實驗周期均為3周、6周、12周。
1.3.5 實驗大鼠非暴露式氣管染塵
將未研磨組與精細研磨組粉塵,分別溶于生理鹽水中配成濃度5 g/100 mL懸液,高溫高壓滅菌,加入800000 U青霉素備用。將大鼠麻醉、固定、氣管插管,插入穿刺針至主支氣管上方約1 cm處,回抽注射器可見氣泡且回抽時無阻力,確認已插入氣管內,將1 mL實驗組懸液及對照組不染塵生理鹽水分別打進大鼠雙肺中,染塵后的大鼠,應盡快從染塵架上取下來,并給予心肺復蘇。
1.3.6 實驗大鼠肺泡灌洗液收集及細胞計數
分別于術后3周、6周、12周,大鼠進行麻醉處死,分離氣管至肺組織完全暴露,在氣管離心端做一橫行切口,用注射器吸取2 mL預冷的生理鹽水,通過導管以較小的壓力將鹽水緩慢注入肺內,見肺逐漸膨隆、蒼白,立即緩慢回抽灌洗液,再將所得液體緩緩注回肺內,反復2次,置于離心管中冷凍離心2000 r/min 10 min,分離上清液和細胞,使用0.1 mL預冷的PBS重懸細胞,吹勻后,吸取10μL細胞懸液,滴加在細胞計數板上,顯微鏡下行白細胞總數計數;另吸取10μL細胞懸液,制成細胞涂片,甲醇固定后進行Giemsa液染色,顯微鏡下觀察細胞形態,并進行細胞分類計數。
1.3.7 ELISA檢測肺泡灌洗液中IL-6、IL-16濃度
按照ELISA試劑盒說明書,依次梯度稀釋標準品蛋白,并進行加樣、溫育、洗滌、加酶、再次溫育、洗滌、顯色、終止,最后在450 nm波長測定各孔吸光度(OD值),并用空白孔調零,以標準品的濃度為橫坐標,調零后的OD值為縱坐標,繪制標準曲線,由標準曲線計算出待測樣品濃度。
1.3.8 肺組織HE染色
打開大鼠胸腔,將大鼠全肺取出將肺剔除氣管、支氣管結締組織及心臟,在生理鹽水內漂洗1次,用濾紙吸干。將整個肺用10%中性緩沖福爾馬林液固定,石蠟包埋,切片厚度為5μm,HE染色,普通光鏡下觀察肺組織病理變化。
1.4 統計學方法
實驗數據應用SPSS 21.0軟件進行統計分析,數據以平均數±標準差(±s)表示,組間比較采用單因素方差分析,兩組間比較采用t檢驗,P<0.05為差異有顯著性。
2 結果
2.1 SEM觀察結果
六組不同齒科粉塵顆粒的表面形態有明顯差異(圖1),PMMA組(圖1A1、A2)顆粒呈團塊狀,大小不一,尺寸相差較大,表面形態不規則;Vitallium組(圖1B1、B2)顆粒較大,形狀不規則,呈薄片狀、卷曲波紋狀結構;ZrO2組(圖1C1、C2)粉塵顆粒相對較小,邊緣銳利,呈團塊狀不規則結構。精細研磨后粉塵顆粒明顯變小,除PMMA精細研磨組(圖1A2)粉塵表面圓鈍外其余兩組形態無明顯改變。

圖1 齒科材料研磨粉塵顆粒的SEM觀察Note.A1,PMMA non-grinding group.A2,PMMA fine grinding group.B1,Vitallium non-grinding group.B2,Vitallium fine grinding group.C1,ZrO2 non-grinding group.C2,ZrO2 fine grinding group.Figure 1 SEM observation of dental dust particles
2.2 激光粒度分析結果
三組不同齒科材料及精細研磨后粉塵顆粒的粒徑分布結果(表1、圖2),三種齒科研磨粉塵的粒徑分布均不同,且分布范圍較為廣泛,精細研磨后粉塵粒徑不同程度減小。
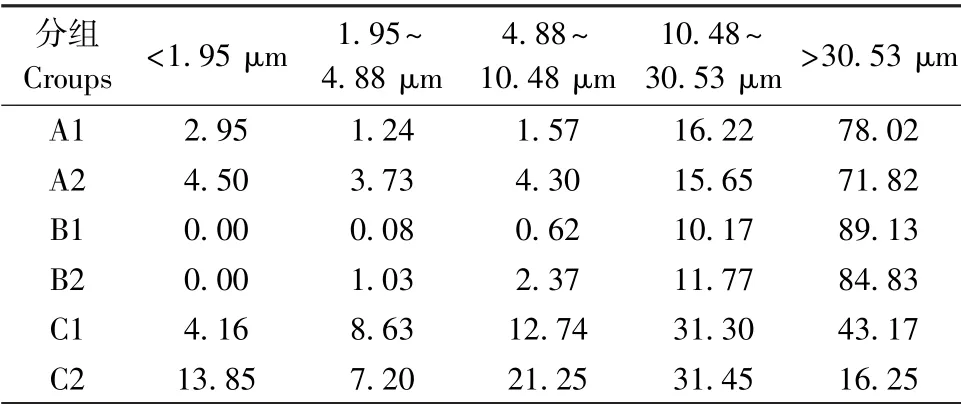
表1 未研磨及精細研磨后粉塵顆粒的粒徑分布(%)Table 1 Particle size distribution of non-grinding dust and fine grinding dust

圖2 未研磨及精細研磨后粉塵顆粒的粒徑分布曲線Note.A1,PMMA non-grinding group.A2,PMMA fine grinding group.B1,Vitallium non-grinding group.B2,Vitallium fine grinding group.C1,ZrO2 non-grinding group.C2,ZrO2 fine grinding group.Figure 2 Particle size distribution curves of non-grinding dust and fine grinding dust
2.3 支氣管肺泡灌洗液的炎癥細胞染色圖片及計數
2.3.1 大鼠BALF中炎癥細胞Giemsa染色圖片
如圖3所示,紅色箭頭所示為中性粒細胞,其特點為細胞圓形,胞漿粉紅色,核形不一,細胞核常染成深紫紅色;綠色箭頭所示為巨噬細胞,其特點為胞體圓形,胞質疏松、淡染,呈淡藍色;黃色箭頭所示為淋巴細胞,其特點為細胞核占細胞體積大且致密,胞漿極少,常染成深藍色至藍色。與不染塵生理鹽水的對照組相比,未研磨及精細研磨染塵組在3周、6周、12周的BALF中白細胞總數均明顯增高,且隨染塵時間的延長,細胞數量的增加越明顯。

圖3 不同觀察時點各染塵組及對照組Giemsa染色圖Note.N,Control group.A1,PMMA non-grinding group.A2,PMMA fine grinding group.B1,Vitallium non-grinding group.B2,Vitallium fine grinding group.C1,ZrO2 non-grinding group.C2,ZrO2 fine grinding group.Red arrow,Neutrophil.Green arrow,macrophage.Yellow arrow,lymphocyte.Figure 3 Giemsa staining in dust exposed group and control group at different observation time points
2.3.2 大鼠BALF中白細胞總數的改變
將Giemsa染色結果進行白細胞總數計數后,如圖4所示,與不染塵生理鹽水的對照組比,未研磨及精細研磨染塵組在3周、6周、12周的BALF中白細胞總數均明顯增高,并具有統計學意義(P<0.05),且隨染塵時間的延長,細胞數量的增加越明顯;與未研磨組比,從第6周起,除12周C2組外其余各精細研磨組白細胞數量均明顯高于未研磨組,差異具有統計學意義(P<0.05)。
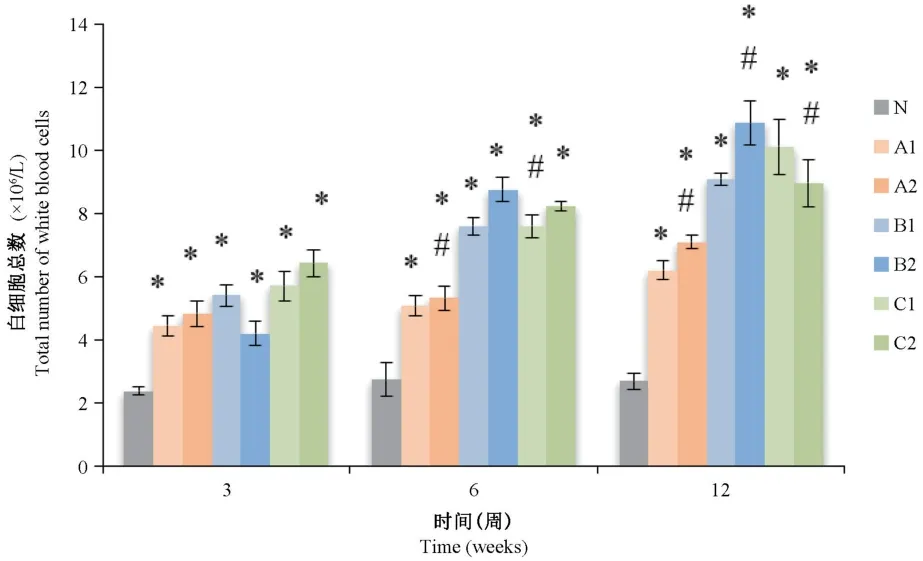
圖4 各組大鼠BALF白細胞總數變化情況Note.N,Control group.A1,PMMA non-grinding group.A2,PMMA fine grinding group.B1,Vitallium non-grinding group.B2,Vitallium fine grinding group.C1,ZrO2 non-grinding group.C2,ZrO2 fine grinding group.Dust group compared with the control group,*P<0.05.Fine grinding group compared with the non grinding group,#P<0.05.The same as below.Figure 4 Total number of white blood cells in BALF of rats in each group
2.3.3 大鼠BALF中巨噬細胞數量改變
將Giemsa染色結果進行巨噬細胞計數后,如圖5所示,與對照組相比,研磨及精細研磨染塵組在3周、6周、12周的BALF中巨噬細胞數量明顯增高,并具有統計學意義(P<0.05);與未研磨組相比,從第6周開始,除12周C2組外其余各精細研磨組巨噬細胞數量均明顯高于未研磨組,差異有統計學意義(P<0.05)。
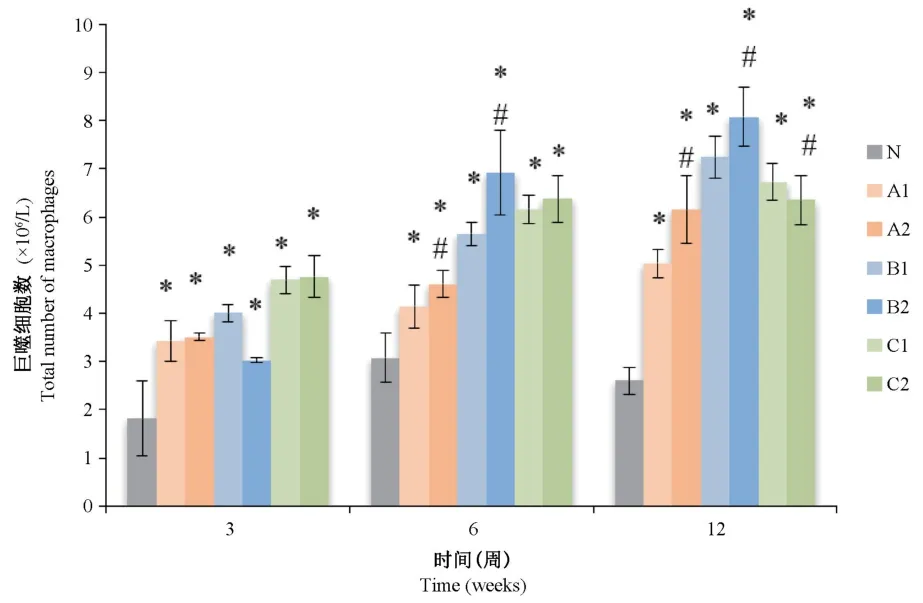
圖5 各組大鼠BALF巨噬細胞總數變化情況Figure 5 Total number of macrophages in BALF of rats in each group
2.4 支氣管肺泡灌洗液中IL-6、IL-16含量
2.4.1 大鼠BALF中IL-6含量
如圖6所示,與對照組相比,染塵組BALF中IL-6含量均增高,12周時明顯增高,除6周A1,A2組外,其余組差異均具有統計學意義(P<0.05);與未研磨組相比,精細研磨組在各時間點BALF中IL-6含量均增高,12周時B2組相比于B1組,C2組相比于C1組,差異有統計學意義(P<0.05)。

圖6 各組大鼠BALF中IL-6含量Figure 6 IL-6 content in BALF of rats in each group
2.4.2 大鼠BALF中IL-16含量
如圖7所示,與對照組相比,染塵組BALF中IL-16含量均增高,除6周A1,A2組外,其余組差異均具有統計學意義(P<0.05);與未研磨組相比,精細研磨組在各時間點BALF中IL-16含量均增高,12周時B2組相比于B1組,C2組相比于C1組,差異有統計學意義(P<0.05)。

圖7 各組大鼠BALF中IL-16含量Figure 7 IL-16 content in BALF of rats in each group
2.5 肺組織切片病理變化
HE染色結果如圖8所示,對照組(圖8A)肺組織3周時有少量炎細胞浸潤,結構無明顯改變,6周及12周肺組織結構完整,清晰,肺泡壁連續。而各染塵組(圖8B、8C、8D)3周時可見少量炎細胞浸潤,6周炎細胞浸潤增多,肺泡間隔增寬,肺泡壁被破壞,12周肺組織破壞明顯,肺泡結構紊亂,肺泡腔及間質內大量炎性細胞浸潤,纖維化形成;其中,C2組在6周即出現纖維樣改變。

圖8 不同觀察時點各染塵組及對照組肺組織變化Note.A,N,Control group.B,A1,PMMA non-grinding group.A2,PMMA fine grinding group.C,B1,Vitallium non-grinding group.B2,Vitallium fine grinding group.D,C1,ZrO2 non-grinding group.C2,ZrO2 fine grinding group.Figure 8 Changes of lung tissue in dust exposed group and control group at different observation time points
3 討論
不同粒徑的粉塵引發的機體生物學毒性差異顯著,粉塵粒徑大小決定了其在人體呼吸系統內沉積的位置及對人體健康的危害程度[13-14]。研究表明,大于10μm的粉塵可沉積在鼻咽和氣管支氣管的呼吸道區域,10~0.1μm的粉塵有90%可沉積于人體呼吸道和肺泡上,5~0.5μm的粉塵沉積率隨粒徑的減小而逐漸降低,而0.4μm以下的粉塵隨粒徑減小沉積率增大,其中粒徑小于2.5μm的粉塵主要沉積在肺泡,更易導致機體的損傷[15-16]。鑒于粉塵收集過程中環境無法達到絕對密閉,打磨過程中產生的小粒徑粉塵,易懸浮在空氣中無法收集,且懸浮于空氣中的小粒徑粉塵顆粒更易被吸入,故本實驗采用研磨精細研磨收集的粉塵,以模擬臨床上產生的小粒徑粉塵,本實驗結果也表明,精細研磨后Vitallium及ZrO2粉塵較研磨前,對大鼠肺組織炎性損傷更強。
中性粒細胞、巨噬細胞、淋巴細胞等炎癥細胞的遷移和活化為肺部損傷的主要炎癥性免疫反應,支氣管肺泡灌洗液中粒細胞的增多,被認為與肺纖維化密切相關,它的大量出現是肺細胞損傷的標志[17-19],巨噬細胞是粉塵作用的主要靶細胞,巨噬細胞的活躍在肺損傷以及纖維化過程中發揮重要作用[20]。本實驗中大鼠染塵后白細胞及巨噬細胞數量高于對照組(P<0.05),除了12周C2組外,從6周開始精細研磨組的白細胞及巨噬細胞含量均高于未研磨組,其中12周B2組炎癥反應最為明顯,說明Vitallium粉塵研磨后致炎作用更強,而C2組白細胞及巨噬細胞數量在6周時明顯高于C1組,但12周時低于C1組,表明C2組染塵后期炎細胞表達有所降低,可能與其早期就有纖維化的形成有關,本實驗結果與HE染色中C2組(圖7)在早期就觀察到纖維組織形成結果一致,并提示精細研磨后ZrO2粉塵對大鼠肺組織早期炎性作用明顯。
隨著炎癥的發展,巨噬細胞吞噬粉塵顆粒,細胞活化并產生大量炎性因子,白介素作為一種重要的細胞因子,在調控塵肺炎癥和纖維化過程中發揮了重要的作用,其中IL-6能促使黏附分子浸潤到肺中,誘導膠原的合成,抑制膠原的降解[21],研究發現,細胞因子IL-6在患有肺纖維化的小鼠和人類中明顯升高[22],IL-6等促炎細胞因子的增加以及中性粒細胞內流是肺囊性纖維化炎癥的顯著早期特征[23]。IL-16又稱淋巴細胞趨化因子,Zhou等[24]發現IL-16在小鼠肺損傷及纖維化過程中明顯增高,Glass等[25]發現,在博來霉素引起的大鼠肺纖維化中IL-16發揮了重要作用,可以作為一種肺纖維化的候選指標。本實驗中染塵大鼠BALF中IL-6與IL-16含量變化趨勢一致,各染塵組12周IL-6與IL-16的含量較3周、6周時增加更明顯,可能與12周時,肺組織結構逐漸纖維化有關[23-25],IL-6與IL-16的變化說明3種齒科粉塵對大鼠肺組織均有損傷,可導致大鼠早期肺炎癥反應及早期纖維化改變,與HE染色結果相符。12周時Vitallium及ZrO2粉塵精細研磨組與未研磨組相比,IL-6與IL-16含量存在統計學差異,說明Vitallium及ZrO2粉塵經精細研磨后對大鼠肺組織的損傷作用及早期纖維化作用增強。
綜上所述,Vitallium金屬、ZrO2全瓷、PMMA樹脂3種齒科粉塵研磨前后,均能引起染塵大鼠肺組織炎性損傷,齒科臨床醫師長期暴露于齒科粉塵顆粒環境下可能會引起肺組織炎癥甚至損傷,金屬及瓷粉粉塵粒徑越小其致病力可能越強,具體損傷機制及程度,有待進一步研究。

