Ni離子螯合親和層析法分離大葉海藻中的抗氧化多肽
余科義,徐禮龍,畢靜
1. 河南應用技術職業學院(鄭州 450042);2. 固始縣農產品質量安全檢測中心(信陽 465200)
海藻是海產藻類的統稱,雖然是海洋中的低等生物,卻是海洋中有機營養物資的主要生產者。海藻除富含蛋白質、維生素、礦物質和ω-3系列不飽和脂肪酸以外,還可生成獨有的代謝性化合物(褐藻多酚、巖藻黃質等)[1-2]。大葉海藻屬馬尾藻科,是海藻中一種生長在淺海區域的品種,能夠進行充分的光合作用與生物代謝活動,在藥理活性上,具有降血脂、抗氧化、抗菌、增強免疫力等的功效,可作為營養品、化妝品、功能性食品及潛在藥物資源等進行應用和開發,提高海藻的資源化優勢[3-4]。
金屬螯合親和層析技術(MCAC)是近年來出現的主要針對生物大分子分離純化的一種新型親和層析技術,一般層析介質的結構由固相基質、螯合配基、金屬離子組成,可用于蛋白質的分離純化、活性酶的純化及核苷酸的純化等。尤其在蛋白質方面的應用,MCAC除了能夠分離純化以外,還可以實現蛋白質的識別和鑒定、蛋白質的定向固定及蛋白質的復性純化。因而在生物科技及醫學檢測中尤為重視[5-6]。試驗擬用Ni2+螯合海藻中的抗氧化多肽后經親和層析柱分離提取,從而保證抗氧化多肽的高純度和優良的活性。
1 材料與方法
1.1 材料、試劑和儀器
大葉海藻(正禾生物科技有限公司);NaHCO3(濟南明星化工有限公司);丁醇(山東諾爾化工有限公司);IDA(湖北遠成賽創科技有限公司);殼聚糖(南京松冠生物科技有限公司);CH3COOK(廣州三鑫化工有限公司);span 60(江蘇海安石油化工廠);Na2S2O3(鄭州欣茂化工產品有限公司);CH3COOH(南京化學試劑股份有限公司);NiSO4(武漢宏信康精細化工有限公司);NH4Cl、NH3·H2O(太原安業化工有限公司)。
JFM-12細胞破壁機(濟南健辰機械有限公司);DT-5離心機(廣東佛衡儀器有限公司);索式提取器(上海歡奧科技有限公司);LYZ-111B培養搖床(上海新諾儀器設備有限公司);UV-1800紫外可見分光光度計(愛來寶醫療科技有限公司)。
1.2 大葉海藻的預處理
將大葉海藻進行細胞壁破碎后浸于5% NaHCO3溶液2 d,抽濾留取沉淀物,參照文獻[7]對沉淀物進行甲酯化處理后離心脫去。剩余的沉淀物置于丁醇溶劑中進行浸提,采用索式提取器重復3次對浸提液純化,得到大葉海藻的多肽粗提取液。
1.3 Ni2+螯合親和層析柱的制備[8]
選用IDA-殼聚糖作為層析柱填料。對殼聚糖進行預處理,將殼聚糖溶解于5%的CH3COOK溶液中,加入2 mL span60和20 mL Na2S2O3溶液(質量分數5%)。形成殼聚糖微球后在50 ℃恒溫水浴中加入CH3COOH溶液脫除Na2S2O3。離心沉淀后取出沉淀微球,并置于氯仿中浸泡2 h,乙醇清洗并去離子水洗后與IDA在搖床中反應生成IDA-殼聚糖微球。將此IDA-殼聚糖微球填料裝柱,用0.1 mol/L的NiSO4水溶液充分沖流整個柱體,使得Ni2+被充分吸附于IDA-殼聚糖填料。采用約pH 8.0的NH3·H2O-NH4Cl緩沖溶液平衡層析柱的酸堿性,使之維持在弱堿性環境狀態。
1.4 Ni2+與多肽的螯合親和層析
用緩沖溶液NH3·H2O-NH4Cl調節多肽粗提取液至與層析柱pH相近,勻速將粗提取液倒入層析柱上端,靜置等待樣品與Ni2+在層析介質上充分結合[9]。采用緩沖溶液NH3·H2O-NH4Cl快速洗脫得到分離液,用不同洗脫劑洗脫,洗脫流速控制在2 mL/min,每5 min收集一批洗脫液,將收集的洗脫液再倒入層析柱中反復洗脫3次,得到的洗脫樣品在240 nm下測定吸光度以判斷多肽濃度高低。
1.5 試驗中的相關測定
鎳含量的測定:參照文獻[10],采用乙二胺四乙酸滴定法進行滴定,計算得出鎳含量。并根據式(1)計算出鎳與抗氧化多肽的螯合率。
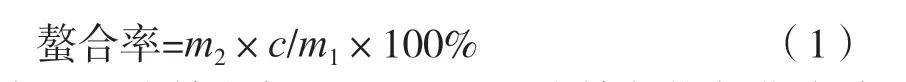
式中:m1為鎳的加入量,g;m2為鎳與抗氧化多肽形成的螯合物質量,g;c為鎳含量,%。
抗氧化多肽的乳化活性測定:參照文獻[11],將抗氧化多肽與不同pH的緩沖溶液配制成0.2%的抗氧化多肽溶液。加入1.0 mL植物油混合混勻后,吸取底部溶液與SDS溶液混合,測得的最大吸光度計為乳化活性。
抗氧化多肽對超氧負離子的清除能力:參照文獻[12],采用鄰苯三酚法。將不同濃度的抗氧化多肽經水浴30 ℃加熱30 min后,加入Tris-HCl緩沖溶液和鄰苯三酚溶液靜置比色。紫外分光光度計每5 min測定1次最大吸光度,繪制最大吸光度變化曲線,經擬合處理,其斜率為抗氧化多肽清除·速率。

抗氧化多肽對羥自由基的清除能力:參照Fenton檢測法[13],在試管中加入抗氧化多肽、FeSO4溶液、H2O2溶液,搖勻后靜置15 min,加入水楊酸溶液,靜置后于480 nm波長處測其最大吸光度,并根據式(3)計算羥自由基的清除率。
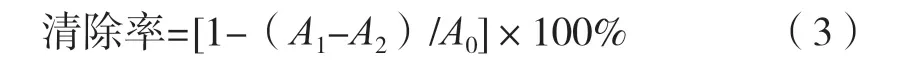
式中:A0為空白對照試驗組吸光度;A1為試驗組吸光度;A2為不添加水楊酸的試驗組吸光度。
2 結果與討論
2.1 不同洗脫劑對抗氧化多肽在親和層析柱上的洗脫影響
圖1為4種不同洗脫劑在濃度均為0.01 mol/L情況下的最大洗脫值對比圖,可以明顯看出,吡啶和甲酸鈉洗脫效果較差,且會影響層析柱的pH環境。NaH2PO4和Na2HPO4的洗脫效果較好,其中,NaH2PO4不僅洗脫效果最好,而且與抗氧化多肽的活性pH范圍相近,因而試驗選用NaH2PO4溶液作為洗脫劑。
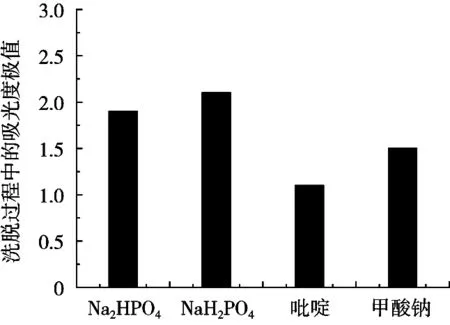
圖1 幾種洗脫劑的洗脫效果對比柱形圖
2.2 抗氧化多肽的洗脫純化
在Ni2+螯合親和層析柱中加入大葉海藻多肽粗提液后,層析柱的洗脫曲線如圖2所示。采用緩沖溶液洗脫得到的第1個峰為雜質洗脫峰,第2個峰為利用NaH2PO4溶液作為洗脫劑進行洗脫的特異性洗脫峰。可以看出2個峰之間的間距時間較長,這樣有利于雜質的脫去而使得多肽的純化效率提升,純化效果提高。具體的抗氧化性多肽的純化效率如表1所示。
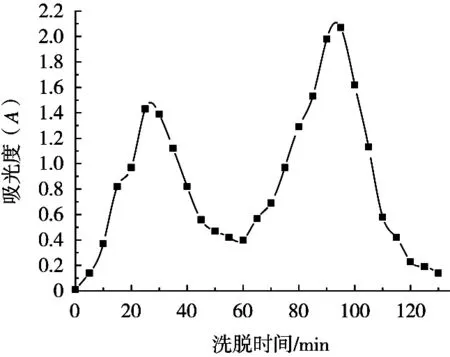
圖2 蛋白質的洗脫曲線

表1 抗氧化多肽的純化效率
2.3 抗氧化多肽-Ni螯合物的組成及螯合率分析
抗氧化多肽與Ni-IDA-殼聚糖-span60形成的螯合物組成成分含量及螯合率測定結果如表2所示。抗氧化多肽與Ni的含量較高,總占比達86.2%,其他成分則包含span60、灰分、鈉鉀鹽等。螯合率超過70%,表明親和層析柱對抗氧化多肽的吸附作用明顯,后續洗脫工藝可以得到純度較高的抗氧化多肽。

表2 螯合物的組成及螯合率測定結果
2.4 層析柱的pH環境對抗氧化多肽乳化活性的影響
層析柱的酸堿性對抗氧化多肽的乳化活性影響變化如圖3所示。在乳化活性測定試驗中,多肽被吸附于油-水交界面形成微膜,多肽鏈端的羧基可與油相互相作用,而氨基則與水相互相作用,從而平衡油-水交界處的平衡,此時利于乳化性能的提升。因此,抗氧化多肽在不同pH環境下的羧基基團和氨基基團數量決定著乳化活性。從圖3可以看出,乳化活性在弱堿性條件下較為活躍,所以試驗中的層析柱pH也應處在弱堿性范圍內。
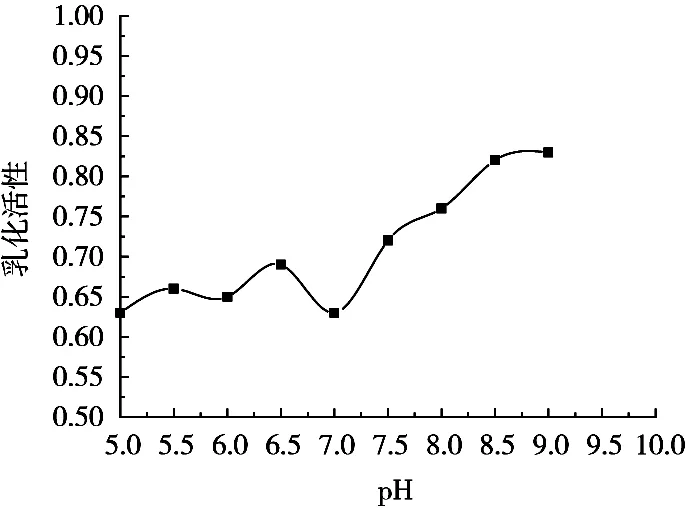
圖3 層析柱的pH對抗氧化多肽乳化活性的影響曲線
2.5 大葉海藻抗氧化多肽的抗氧化活性分析
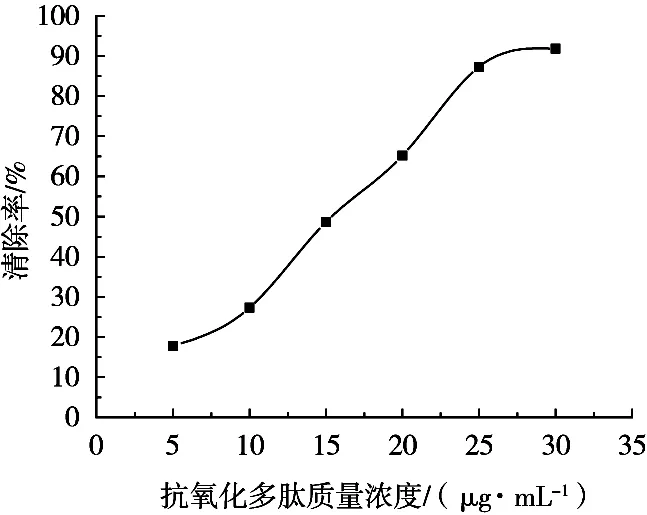
圖4 抗氧化多肽質量濃度對O2-·清除率的關系曲線
2.5.2 對·OH的清除能力
不同質量濃度的抗氧化多肽對·OH的清除率測定結果如圖5所示。大葉海藻中提取出來的抗氧化多肽對·OH的清除率隨著其質量濃度增加而呈現清除率迅速增大的趨勢。推測為抗氧化多肽的鏈段中存在著能與·OH發生二級反應的基團,故初始抗氧化多肽質量濃度較低時引發的·OH遷移速率較慢,一級反應的終產物濃度提升時,決定整個反應速率的二級反應才會顯著加快,提高對·OH的捕捉能力,因而對·OH清除能力在抗氧化多肽質量濃度大于10 μg/mL時明顯增強。
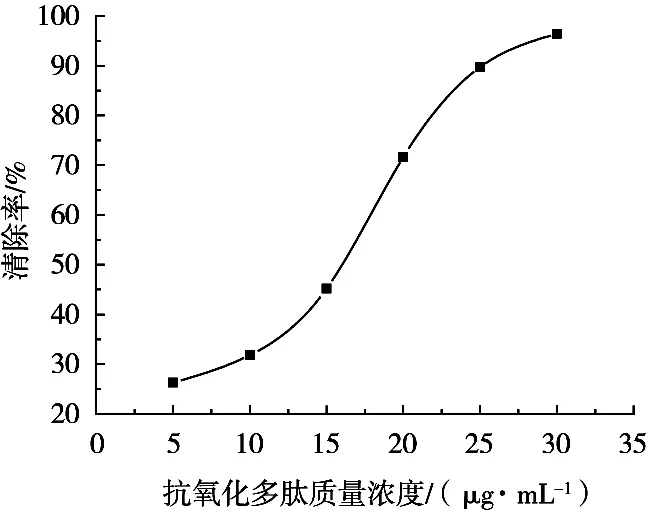
圖5 抗氧化多肽質量濃度對·OH清除率的關系曲線
3 結論
以大葉海藻為原料,采用Ni2+離子親和層析柱擬對海藻中的抗氧化多肽進行分離純化。多肽與Ni2+形成螯合物后,吸附于IDA-殼聚糖-span60組成的層析柱中,經洗脫劑NaH2PO4溶液洗脫后即得純化的抗氧化多肽溶液。比對幾種洗脫劑的洗脫效果,NaH2PO4不僅洗脫效果最好,而且與抗氧化多肽的活性pH范圍相近。抗氧化多肽-Ni螯合物經分析由抗氧化多肽、Ni、IDA-殼聚糖和其他成分組成,抗氧化多肽與Ni總占比86.2%,而螯合率也超過70%。層析柱經緩沖溶液調節約pH 8.5時分離純化效果最佳。洗脫過程中的洗脫曲線會產生雜質洗脫峰和多肽洗脫峰,2個峰之間的間距時間較長,說明層析柱將雜質與多肽互相分離的程度較高。試驗還對抗氧化多肽的抗氧化能力進行探討,抗氧化多肽質量濃度達到30 μg/mL時,對O2-· 和·OH的清除率分別達到91.8%和96%,此時多肽的抗氧化活性較高。

