鹽田鹵水小型自然蒸發實驗
薛玉婷

摘 要:通過實驗確定霍布遜礦區鹽田原鹵自然蒸發的結晶析出順序和光鹵石礦物的最佳分離點,獲得母液中的KCl質量分數等基礎數據,掌握鹽田走水路線和各控制點參數。
關鍵詞:原鹵;自然蒸發;最佳分離點
1?實驗原理
霍布遜礦區鹽湖鹵水化學類型為氯化物型,從KCl等組分的質量分數來看,屬于低鉀高鈉高鎂的鹵水。對該類型鹵水進行自然蒸發實驗,確定鹽類結晶析出順序和光鹵石礦物的最佳分離點,獲得母液中的KCl質量分數等基礎數據[1]。
2?實驗目的
為了更好地指導鹽田生產,選擇合理的固液分離點,對東泵站原鹵鹵水進行實驗室模擬鹽田生產小型蒸發實驗,用以指導鹽田蒸發工作,進一步掌握鹽田走水路線和各控制點參數。
3?實驗器材
3.1? 實驗儀器
燒杯,波美計,分析天平,移液管,量瓶,三角瓶,溫度計,滴定管,布氏漏斗,電子秤,光度計。
3.2? 實驗材料
實驗所用原鹵組分如表1所示。
4 ? 實驗方法
本實驗將同一組分的原鹵鹵水分成兩組,分別進行蒸發實驗。第一組用電子秤準確稱取1 218 g原鹵,置于? ? ? ? ? ? ? ? ?2 000 mL燒杯中;第二組用電子秤準確稱取5 000 g原鹵,置于5 000 mL燒杯中,靜置,在實驗室內有自然光照射的地方進行自然蒸發,定時測定鹵水溫度和密度,觀察蒸發過程中原鹵中鹽類結晶析出的變化,當波美度升至30.5? °Be′時,先稱取燒杯內總物料的質量、測量物料溫度,然后將燒杯內的物料固液分離,分別稱量固液相各自的質量,并對固液相進行化驗分析。再依次將波美度控制在31.5、32.5、36.5 °Be′進行固液分離,對固相和液相進行化驗分析,計算相圖指數,以相圖理論為指導,預測結晶路線,探求光鹵石礦物的最佳分離點。
5?分析方法
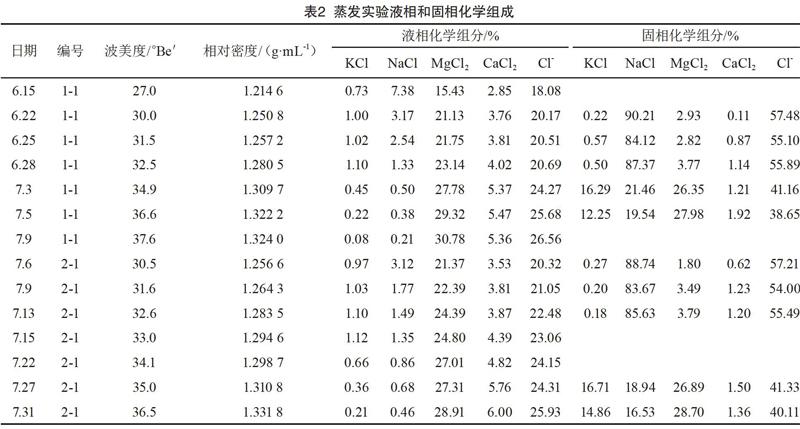
利用光度計測K+、Na+,采用容量法測Mg2+、Ca2+、Cl-。測量結果如表2所示。
6 ? 結果與討論
6.1? 實驗1(原鹵KCl質量分數為0.73%)結果
1-1樣品質量1 218 g,6月15日置于2 000 mL燒杯中,這一階段氣溫不斷升高,蒸發較快。實驗過程中的取樣分析結果表明,母液中的NaCl質量分數逐漸降低,KCl、MgCl2、CaCl2的質量分數不斷提高,有石鹽固體不斷析出。6月22日,當波美度為30.0 °Be′、密度為1.250 8 g/mL(25 ℃)時,進行了本組實驗的第一次固液分離,分離出固體70 g,主要物質是石鹽。通過化學分析得到固相KCl質量分數為0.22%、NaCl質量分數為90.21%、MgCl2質量分數為2.93%、CaCl2質量分數為0.11%。此時母液中的KCl質量分數為1.00%,是原鹵的1.37倍,蒸發水分276 g(含少量作業損失),占原鹵的23%。
進行了第一次固液分離后,繼續進行蒸發,母液組分的變化規律不變。6月25日,當波美度為31.5 °Be′、密度為 1.257 2 g/mL(22 ℃)時,進行第二次固液分離,分離出固體12 g,主要物質還是石鹽。通過化學分析得到固相KCl質量分數為0.57%、NaCl質量分數為84.12%、MgCl2質量分數為2.82%、CaCl2質量分數為0.87%。此時母液中的KCl質量分數為1.02%,是原鹵的1.4倍,蒸發水分70 g(含少量作業損失),占原鹵的5.75%。
繼續進行蒸發,6月28日,當波美度為32.5 °Be′、密度為1.280 5 g/mL(22 ℃)時,進行第三次固液分離,分離出固體14 g,主要物質還是石鹽。通過化學分析得到固相KCl質量分數為0.50%、NaCl質量分數為87.37%、MgCl2質量分數為3.77%、CaCl2質量分數為1.14%。此時母液中的KCl質量分數為1.10%,是原鹵的1.51倍,蒸發水分70 g(含少量作業損失),占原鹵的5.75%。
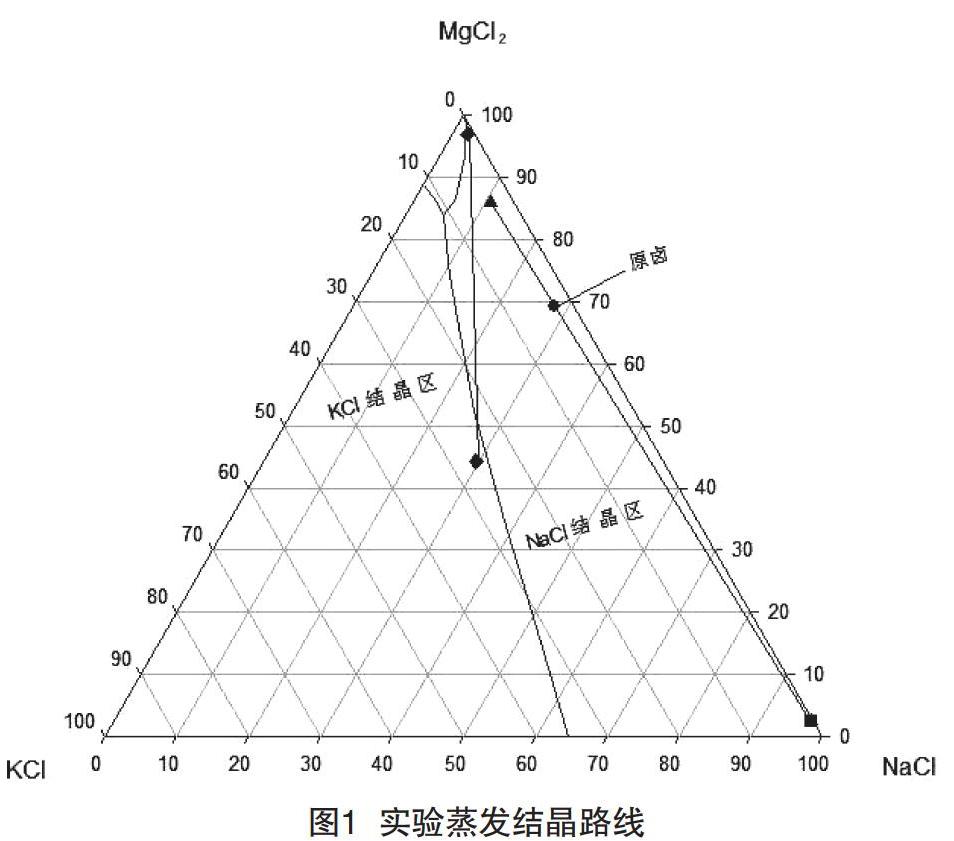
第三次分離后的鉀飽和液母液為706 g,3次共分離出石鹽96 g,繼續蒸發。7月3日,當波美度為34.9 °Be′、密度為? ? ? ? 1.309 7 g/mL(25 ℃)時,進行第四次固液分離,得到固體? ? ? 40 g。通過化學分析得到固相KCl質量分數為16.29%、NaCl質量分數為21.46%、MgCl2質量分數為26.35%、CaCl2質量分數為1.21%,此時樣品進入光鹵石析出階段。然后進行下一步蒸發,此時溫度升高較快,蒸發量較大。7月5日,當波美度為36.6 °Be′、密度為1.322 2(31 ℃)時,進入老鹵階段,進行第五次固液分離,得到固體12 g,產率較低。通過化學分析得到固相KCl質量分數為12.25%、NaCl質量分數為19.54%、MgCl2質量分數為27.98%、CaCl2質量分數為1.92%。根據第四次和第五次的實驗數據,當鹵水波美度為34.9 °Be′、密度為1.309 7 g/mL時,光鹵石的品質較好,產率較高。隨著鹵水密度的不斷升高,光鹵石品質變差,且產率變低,此組實驗結束。實驗蒸發結晶路線如圖1所示。
6.2? 實驗2(原鹵KCl質量分數為0.73%)結果
2-1樣品于6月19日置于5 000 mL燒杯中進行自然蒸發,樣品重5 000 g。與1-1樣品相比,實驗方法及實驗過程完全相同,蒸發的表面積變大,鹵水的深度也增加了,所以蒸發速度較慢。根據監測樣本的分析結果,經過17天的蒸發,對本組實驗進行了第一次固液分離,固相物為石鹽。本組實驗共進行了5次固液分離,前3次固液分離共產出石鹽374 g,產率為7.48%,同時鹵水進入光鹵石階段。實驗于7月31日結束,光鹵石階段共進行了兩次固液分離。第一次固液分離,產出了固相KCl質量分數為16.71%、NaCl質量分數為18.94%、MgCl2質量分數為26.89%、CaCl2質量分數為1.50%的光鹵石178 g,產率為3.6%。第二次固液分離,產出了固相KCl質量分數為14.86%、NaCl質量分數為16.53%、MgCl2質量分數為28.70%、CaCl2質量分數1.36%的光鹵石32 g,產率為0.6%。由此可見,當鹵水剛進入光鹵石階段時,產出的光鹵石品質好、產率高。隨著鹵水密度的不斷增高,光鹵石品質變差,且產率變低。
6.3? 兩組實驗分析與討論
雖然兩組實驗的蒸發面積和鹵水深度不同,但原鹵組分完全相同。分析固相石鹽和光鹵石的產率,1-1樣品的固相石鹽的產率為7.9%,光鹵石的產率為4.3%。2-1樣品的固相石鹽的產率為7.5%,光鹵石的產率為4.2%。由此可見,兩組實驗的石鹽析出階段較長,且產率較高,光鹵石析出階段較短,相應地產率也較低。
實驗表明,在自然蒸發的析鹽過程中,可以通過母液的波美度對分離點進行控制,還可以通過鹵水表面漂浮的結晶物特征進行控制。根據兩組實驗化學分析數據,石鹽析出階段較長,不同階段石鹽夾帶的KCl質量分數也不同,隨著波美度的升高,母液中的KCl質量分數也不斷增加,當波美度為32.5 °Be′、密度為1.280 5 g/mL(22 ℃)時,母液中的KCl達到飽和,波美度再升高,母液中的KCl質量分數不斷降低,進入光鹵石階段。由表2可知,當波美度為32.5~34.9 °Be′時,形成的光鹵石品質好且產率高。當波美度為34.9~36.6 °Be′時,形成的光鹵石品質較差,產率也低。鹽田生產可根據實驗數據,控制最佳的固液分離點:鈉鹽池鹵水波美度應控制在27.0~31.5 °Be′,調節池鹵水波美度應控制在31.5~32.5 °Be′,一級礦池鹵水波美度應控制在32.5~34.9 °Be′,二級礦池波美度應控制在34.9~36.6 °Be′。
[參考文獻]
[1]張兆廣,祁艷.察爾汗鹽湖低品位鹵水自然蒸發試驗研究[J].鹽湖研究,2006(1):17-23.

