用于高溫NaCl-KCl熔鹽體系莫來石隔膜Ag/AgCl參比電極的性能研究
張 磊,何 輝,程仲平,林如山,肖益群
中國原子能科學研究院 放射化學研究所,北京 102413
NaCl-KCl熔鹽具有初晶溫度高[1]、揮發小、價格低廉等優點,可作為難熔金屬(鎢、鉬等)、稀土金屬(鈰[2]等)和錒系金屬(鈾[3]、钚[4]等)等的電解、萃取純化[5]的體系。掌握NaCl-KCl熔鹽體系中元素的電化學行為是開展電解研究的必要條件之一,而穩定可靠的參比電極是熔鹽電化學研究的前提[6]。
NaCl-KCl熔鹽體系中使用的參比電極有準參比電極[7]、Cl-/Cl2參比電極以及Ag/AgCl參比電極[8],其中Ag/AgCl參比電極由于結構簡易、可逆性良好,廣泛地應用于高溫熔鹽電化學研究[9]。由于Ag/Ag+電對是可逆的,因此隔膜材料的選擇對參比電極的性能起著至關重要的作用。目前,隔膜材料有高硅硼玻璃[10]、石英[11]、剛玉[4]和莫來石[6,12-13]等。其中,高硅硼玻璃由于軟化點低,不適合NaCl-KCl熔鹽體系;石英隔膜在850 ℃以上時,電阻率仍然很大,致使石英參比電極在900 ℃時仍有瞬時的電位波動現象[14];而剛玉材料由于電阻較大[15],需打磨至較薄或制成多孔陶瓷,工藝復雜。莫來石隔膜具有電阻小[6]、結構穩定、抗熱震性好和抗化學侵蝕性強等[16]優點,已用于低溫LiCl熔鹽體系[6,12-13],但在高溫NaCl-KCl熔鹽體系中的應用未見報道。
本研究擬采用莫來石作為NaCl-KCl熔鹽體系中Ag/AgCl參比電極的隔膜,考察活化時間、溫度、極化電流對參比電極穩定性的影響,并研究參比電極的平行性及重復使用性能等。
1 實驗部分
1.1 試劑和儀器
氯化鈉、氯化鉀(分析純),AgCl(純度99.5%),上海麥克林生化科技有限公司;氯化鈉(純度99.999%),氯化鉀(純度99.99%),上海阿拉丁試劑有限公司;Ag絲(直徑1 mm,純度99.99%),Alfa-alser(天津)有限公司;莫來石,6×4 HB,日本Nikkato株式合作社;剛玉坩堝,訂制,鞏義市穎輝高鋁瓷廠;高純液氬(純度99.999%),北京氙禾玉商貿有限公司。
Satorius BSA224S電子天平,精度0.000 1 g,德國賽多利斯集團;Gamry Reference 5000電化學工作站,美國Gamry公司。
1.2 實驗裝置
參比電極性能評價實驗裝置示于圖1。如圖1所示,該裝置主要由密封手套箱、氬氣循環凈化系統、加熱系統、冷卻水循環系統、坩堝爐和尾氣處理系統等部分組成。
1.3 參比電極制備
熔鹽純化:將一定量的NaCl和KCl熔鹽分別置于電阻爐中,升溫至300 ℃以除去水分和易揮發雜質。按摩爾比1∶1將NaCl和KCl混合均勻,升溫至750 ℃待熔鹽熔融后通入HCl氣體30 min,隨后通入高純氬氣以除去殘留的HCl,將混合熔鹽轉至陶瓷盤中,冷卻后收集備用。

圖1 參比電極性能評價實驗裝置示意圖
內參比鹽制備:將純化后的NaCl-KCl混合熔鹽轉移至氬氣氣氛手套箱內,按實驗所需比例稱取AgCl粉末與之混合。添加比例根據文獻調研[12-13]及前期實驗確定,參比電極內部AgCl的摩爾分數控制在1%~2%。在剛玉坩堝內將熔鹽混合均勻,設定溫度為750 ℃,使熔鹽熔化并恒溫維持1 h,隨后自然冷卻,并將熔鹽磨碎后收集備用。
參比電極制備:莫來石管(內徑4 mm)底部稍作打磨,將1.0 g參比鹽粉末加入莫來石管內部。隨后將直徑1 mm的Ag絲插入莫來石管。將莫來石管置于爐膛內加熱,待熔鹽融化后將Ag絲插入底部,頂部采用高溫陶瓷膠密封,干燥后即可使用。莫來石隔膜Ag/AgCl參比電極的底部示于圖2。
1.4 參比電極性能研究
高溫熔鹽體系對參比電極的要求主要包括:在實驗條件下具備良好的可逆性,可以長時間穩定工作,不同批次制備的電極平行性良好。據此要求,參比電極的性能研究主要包括活化時間、可逆性、耐極化性、穩定性、平行性和重現性幾方面。
2 結果和討論
2.1 活化時間
參比電極在第一次使用時需要經過活化步驟,活化過程中電位變化較大,完成活化后即可使電位趨于穩定。活化時間的長短與所選擇的隔膜材質、隔膜的厚度以及實驗所選擇的溫度有直接關系。實驗采用不同批次制備的兩根莫來石隔膜Ag/AgCl(2%,摩爾分數,下同)參比電極分別作為工作電極和對電極,在工藝條件(NaCl-KCl熔鹽體系,溫度830 ℃)下測定電極電位穩定所需要的時間,結果示于圖3。由圖3可見,該參比電極經過2 h活化,電位趨于穩定。
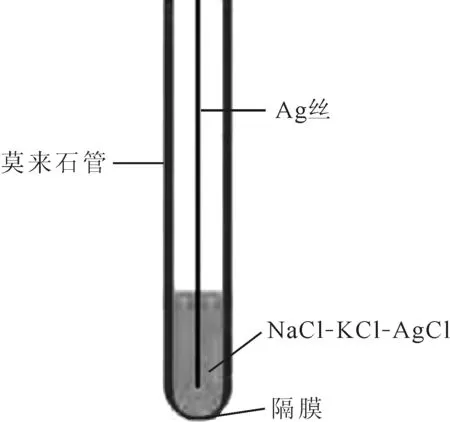
圖2 莫來石隔膜Ag/AgCl參比電極底部示意圖
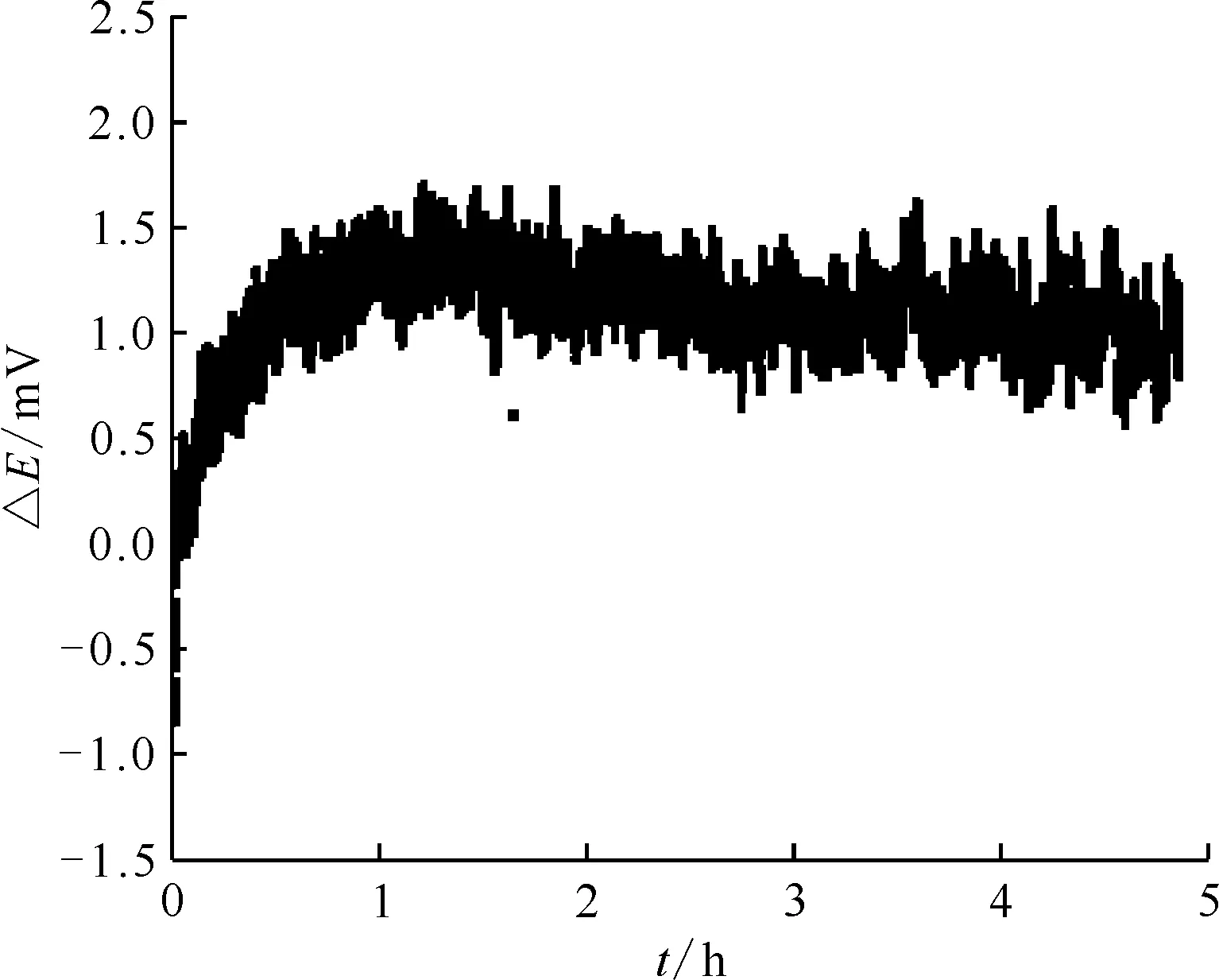
圖3 NaCl-KCl熔鹽體系830 ℃時Ag/AgCl(2%)參比電極的活化時間
2.2 溫度對電極可逆性影響
以莫來石為隔膜,制備兩根AgCl濃度不同的參比電極,置于NaCl-KCl熔鹽體系中,組成如下電池:
Ag|AgCl(1%),NaCl-KCl(99%)‖莫來石|NaCl-KCl|莫來石‖AgCl(2%),NaCl-KCl(98%)|Ag
根據能斯特方程,可將上述濃差電池的電位表示為:
E=(RT/F)ln[(γ1c1)/(γ2c2)]
其中:E為電極電勢,V;T為熱力學溫度,K;R為摩爾氣體常數,8.314 J/(K·mol);F為法拉第常數,96.487 kJ/(V·mol);γ為活度系數;c為離子濃度,mol/L。
實驗過程中所選用的AgCl的摩爾分數小于等于2%,可近似認為活度系數相等,即γ1=γ2,上述方程可表示為:
E=(RT/F)ln(0.02/0.01)=0.693RT/F
通過開路電位法分別測定了兩電極在780~880 ℃范圍內NaCl-KCl熔鹽體系中的電位差(ΔE),結果示于圖4。由圖4可看出,隨著溫度的升高,測量值與計算值的偏差增大,但總體偏差較小(3 mV以內)。電池的溫度系數通過曲線的斜率可求得,為0.058 0 mV/℃,通過公式計算可得溫度系數為0.059 7 mV/℃,可見測量值與計算值相差不大。將所得的數據點擬合為直線,得到r2=0.999,表明ΔE與溫度(θ)具有非常高的線性相關性。上述結果表明,在780~880 ℃范圍內該參比電極滿足能斯特方程,可逆性好,膜電位較小。

■——測量值,●——計算值,直線——ΔE擬合直線
2.3 耐極化性能
參比電極的極化是由于微小的電流通過參比電極后引起的電位變化。在進行電化學實驗時,所使用的參比電極需要具備良好的耐極化性能,在電流通過參比電極后需要在短時間內恢復至平衡狀態。為了進行實驗條件下耐極化性能的測試,制備兩根相同AgCl濃度的參比電極組成電池:
Ag|AgCl(2%),NaCl-KCl(98%)‖莫來石|NaCl-KCl|莫來石‖AgCl(2%),NaCl-KCl(98%)|Ag
在830 ℃條件下,依次設置電流±1 mA、±5 mA和±10 mA分別進行極化,極化時間設置為10 s,隨后分別進行電位的測定,結果示于圖5。由圖5可知,極化后電位發生明顯變化,隨后逐漸恢復至平衡電位,恢復時間小于10 min,表明所制備的參比電極具備良好的耐極化性能。
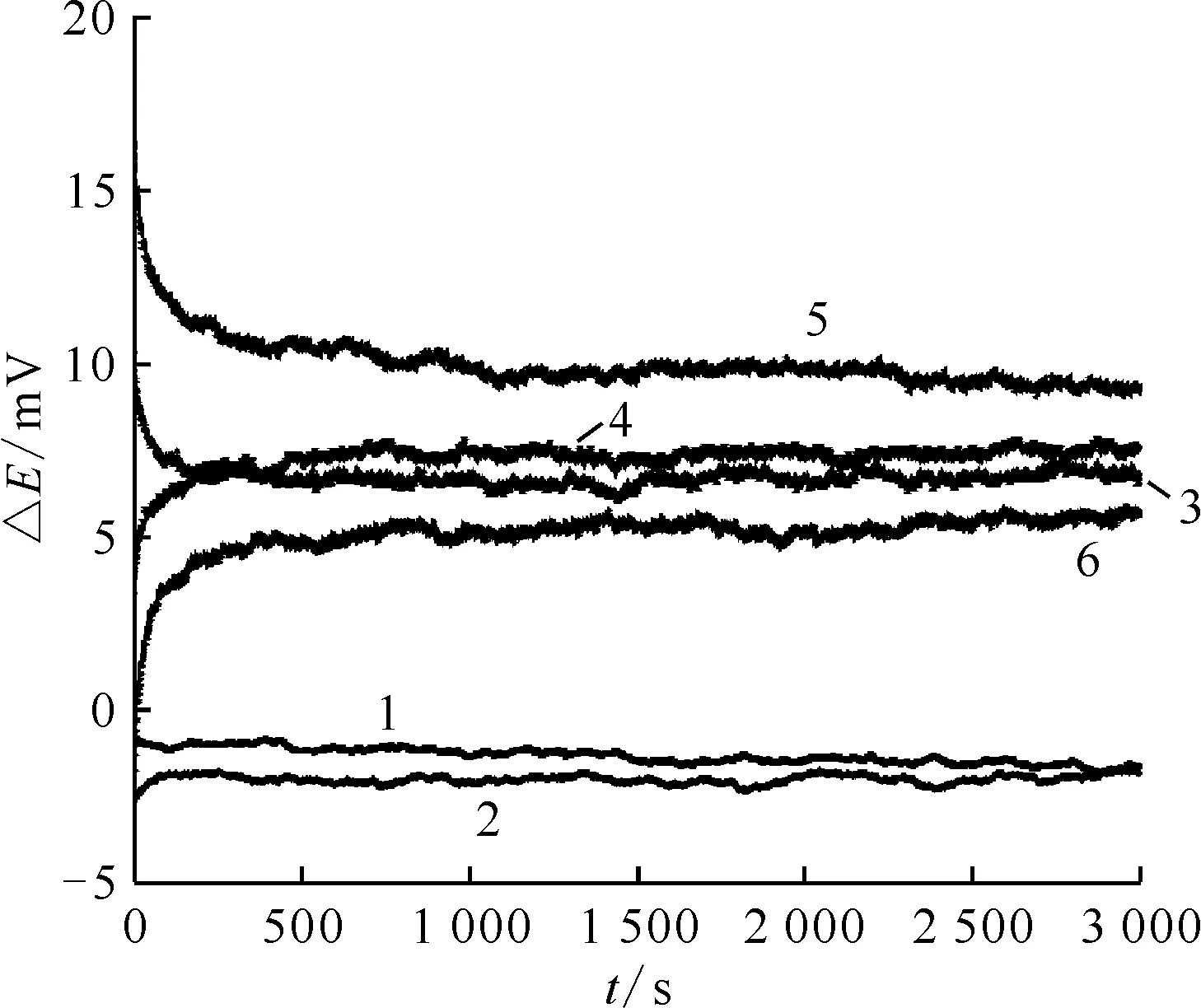
1——+1 mA,2—— -1 mA,3——+5 mA,4—— -5 mA,5——+10 mA,6—— -10 mA
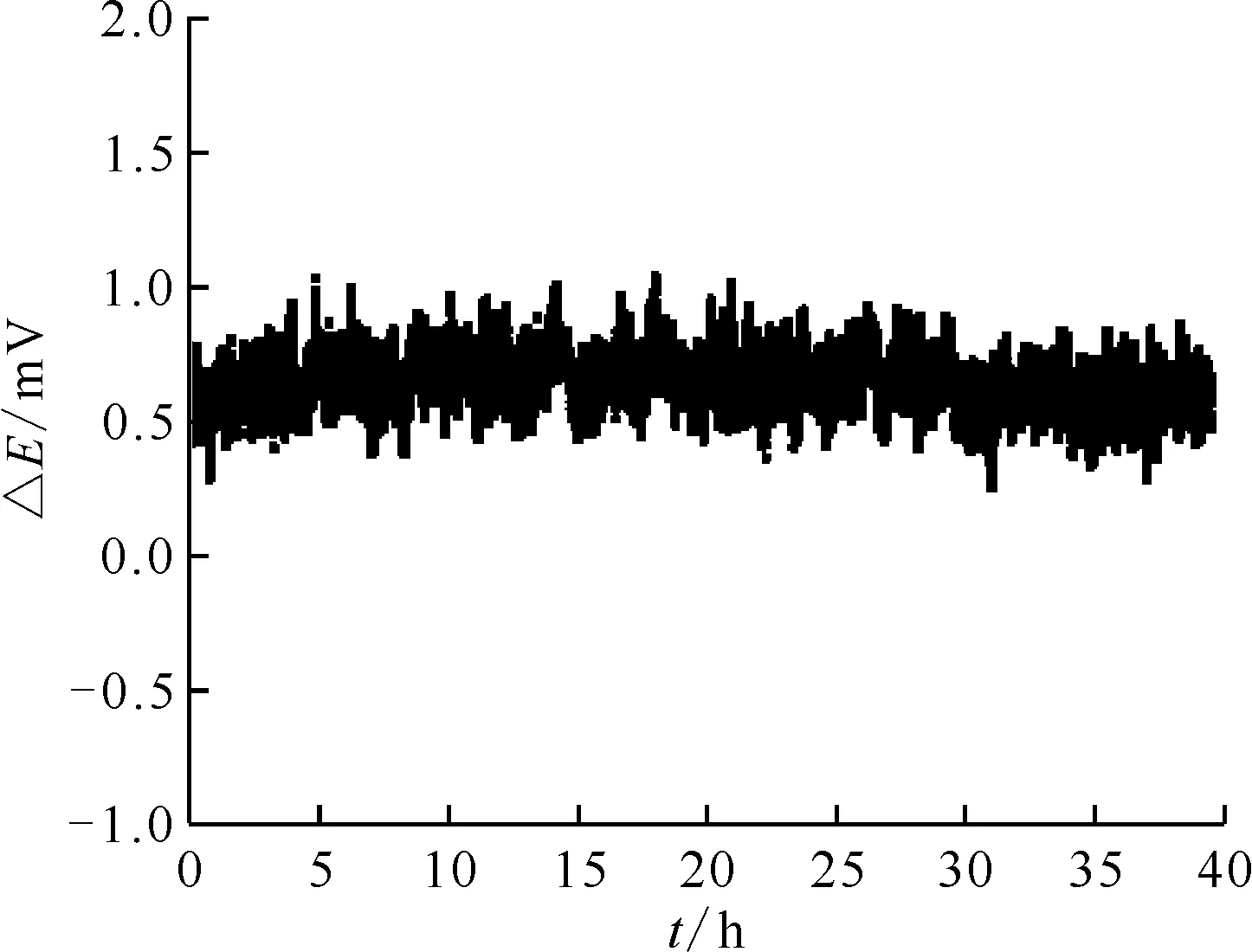
圖6 830 ℃下NaCl-KCl熔鹽中莫來石隔膜Ag/AgCl(2%)參比電極電位差隨時間的變化
2.4 穩定性
參比電極長時間穩定性對電化學測量至關重要,進行工藝條件實驗時,作為基準的參比電極必須保證實驗周期內電位變化盡可能小,因此需對電極的長期穩定性進行評價。通過開路電位法研究了830 ℃時NaCl-KCl熔鹽體系中兩根莫來石隔膜Ag/AgCl(2%)參比電極長時間測定電位的變化情況,結果示于圖6。如圖6所示,在測量周期內,電位差有微小變化,但總體趨勢維持穩定,變化幅度小于1 mV,說明所制備的參比電極具備良好的穩定性,可滿足實驗周期內的測量要求。
2.5 平行性
采用相同工藝制備的參比電極必須保證不同時間、不同批次制備的電極具有良好的平行性,不同參比電極測量得到的電化學數據才具有可比性。通過多次制備的參比電極兩兩組合、測定電位差的方式來評判平行性。選取不同批次制備的10支參比電極兩兩隨機組合,測定兩電極電位差,結果列于表1。由表1可知所制備的參比電極電位差小于3 mV,說明不同批次制備的參比電極平行性良好,該制備方法穩定可靠。
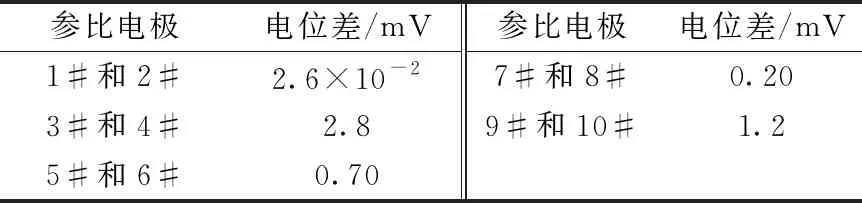
表1 莫來石隔膜Ag/AgCl(2%)參比電極的平行性
2.6 重現性
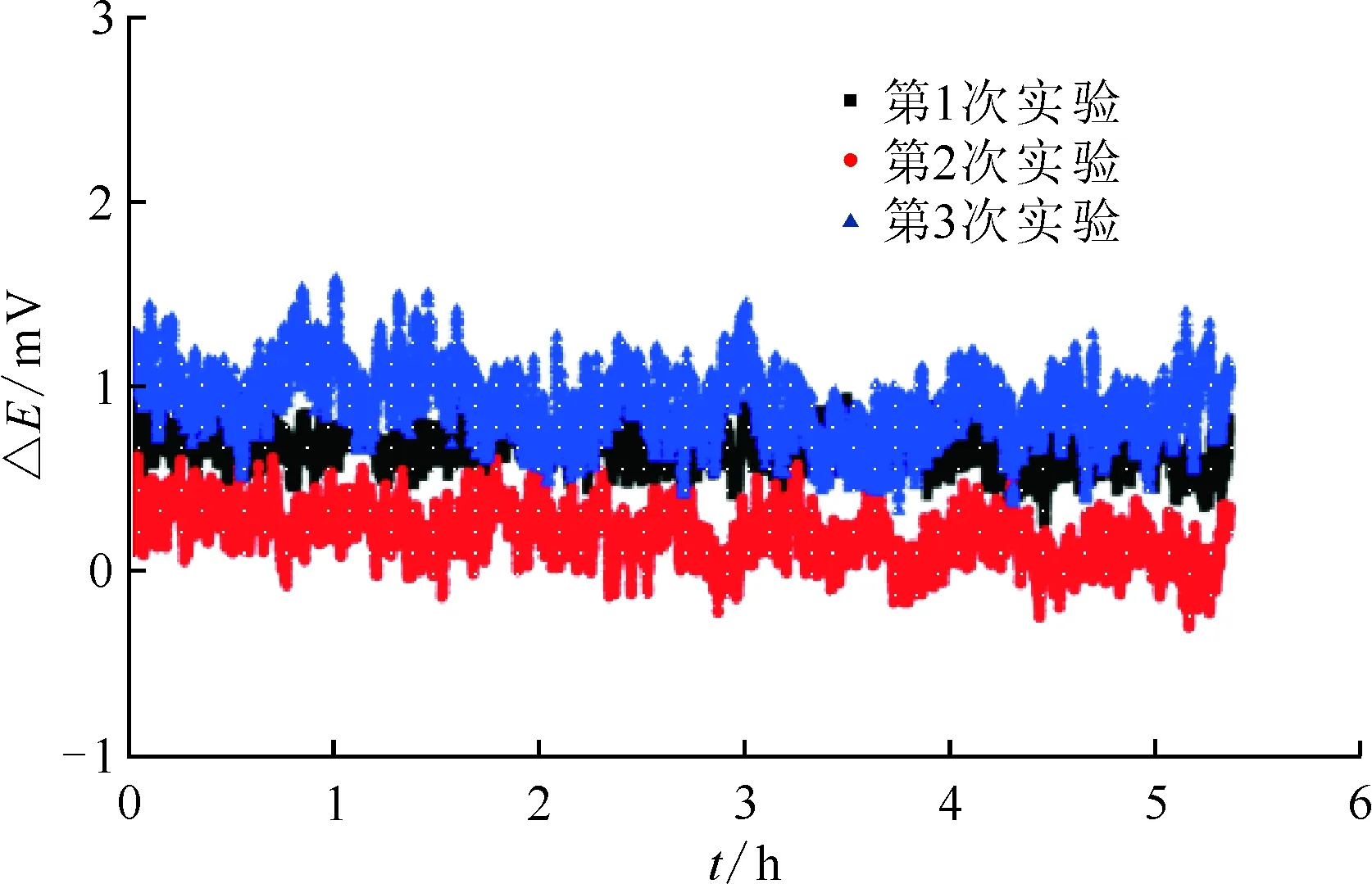
圖7 830 ℃下NaCl-KCl熔鹽中莫來石隔膜Ag/AgCl(2%)參比電極重現性
將兩根莫來石隔膜Ag/AgCl(2%)參比電極在830 ℃條件下重復測量3次,結果示于圖7。圖7結果表明,在3次測量過程中,兩電極間的電位差變化幅度較小,波動范圍在±2 mV以內,具備良好的重現性。
3 結 論
以莫來石為隔膜材料,制備了用于高溫NaCl-KCl熔鹽體系的Ag/AgCl參比電極,并對其性能進行評價。在手套箱中制備的莫來石隔膜Ag/AgCl參比電極的活化時間約為2 h;在780~880 ℃范圍內測量,實驗所得電位差值與計算值偏差在±3 mV內,電位差與溫度擬合曲線為直線,r2=0.999;電極極化后可在10 min內恢復平衡。該參比電極的制備工藝簡單,具有良好的穩定性、平行性和重現性,可適用于高溫NaCl-KCl熔鹽體系中電化學行為的研究。

