基于MRI紋理分析預測肝外膽管癌中VEGF的表達
陳 馨,舒 健,黃新蕎,楊春梅
西南醫科大學附屬醫院放射科,四川 瀘州 646000
膽管癌(cholangiocarcinoma,CCA)起源于膽管上皮細胞,是一種具有高度侵襲性的惡性腫瘤,根據解剖位置分為肝內、肝門周圍和遠端CCA,其中肝門周圍和遠端CCA又統稱為肝外膽管癌(extrahepatic cholangiocarcinoma,ECC)[1-2]。ECC惡性程度較高,早期診斷困難,患者預后差[3]。研究[4-5]表明,血管內皮生長因子(vascular endothelial growth factor,VEGF)在腫瘤血管生成中具有重要的促進作用。而VEGF在ECC中呈高表達,其表達隨著ECC的臨床和病理學分期升高而增加。本研究的目的是基于磁共振成像(magnetic resonance imaging,MRI)紋理分析來預測ECC組織中VEGF的表達。
1 資料和方法
1.1 研究對象
收集2011年1月—2018年12月于西南醫科大學附屬醫院治療的ECC患者。納入標準:① 經手術后病理學檢查證實為ECC;② 具有術前4周內的MRI圖像。排除標準:① MRI檢查前對ECC病灶行動脈栓塞手術或其他手術治療的患者;② 術前MRI圖像中病灶短徑<5 mm或無法確定腫瘤病灶者。最終,納入70例ECC患者,所有患者均行根治性ECC切除或胰十二指腸切除術。
1.2 病理學診斷及VEGF表達判定標準
采用雙盲法對病理學標本進行觀察,并由2名有5年以上工作經驗的病理科醫師進行診斷。細胞質染色主要呈棕黃色或棕褐色即可判定VEGF表達陽性。先用低倍鏡(×100)觀察全片,再用高倍鏡(×200)觀察3個陽性細胞分布密集的視野,計數陽性細胞數和總細胞數,計算陽性細胞百分數。無陽性細胞為未表達(-),陽性細胞數<25%為低表達(+),陽性細胞數25%~50%為中度表達(++),陽性細胞數>50%為高表達(+++)。未表達(-)和低表達(+)均被視為VEGF表達陰性,中度表達(++)和高表達(+++)均被視為VEGF表達陽性[6]。
1.3 掃描設備及參數
患者術前檢查均使用荷蘭Philips Achieva 3.0 T雙梯度超導型MRI掃描儀及16通道相控陣腹部線圈。患者在禁食4~8 h后屏氣掃描,不能屏氣者采用呼吸觸發掃描。掃描序列主要包括橫斷位雙回波化學位移(dual fast field echo,dual-FFE)T1加權成像(T1-weighted imaging,T1WI),橫斷位T1高分辨力各向同性容積激發(high resolution isotropic volume excitation,THRIVE),橫斷位呼吸觸發快速自旋回波(turbo spin echo,TSE)脂肪抑制T2加權成像(T2-weighted imaging,T2WI),橫斷位呼吸觸發單脈沖TSE平面回波成像(echo-planar imaging,EPI),彌散加權成像(diffusionweighted imaging,DWI)。最終選擇以下3個序列進行研究:① THRIVE序列,重復時間(repetition time,TR)為3.1 ms,回波時間(echo time,TE)為1.44 ms,層厚為3 mm,層間距1.5 mm,翻轉角度10°,激勵次數為1,矩陣244×186,視野(field of view,FOV)為280 mm×305 mm;② T2WI序列,TR為2 285 ms,TE為90 ms,層厚為7 mm,層間距為1 mm,翻轉角度90°,激勵次數為2,矩陣為196×206,FOV為330 mm×132 mm;③ DWI序列TR為934 ms,TE為52 ms,b值取0和800 s/mm2,翻轉角度90°,激勵次數為4,矩陣為100×124,回波鏈長度為53,FOV為280 mm×305 mm,層厚為7 mm,層間距為1 mm。所有序列均采用敏感性編碼技術(sensitivity encoding,SENSE)。掃描范圍為雙側膈面至十二指腸水平部。
1.4 圖像處理
所有患者的MRI圖像均傳輸到Philips后處理工作站進行處理,獲取表觀彌散系數(apparent diffusion coefficient,ADC)圖像。在軸向THRIVE、T2WI、DWI及ADC圖中選擇顯示病灶最大截面進行分析(圖1),并以BMP格式保存圖像。ADC值測量:在DWI圖中選擇病灶最大截面,盡量避開出血壞死區設定感興趣區(region of interest,ROI),將ROI復制到ADC圖中計算病灶的平均ADC值。
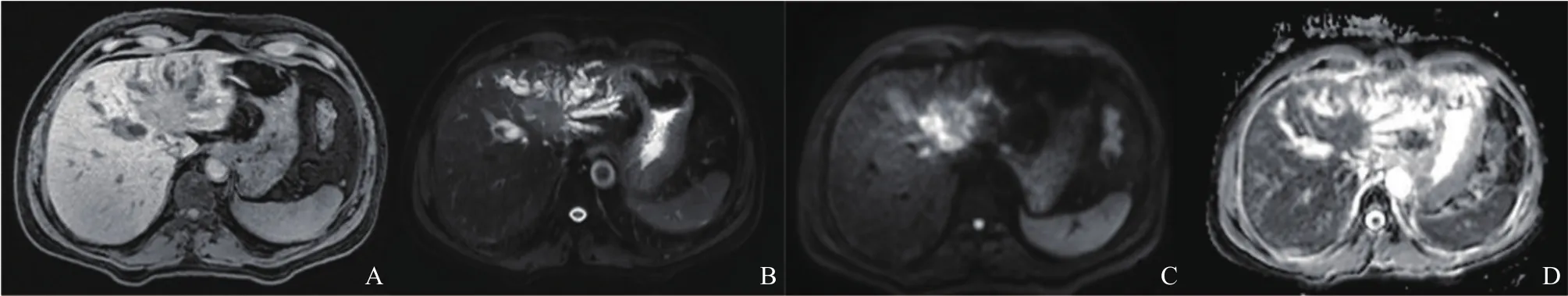
圖1 肝門部CCA的MRI圖像
1.5 圖像分割與特征提取
1名放射科醫師通過MaZda軟件(version 4.6,http://www.eletel.p.lodz.pl/programy/mazda/)劃定病灶的ROI。將受檢者病灶最大截面的MRI圖像以BMP格式導入MaZda軟件,并勾畫病灶的ROI,ROI盡可能以最大范圍覆蓋病灶,勾畫過程中避開血管及壞死區域(圖2)。每例患者分別獲取4個ROI,包括DWI、THRIVE、T2WI、ADC圖中病灶最大截面的ROI,共描繪70例患者共280個ROI。使用標準化圖像強度的方法執行圖像標準化,以最大程度地減少對比度和亮度變化的影響。
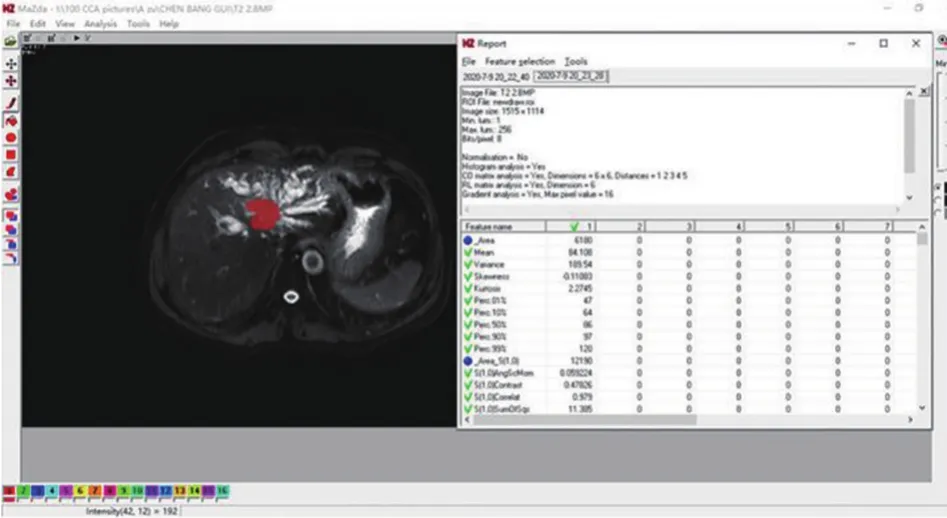
圖2 MaZda軟件勾畫CCA腫瘤最大橫截面的ROI并提取紋理特征的過程截圖
最終提取了直方圖、絕對梯度、灰度共生矩陣、游程長度矩陣、自回歸模型和小波變換等6個常見特征組,每幅圖像提取300個紋理特征,每例患者共有1 200個紋理特征。
1.6 統計學處理
采用SPSS 24.0進行統計學分析。采用兩獨立樣本t檢驗篩選出VEGF表達陽性和陰性兩組間差異有統計學意義的紋理特征,并進行Spearman相關分析以消除相關性顯著的紋理特征,在相關系數(rs)≥0.9的特征中保留P值最小的參數,最后將篩選出的紋理特征納入二元logistic回歸模型,采用Enter法建立預測模型,保存每例患者的預測概率,以每例患者的預測概率與實際VEGF表達情況繪制受試者工作特征(receiver operating characteristic,ROC)曲線,用于評估預測模型的分類性能。采用兩獨立樣本t檢驗比較VEGF陰性組和陽性組間ADC值的差異。P<0.05為差異有統計學意義。
2 結 果
2.1 研究對象
共70例患者納入本研究,其中VEGF陰性患者共38例,VEGF陽性患者共32例。VEGF陰性組男性18例,女性20例,年齡32~83歲;VEGF陽性組男性17例,女性15例,年齡39~69歲。兩組間性別(χ2=0.230,P=0.631)及年齡(t=0.429,P=0.669)差異無統計學意義。患者腫瘤病灶在MRI圖像上最大截面的最長徑為0.6~7.5 cm,中位值為2.0 cm;最短徑為0.5~5.0 cm,中位值為1.7 cm。
2.2 基于VEGF表達的最優紋理特征的選擇及統計分析
由ADC圖提取的紋理特征經t檢驗顯示組間差異有統計學意義的共54個(P<0.05),然而DWI、THRIVE、T2WI圖像中病灶的所有紋理特征組間差異均無統計學意義(P>0.05);將差異有統計學意義的54個紋理特征進行Spearman相關分析,刪除rs≥0.9的各類相關特征(僅保留rs≥0.9的所有變量中P值最小的一個紋理特征),最終保留了4個特征參數,包括2個灰度共生矩陣特征、1個游程長度矩陣特征及1個小波變換特征,詳見表1。
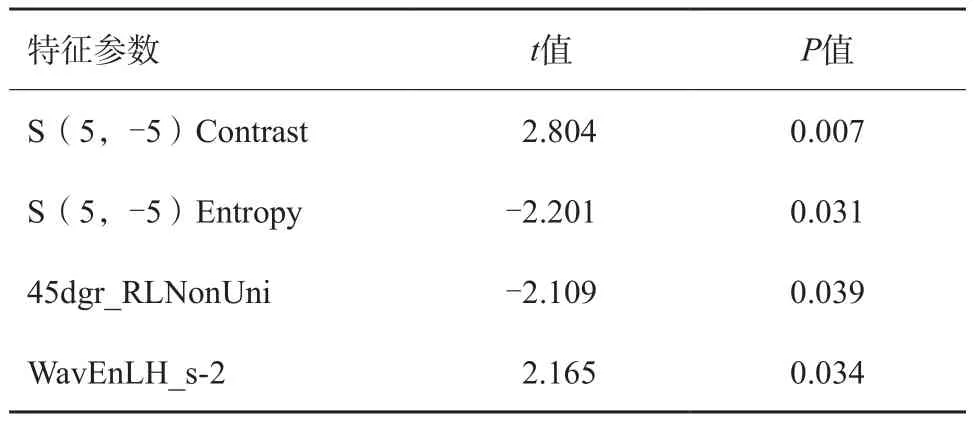
表1 CCA在ADC圖中用以建立模型的最優紋理特征
以VEGF的表達為因變量,4個篩選后的特征參數為自變量,擬合非條件二分類logistic回歸模型建立預測模型,得到每例患者的預測概率;對每例患者的預測概率與該患者實際的VEGF表達情況進行ROC曲線分析(圖3),曲線下面積(area under cure,AUC)為0.708(95% CI:0.584~0.832;P=0.003),其預測VEGF表達陽性的靈敏度、特異度、準確度、陽性預測值、陰性預測值分別為65.6%、78.9%、72.8%、72.4%、73.2%。
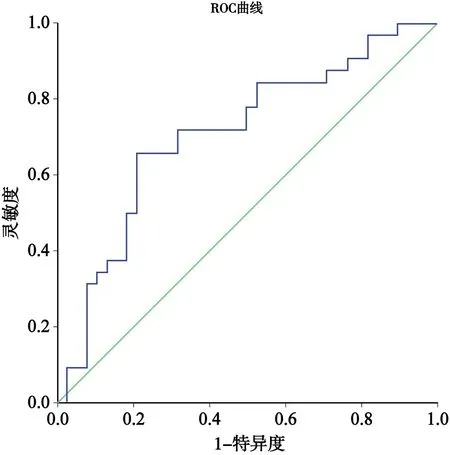
圖3 MRI圖像紋理特征預測VEGF陽性預測概率與實際VEGF表達情況的ROC曲線圖
2.3 ADC值與VEGF表達的相關性
VEGF陰性組的ADC值為1368.2×10-6mm2/s,陽性組為1 292.2×10-6mm2/s,t檢驗結果顯示兩組間差異無統計學意義(t=0.851,P=0.398)。
3 討 論
CCA是發生于膽管上皮細胞的惡性腫瘤,其中ECC占約90%[2]。近40年來ECC的上升幅度趨于緩慢,但因其診斷及手術切除困難,淋巴結轉移和局部腫瘤浸潤往往導致高復發率和較差的預后[7-8]。血管和淋巴管的生成是大多數惡性腫瘤生長、侵襲和轉移的重要過程,而VEGF又在調控血管生成中起著最重要的作用[9]。研究[5,10]表明,VEGF在ECC中高表達,且VEGF高表達與CCA的淋巴結轉移、血管受侵密切相關。因此如能在術前評估CCA中VEGF的表達情況,對指導臨床治療及評估患者預后將具有重要意義。
影像組學(radiomics)從不同模態醫學影像圖像中提取大量特征數據并加以分析,利用機器學習算法或統計學途徑建立分類或預測模型,從而對疾病進行診療[11]。影像組學是對醫學影像圖像進行特征提取、分析和應用,在醫學影像特征層面對腫瘤基因、蛋白和分子等變化進行解讀,能夠進一步認識腫瘤的異質性,可應用于判斷腫瘤分子分型、協助診斷與治療、評估療效及預后等多個方面[12]。目前,影像組學已在多種腫瘤的診療方案確定和預后預測方面取得了可靠的成果,例如預測頭頸部鱗狀細胞癌的病理學分化程度[13]、預測浸潤性乳腺癌患者Ki-67增殖指數[14]、評估結直腸癌淋巴結轉移狀態等[15]。
本研究建立了一個基于MRI的影像組學模型來預測ECC組織中VEGF的表達狀態。選取了患者術前MRI的DWI、THRIVE、T2WI及ADC圖像進行研究,并研究了組間平均ADC值之間的差異,結果發現DWI、THRIVE和T2WI圖像中腫瘤病灶提取的紋理特征不能區分VEGF的表達狀態(P>0.05),同時,VEGF陰性組和陽性組間平均ADC值差異也無統計學意義(P>0.05)。而基于ADC圖像的紋理特征建立的影像組學模型具有分類意義(AUC=0.708,P<0.05)。
THRIVE、T2WI主要反映組織間T1值、T2值的差別,人體不同正常組織或病理狀態下的組織具有不同的T1、T2值。VEGF促進血管內皮細胞生長,可能并沒有明顯改變腫瘤組織成分,故THRIVE、T2WI難以鑒別VEGF的表達狀態。而DWI及ADC圖深入到細胞分子水平,反映水分子彌散運動受限制程度,可提示腫瘤細胞的存活情況和腫瘤組織的血液灌注變化[16]。VEGF過表達促進腫瘤血管生成,增加血流灌注,促進腫瘤生長,故DWI及ADC圖預測VEGF的表達有一定意義。但由于T2穿透效應使得DWI難以準確反映彌散受限的程度。以上可能是引起THRIVE、T2WI、DWI序列圖像中腫瘤病灶提取的紋理特征不能預測VEGF的表達,而基于ADC圖像的影像組學模型有預測意義的原因。
平均ADC值為病灶ROI內每個體素ADC值的平均值,是反映水分子彌散運動的常用參數。而紋理分析利用數學方法評估圖像中像素的灰度強度和位置等信息,從而獲取比平均值更多的人類肉眼無法識別的圖像特征信息[11]。本組數據發現病灶的平均ADC值在VEGF陰性組和陽性組間并無差異,而ADC圖的紋理特征參數S(5,-5)對比度、S(5,-5)熵、45°方向游程長不均勻度和低高頻小波轉換系數s-2在兩組間差異顯著。對比度反映圖像清晰度和紋理溝紋深淺,與溝紋的深淺程度成正比;熵值反映圖像紋理的復雜性,與紋理信息量成正比[17]。Lian等[18]報道,相比低轉移癌細胞,高轉移癌細胞具有高度的無序性,使高轉移癌細胞表現出較高的對比度和熵。Karahaliou等[19]研究發現乳腺惡性微鈣化簇周圍組織較良性組的對比度和熵值較低,表明惡性組織減少局部變化量和減少隨機性的特點。游程長不均勻度描述紋理粗細的相似性,該值越小說明圖像紋理粗細越均勻[20]。謝元亮等[21]報道,游程長不均勻度與宮頸癌的國際婦產科聯盟(Federation International of Gynecology and Obstetrics,FIGO)分級呈正相關。低高頻小波轉換系數為圖像經小波分解后得到的垂直高頻細節分量子圖像的高頻系數,反映原圖像的垂直細節特征,細節越豐富則圖像越清晰[22]。本研究通過比較ECC VEGF陰性組和陽性組紋理特征參數的差異,發現陽性組ADC圖中病灶ROI的S(5,-5)對比度和低高頻小波轉換系數s-2較小,S(5,-5)熵、45°方向游程長不均勻度較大,說明陽性組圖像模糊、紋理復雜且粗細不均。腫瘤血管的內皮細胞形態失常、間距增大,血管基底膜缺損,血管結構紊亂且異常分支增多,而VEGF與腫瘤血管異常生長關系密切,可誘導血管內皮細胞的異常增殖,這有可能是VEGF陽性組圖像紋理復雜不均的原因;并且腫瘤內血管在結構上的異常可導致組織乏氧、酸中毒等,影像學上可表現為信號不均勻,組織囊變、壞死等[23]。
本研究最終基于ECC腫瘤組織ADC圖的4個紋理特征,利于logistic回歸分析建立了預測VEGF表達的模型,其靈敏度為65.6%,特異度為78.9%。
本研究不足:影像組學需要大數據研究及多中心驗證,但本研究收集的樣本量較小且為單中心數據,因此需要大樣本、多中心研究來驗證該模型的可重復性和可靠性。另外,此次僅選取病灶最大層面勾畫ROI和提取紋理特征,未能全面反映腫瘤的整體情況。在將來的研究中,可以逐漸彌補這些不足。
綜上所述,本研究分析了ECC的MRI紋理特征,發現基于病灶ADC圖的部分紋理特征對預測癌組織中VEGF的表達具有一定意義,而基于病灶DWI、THRIVE、T2WI序列各圖的紋理特征和病灶的平均ADC值在不同VEGF的表達中不具有預測意義。

