化學認知中的“假說—證明”方法
吳俊明 張燕靜
摘要:闡釋了假說、證明以及化學科學中的假說、化學科學中的證明;“假說—證明”是化學科學的重要方法,在化學教學中也具有重要的作用。
關鍵詞:化學的“假說—證明”; 化學的“假說—證明”思維; 教學訓練
文章編號:1005-6629(2021)08-0009-06
中圖分類號:G633.8
文獻標識碼:B
1 化學認知中的“假說—證明”
“假說—證明”是一種重要的認知活動,也是一種重要的化學認知方法(“假說—證明”方法常常被簡稱為假說方法)。“假說—證明”由假說和證明這兩個部分組合而成。要了解“假說—證明”活動,需要先分別了解假說和證明。
1.1 化學認知中的假說
假說是出于解決問題的需要,根據某些事實或原理對事物現象及其規律性作出的、有待于證明的猜測性解釋和說明。
科學假說是為解釋、說明自然、社會、思維等方面的事實、現象,尋找有關規律,或者解答有關問題而提出的初步推測,常常涉及“會發生什么”“可以觀察到什么”“產生什么結果”“在什么情況下發生”(或者“在什么情況下可以觀察到”)、“為什么會發生”“現象的實質是什么”等問題,是科學探究中最重要的智力活動手段之一。科學假說具有科學性和科學系統性(可歸屬于科學范疇)、假定性(需要驗證或論證)、可證性(否則就無法進行驗證、論證)以及推測性、預見性(否則就無法對化學研究起指導作用)等。科學假說必須滿足2項要求:一是必須具有可檢驗性;二是必須具有可證偽性[1]。
科學假說是以一定的事實或原理為基礎的。沒有事實或原理為基礎的假說不是科學假說。
科學假說大體上可以分為解釋性假說(理論性假說)、經驗性假說(描述性和預測性假說,即關于事實的假說)兩大類。依據假說涉及的對象、范疇及其產生的影響,還可以把它分為“常規科學假說”和“革命性科學假說”兩類。
科學假說往往有其逐步形成、充實、修正、發展和完善的過程。
化學認知中的假說,即化學假說,是科學假說的一類,可能涉及物質(實物材料)的存在、種屬、組成、結構、性質、用途、制取等等。它常常還具有形象性(否則就無法在宏觀直至原子、分子等水平上反映實物材料的存在、組成、結構、性質、變化及相應規律)。
假說一般對應于比較重大的問題。跟非重大問題對應的猜測性解釋和說明可以稱為猜測、猜想(例如本文第3部分的實例2)。
1.2 化學認知中假說的證明
假說是想象的產物,不一定是真實、正確的,只有得到證明或者否證才會具有積極意義。證明、否證分別是根據確實的材料肯定或者否定假說真實性的方法。也就是說,證明的作用是檢驗假說是否正確,所以,“假說—證明”又被稱為“假說檢驗”。沒有經過證明或者否證的假說是沒有實際意義的,必須把假說跟其證明或者否證結合起來,形成“假說—證明”過程,假說才成為通向科學認識的“橋梁”,也才能實現認識的飛躍和發展。
因此,完整的假說方法應該包括4個基本過程:
(1) 明確要解決的問題;
(2) 提出假說;
(3) 由假說得出推論;
(4) 驗證推論,由此證明或者否證假說。
對化學假說進行證明或者否證有兩條路徑:(1)利用實驗手段來驗證或者否證假說;(2)通過已有理論的演繹來論證或者反駁假說。邏輯證明和實踐檢驗是確定假說是否正確的基本方法。其中,實踐檢驗具有根本性,但是實踐常會受到某些限制。實行邏輯證明和實踐檢驗相結合是最好的方法。
在假說基本正確的前提下,這兩條路徑還可能具有對假說進行修正、完善的作用。
化學假說通常通過歸納、類比等非必然性推理形成。它一旦被已有理論演繹證明,就具有了必然性。
假說的提出往往建立在部分事實的基礎上,把這部分事實跟形成的可檢驗推論作為“假說—證明”方法的核心,只突出事實和推理,忽視假說及其證明是不妥的:畢竟事實不等于命題、不等于假說、不能直接進行推理;把事實跟證據等同是不妥的:“證據”是“證明命題或假說的依據”,沒有命題或假說,事實就成不了證據。從邏輯學的角度來看,假說是跟事實有關的命題,推理是對命題進行的邏輯操作活動,命題和假說都需要經過證明才能確立;光有假說沒有證明的過程不是完整的邏輯過程。假說和證明是整個過程真正的核心。
2 “假說—證明”是化學科學的重要方法
化學科學形成和發展的歷史充分說明,“假說—證明”是化學科學的重要方法,它不但在化學科學的形成和發展中一再起到了關鍵性作用,在化學科學的傳承中也是如此。
2.1 化學科學形成和發展中的“假設—證明”
在化學科學的形成和發展過程中,有許多化學家在提出自己的“理論”和猜想時,未能提供足夠和有力的證明;雖然這些“理論”在提出之初大多沒有冠以“假說”,它們實際上屬于假說。這些假說中,有些很快得到證明、被確認為理論(或稱為“學說”);有些直到多年之后,才被證實、被認可為“理論”;還有一些或者無法證實,或者被否證、終被拋棄。例如:
1661年,波義耳(Boyle R.,1627~12691,英)提出的元素假說;
1703年,施塔爾(Stahl G.E.,1660~1734,德)提出的燃素假說;
1732年,波爾哈夫(Boerhaave H.,1668~1738,荷)提出的“化學親和力”假說;
1755年,布拉克(Black J.,1728~1799,英)提出的“固定空氣”(二氧化碳)假說;
1777年,拉瓦錫(Lavoisier A.L.,1743~1749,法)發表的燃燒假說;
1803年,道爾頓(Dalton J.,1766~1844,英)提出的原子假說;
1811年,貝采尼烏斯(Berzelius J.J.,1779~1848,瑞典)提出的電化二元假說;
1811~1821年,阿伏伽德羅(Avogadro A.,1776~1856,意)提出的分子假說;
1814年,蓋·呂薩克(Gay Lussac J.L.,1778~1850,法)提出的含氫酸假說;
1815年,普勞特(Prout W.,1785~1850,英)提出的元素由氫原子構成假說;
1829年,德貝萊納(W. Dbereiner J.,1780~1849,德)提出的“三元素組”假說;
1834年,杜馬(Dumas J.B.A.,1800~1884,法)提出的取代假說;
1835年,貝采尼烏斯(Berzelius J.J.,1779~1848,瑞典)提出的催化假說;
1843年,日拉爾(Gerhardt C.F.,1816~1856,法)提出的有機物同系列假說;
1850年,威廉遜( Williamson A.W.,1824~1904,英)提出的有機化合物的水類型假說;
1852年,弗蘭克蘭(Frankland E.,1825~1899,英)提出的原子價假說;
1857年,凱庫勒(Kekulé F.A.,1829~1896,德)提出的有機物沼氣結構類型和碳四價假說;
1858年,凱庫勒等提出的碳鏈假說;
1861年,布特列洛夫(Бутлеров А.М.,1826~1886,俄)提出的有機物結構假說;
1862年,格雷阿姆(Graham T.,1805~1869,英)提出的膠體假說;
1864年,古爾德貝格(C.M. Guldberg,1836~1902,挪)和瓦格(P. Waage,1833~1900,挪)提出的質量作用定律假說;
1869年,門捷列夫(Дмитрий Иванович Менделеев,1834~1907,俄)提出的元素周期律假說;
1874年,范霍夫(J.H. vant Hoff,1852~1911,荷)和勒貝爾(J.A. Le Bel,1847~1930,法)分別提出的碳原子價鍵的四面體構型假說;
1884年,勒夏特列(H. Le Chatelier,1850~1936,法)提出的化學平衡假說;
1887年,阿累尼烏斯(S. Arrhennius,1859~1927,瑞典)提出的電離假說;
1889年,阿累尼烏斯提出的活化分子和活化能假說;
1893年,維爾納(A. Werner,1866~1919,瑞士)提出的絡合物配位假說;
1902年,盧瑟福(E. Rutherford,1871~1937,英)提出的元素蛻變假說;
1906年,費歇爾(Emil Fischer,1852~1919,德)提出的蛋白質多肽結構假說;
1910年,索迪(F. Soddy,1877~1956,英)提出的同位素假說;
1911年,盧瑟福提出的原子結構假說;
1916年,柯塞爾(W. Kosssel,1888~1956,德)和路易斯(G.N. Lewis,1875~1946,美)分別提出的電價假說和共價假說;
1929年,德拜(P. Debye,1884~1966,荷)提出的極性分子假說;
1930年,范德華(J. van der Waals,1837~1923,荷)提出的分子間作用力假說;
1931年,鮑林(L. Pauling,1901~1994,美)和斯萊特(J.C. Slater,1900~1976,美)提出的雜化軌道假說……
就它們在化學科學形成和發展中的影響而言,拉瓦錫的燃燒假說;道爾頓的原子假說;阿伏伽德羅的分子假說;凱庫勒、柯爾柏和布特列洛夫的有機物分子結構假說;門捷列夫等人的元素周期律假說;阿累尼烏斯提出的電離假說;盧瑟福的原子結構假說;柯塞爾、路易斯的電價、共價假說;范德華的分子間作用力假說;鮑林和斯萊特的雜化軌道假說等,堪稱為化學史中的十大科學假說,可以作為認識、了解“假說—證明”方法的素材。
2.2 化學科學形成和發展中的“假說—證明”方法例說
歷史事實表明,化學的許多理性認識的形成都依賴于“假說—證明”活動,“假說—證明”思維在化學科學形成和發展中多次起到了關鍵作用。為具體地了解化學科學中“假說—證明”的過程和特點,現概述兩個例子供讀者參考。
例1 道爾頓原子理論的確立[2~5]
古希臘哲學家德謨克利特(約公元前460~公元前370)認為,物質由極小的微粒——“原子”構成,物質只能分割到原子為止。這種臆測性的自然哲學觀點在人類歷史中延續了很長時間。例如,17世紀時著名的英國科學家牛頓仍然認為原子是物質的最小單位,且用原子間作用力來解釋化合、溶解、金屬置換、金屬溶解于酸、鹽與酸發生復分解反應、火藥爆炸以及氣體體積與壓力成反比等化學和物理現象。牛頓的這些觀點沒有實驗事實證明。
道爾頓從1787年開始業余從事氣象的觀察和研究長達57年之久,先后研究過蒸汽壓、混合氣體分壓、氣體擴散、空氣組成等問題。他曾經特別注意如何解釋兩種或兩種以上氣體混合后會變成一種均勻的氣體這個問題。
1803年,他根據氣體受熱時膨脹,升壓、冷卻時收縮或降壓等現象以及查理定律(氣體體積隨溫度升高而膨脹),把氣體微粒間的排斥力解釋為熱的作用。他描繪氣體原子的周圍被一層“熱氛”籠罩,因而相互產生排斥力。溫度越高,“熱氛”就越多,相互間的斥力就越大。不久之后,道爾頓發表了有關論文,其要點是:
(1) 元素的最終組成稱為簡單原子,它們是不可分割、不可見的;在一切化學變化中保持其本性不變;既不能創造也不能消滅。
(2) 同一元素的原子,其形狀、質量及各種性質都是相同的;不同元素的原子在形狀、質量及各種性質上各不相同;每一種元素以其原子的質量為最基本的特征。
(3) 不同元素的原子以簡單數目比例相結合,就形成化學中的化合現象;化合物的原子是復雜原子,其形狀、質量和性質必然相同。
道爾頓指出了每種化學元素以它們的原子質量為其最基本的特征(這是道爾頓原子論跟牛頓原子論的重要差別),被后來的化學元素周期律進一步證實,也為化學的發展提供了理論基礎。
道爾頓的原子假說使當時一些化學基本定律得到了統一的解釋,說明了各種化學現象和各種化學定律間的內在聯系,很快被化學界接受和重視。
道爾頓為什么能夠建立科學的原子假說?一個重要原因是他以事實為基礎:他曾經通過實驗分析過許多地區的空氣組成。運用這方面的經驗,他分析了甲烷和乙烯兩種氣體的組成,發現甲烷的氫/碳比是乙烯的2倍,還發現其他一些化合物也有類似現象。例如:在黑色的氧化銅中,按重量計算,總是20份氧跟80份銅化合;而在紅色的氧化銅(實為氧化亞銅)中則是11份重量的氧跟89份重量的銅化合。若同是跟20份重量的氧化合,紅色氧化銅中銅的重量是黑色氧化銅中的2倍;再如,在氮的氧化物中,跟相同重量氧化合的氮的重量也有簡單整數倍數關系!他在實驗基礎上發現了倍比定律,發現只有用他的原子假說才能很好地解釋倍比定律;否則的話,在不同化合物中,元素含量之比絕不會恰巧都為正整數。他自我辯解:“有些人把我的原子理論叫做假說,不過,請相信我的話,我的原子理論是真理。我所得到的全部實驗結果,使我對這一點深信不疑。”道爾頓還進一步想象到:不同元素的原子應該有不同的大小和質量。他根據當時已經發現的當量定律認為原子的相對質量是可以測定的,并且以氫的原子質量為1,測出了20種不同元素的相對原子質量,制定了世界上第一張原子量表。
盡管道爾頓當時測定的原子量很不準確,然而這是一個創舉。盡管道爾頓的原子論含有一些錯誤,但是其后化學科學近3個世紀的發展已經證明道爾頓原子論的基本假定是正確的。他所說的“熱氛”,實際上跟原子的熱運動有關……他為科學的原子論奠定了基礎,功績永存。正如恩格斯所說:“化學中的新時代是從原子論開始的,所以近代化學之父不是拉瓦錫,而是道爾頓。”
例2 阿累尼烏斯電離學說的建立[6~9]
1800年伏打電池研制成功、隨后尼科爾森(W. Nicholson,1753~1815,英)和卡里斯爾(A. Carlisle,1768~1840,英)實現了水的電解,使許多科學家對電解與導電度的實驗研究產生了極大的興趣,對水溶液導電性和電解的研究步步深入。當時的科學界普遍認為:只有存在外加電壓時電解質才會離解成正離子和負離子。例如,1805年,格羅特斯(C.J.D. Grotthuss,1785~1822,德)在解釋水的電解機理時指出:在電流作用下,水分子變為帶負電的氧原子和帶正電的氫原子。
由于對上述觀點產生了懷疑,阿累尼烏斯開始了一系列實驗探究。從1882年到1883年冬季,阿累尼烏斯測定了各種酸、堿、鹽的稀溶液的導電度。1884年,他根據實驗結果寫成了第一篇論文“電解質的電導率研究”,其中指出:對極稀薄的鹽類水溶液來說,在其他條件不變的情況下,導電度與濃度成正比;溶有兩種鹽類的稀薄溶液的導電度,等于這兩種鹽在相同濃度時的導電度之和。
上述實驗結果可以對溶液中電解質的狀態做出怎樣的判斷?在反復思考和大膽想象的基礎上,阿累尼烏斯隨即又寫出了第二篇論文“電解質的化學理論”,介紹了他的電離假說。其要點有:
(1) 在某水化物(指可溶電解質)的水溶液中,除水之外,由兩種成分組成,即具有活性又有電解性的成分(指電離后的產物)與無活性也無電解性的成分(指未電離的電解質)。水、活性水化物與非活性水化物這3種成分在稀釋過程中以活性部分增長、非活性部分減少來達到平衡。
(2) 一種電解質的活度系數是電解質中實際存在的活化分子數與該電解質完全變化為活化分子時所存在的活化分子數之間的比值。
(3) 酸的活性系數越大,酸性越強;堿也類似如此……溶劑量無限大時,鹽能被完全活化(離解)。
(4) 電解質能以活性和非活性兩種不同形式來表現,因而活性部分是在同一外因條件(溫度與稀釋度)下,總是形成電解質全量的一定分數值,這就是關鍵。活性部分是導電的,實際上是電解質,非活性部分則不然……
阿累尼烏斯的論文受到質疑,評價一度極低。一些化學權威認為這篇論文缺乏依據,還有常識性錯誤。例如,食鹽是一種穩定的化合物,論文中卻認為它溶解于水時被分解為鈉和氯氣,鈉可是能跟水劇烈反應的,氯氣是黃綠色的、有刺激性氣味呢,這個推斷不符合實際情況……當時的化學界對阿累尼烏斯的假說普遍持懷疑態度。
不久,奧斯特瓦爾德(F.W. Ostwald,1853~1932,德)在研究乙酸甲酯水解和蔗糖轉化問題時發現:有機酸和鹽酸在沒有外部電力作用時都含有不同濃度的氫離子,與阿累尼烏斯電離假說一致,可以作為這個假說的旁證。1886年,阿累尼烏斯發現:把等量的鹽溶解在不同量的水中時,溶液越稀,分子電導越大,表明電離度越高;到無限稀釋時,溶液的分子電導達到最大值,可以認為這時全部電離。
早在1788年,英國物理化學家布拉格登(C. Blagden,1748~1820,英)就發現食鹽、硝酸鉀、氯化鈉、酒石酸鉀鈉等溶液的凝固點降低值簡單地依賴于鹽和水的比例;如果幾種鹽同時溶在水中,凝固點的降低值具有加和性(布拉格登定律)。1885年,范霍夫根據他的研究指出:酸、堿、鹽溶液中的溶質粒子似乎要比同摩爾濃度的有機物溶液中的粒子多。1887年,法國化學家拉烏爾(F.M. Raoult,1830~1910,法)在研究了水溶液和非水溶液蒸汽壓降低問題之后,發現各種溶液的相對蒸汽壓降低值跟溶質的分子分數成正比、跟溫度無關(拉烏爾定律),并發表了由熱力學推導出的凝固點降低公式和沸點升高公式,兩者都正比于溶質的摩爾分數。這些研究成果對阿累尼烏斯的電離假說是有力的支持。阿累尼烏斯指出:凡是不遵守范霍夫的凝固點降低公式、沸點升高公式和滲透壓公式的溶液顯然都是能夠導電的酸、堿、鹽電解質溶液,在這些公式的右邊都要乘上范霍夫提出的系數i(i>1),才能符合實驗結果,這正是電離使溶液內溶質粒子增加造成的結果。如果一個分子離解為n個離子,則i=1+(n-1)α。阿累尼烏斯利用他人以及自己測定的電導數據計算α值,所得的i值跟實驗所得的i值符合得很好,通過兩個完全不同的途徑和方法得到相同的i值,有力地證明了電離假說的正確性。1887年,阿累尼烏斯發表論文“論水溶液中物質的電離”,全面地闡述了電離學說的基本內容。自此,阿累尼烏斯的電離假說正式成為阿累尼烏斯電離學說。
3 “假設—證明”方法在化學教學中也具有重要的作用
“假設—證明”方法在化學教學實踐中也具有重要的作用,下面介紹兩個實例。讀者不難通過分析和思考得出上述結論。
實例1 用“假說—證明”方式進行“弱電解質的電離”教學
“弱電解質的電離”教學涉及弱電解質概念、電離平衡移動和電離常數,是研究電解質溶液、學習電化學知識,進行后續學習的重要基礎。同時又是對先期所學化學平衡理論進一步延伸、拓展和鞏固的重要題材。由于涉及到物質微粒的荷電現象、物質微粒的動態運動,無法直觀、比較抽象,它不但是中學化學的重要內容,又是高中化學的難點內容。
在其教學中通常先通過實驗和討論讓學生認識到不同電解質的電離程度強弱不同,因而電解質有強弱之分,進而形成弱電解質概念。為了使學生形成弱電解質電離平衡、電離平衡移動和電離常數等概念,還需要引導學生認識到“不同弱電解質的電離程度也有區別”以及弱電解質電離的特點、建立弱電解質電離及電離平衡假說并予以證明。為此,需要引導、組織學生嘗試根據化學平衡移動規律預測弱電解質電離平衡移動現象,想象弱電解質電離及其平衡移動的微觀圖景并且用實驗進行檢驗……,才可能最終確立關于弱電解質電離的理性認識。教師組織學生利用數字pH計測定并比較三種濃度鹽酸與醋酸的pH,以及未知酸的pH,對實驗數據進行電解質的強弱之分、強弱電解質的差異、同為弱電解質的醋酸與未知酸的差異3個層面的分析,然后進行討論,應用“假說—驗證”方法較好地進行了“弱電解質的電離”教學[10]。
實例2 通過“假說—證明”活動嘗試解釋異常現象
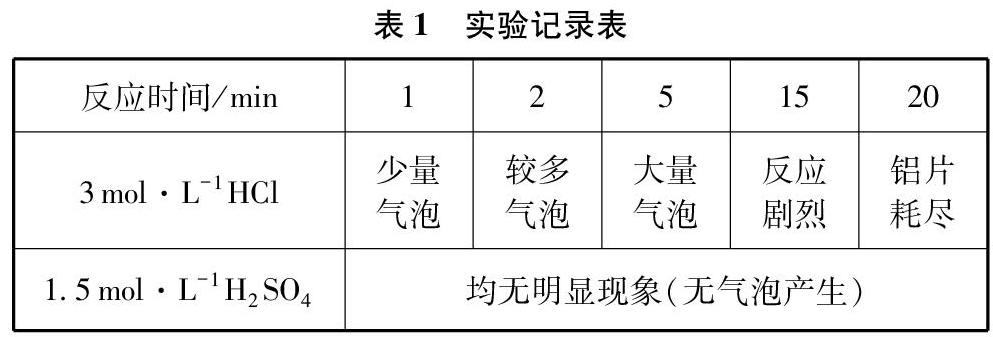
往二支相同的試管中各加入一片鋁片(純度高于99.5%且大小相同),再分別加入等體積的3mol/L HCl和1.5mol/L H2SO4,實驗結果如表1所示:
學生發現,雖然都是Al和H+反應,且H+濃度相同,卻產生了不同現象。為什么會這樣?如何解釋這個現象?
為解決這個問題,教師和學生通過討論共同確定并關注了兩點:第一,鋁的表面有一層致密氧化鋁保護膜;第二,酸溶液的陰離子不同,一個是Cl-,另一個是SO2-4。在此基礎上以猜測形式提出兩個假說:(1)Cl-能促進Al與H+的反應;(2)SO2-4不會促進Al與H+的反應。
為檢驗這兩個假說,教師和學生又做了下面兩個實驗:
實驗一:將一鋁片放入3mol·L-1HCl中,產生大量氣泡;再加入1.4g Na2SO4晶體(約0.01mol),產生氣泡的速率無明顯變化。
結論一:SO2-4不會促進,也不會阻礙Al與H+的反應。
實驗二:將一鋁片放入1.5mol·L-1 H2SO4中,無明顯現象;再加入0.5g NaCl晶體(約0.01mol),幾分鐘后有大量氣泡產生。
結論二:Cl-能促進Al與H+的反應。
綜合結論:由于Cl-能促進Al與H+的反應從而破壞鋁片表面的氧化膜,使H+直接與Al反應生成H2,而SO2-4不能促進Al與H+的反應,不會破壞鋁片表面的氧化膜,所以鋁片在稀鹽酸中能夠迅速產生氫氣,而在稀硫酸中卻看不到明顯現象。
嚴格地說,上述結論二還是假說,還需要進一步證明,特別是理論的支持。一些研究者發現:在某些環境下,許多金屬的表面能夠形成具有防腐蝕效果的鈍化膜。然而,當有氯離子存在時,鈍化膜會破裂發生點蝕,使鈍化膜對材料的保護作用失效,表現出氯離子對鈍化膜有活化作用[11]。這是可以支持結論二的。但是,氯離子的“活化”機理很復雜,有著不同的“理論”。例如,有人認為氯離子是陽極過程的強活化劑,而不是著眼于鈍化膜[12]。這些“理論”還有待于進一步證明,未完全擺脫假說性質。
參考文獻:
[1]Kasser J L,Walz L,Leven J. Philosophy of science [M]. Florida:The Texching Company,2006:24.
[2][6]《化學發展簡史》編寫組編寫. 化學發展簡史[M]. 北京:科學出版社,1980:94~100,216~218.
[3]袁翰青,應禮文合編. 化學重要史實[M]. 北京:人民教育出版社,2000:70~78.
[4][8]劉宗寅,呂志清編著. 化學發現的藝術[M]. 青島:中國海洋大學出版社,2003:94~96,99~102.
[5][保]卡. 馬諾洛夫著. 世界著名化學家的故事[M]. 北京:科學普及出版社,1987:167~184.
[7]袁翰青,應禮文合編. 化學重要史實[M]. 北京:人民教育出版社,2000:317.
[9]應禮文. 阿累尼烏斯與電離理論[J]. 大學化學,1987,2(5):55~59.
[10]馮晴. “弱電解質的電離”課例的再研究[J]. 化學教學,2016,(9):43~45.
[11]李俊生. 氯離子活化機理簡介[J]. 中學化學,2011,(3):19.
[12][蘇]Н. Н. 畢畢柯夫等著. 《海船電化學保護》翻譯組譯. 海船電化學保護[M]. 北京:國防工業出版社,1975:10.

