啟發(fā)思維在化學(xué)實(shí)驗(yàn)設(shè)計(jì)及評價(jià)中的應(yīng)用
李玉亮

摘 要:本文采用分割問題啟發(fā)、遞進(jìn)啟發(fā)、假設(shè)啟發(fā)與對比啟發(fā)等方法對蘇教版必修一專題4《硫、氮和可持續(xù)發(fā)展》中的化學(xué)實(shí)驗(yàn)設(shè)計(jì)進(jìn)行教學(xué),發(fā)現(xiàn)啟發(fā)思維在化學(xué)實(shí)驗(yàn)設(shè)計(jì)及評價(jià)中的應(yīng)用,教學(xué)效果很好。
關(guān)鍵詞:啟發(fā)思維;實(shí)驗(yàn)設(shè)計(jì)驗(yàn)證;評價(jià)
化學(xué)是一門以實(shí)驗(yàn)為基礎(chǔ)的自然科學(xué),是可以提高生活和生命質(zhì)量的科學(xué)。自“3+1+2”高考方案實(shí)施以來,據(jù)調(diào)查,選擇化學(xué)科目的學(xué)生大量減少,這個(gè)現(xiàn)象令人擔(dān)憂。作為一名高中化學(xué)老師,我們要不斷調(diào)整自己的教學(xué)方法,讓化學(xué)課堂更加生動(dòng)、有趣;讓學(xué)生想學(xué)化學(xué)、愛學(xué)化學(xué)!
高考對化學(xué)實(shí)驗(yàn)內(nèi)容的考查要求:①設(shè)計(jì)實(shí)驗(yàn)方案;②正確選用實(shí)驗(yàn)裝置;③掌握控制實(shí)驗(yàn)條件的方法;④預(yù)測或描述實(shí)驗(yàn)現(xiàn)象、分析或處理實(shí)驗(yàn)數(shù)據(jù),得出實(shí)驗(yàn)結(jié)論;⑤評價(jià)或改進(jìn)實(shí)驗(yàn)方案。對于高一新生,個(gè)體化學(xué)水平參差不齊,遇上綜合性較強(qiáng)的題目往往無從入手,這樣就容易產(chǎn)生對化學(xué)的恐懼心理,覺得化學(xué)很難,這就需要教師在平時(shí)的教學(xué)中善于設(shè)計(jì)啟發(fā)性問題,由易到難,層層深入,逐一解決問題,啟發(fā)思維與實(shí)驗(yàn)設(shè)計(jì)的有機(jī)結(jié)合,能幫助學(xué)生攻克化學(xué)難題,這對于培養(yǎng)學(xué)生的綜合能力也是十分重要。
啟發(fā)教學(xué)是指教師對學(xué)生的思維進(jìn)行的引導(dǎo)行為。它可以指導(dǎo)學(xué)生思考、深層領(lǐng)悟。
啟發(fā)性原則就是教師在課堂上要承認(rèn)學(xué)生的主體地位,千方百計(jì)想方設(shè)法調(diào)動(dòng)學(xué)生學(xué)習(xí)的積極性主動(dòng)性,引導(dǎo)學(xué)生合作互助積極思考,勇于探索,提高學(xué)生分析問題和解決問題的能力。本文主要談?wù)剢l(fā)思維在化學(xué)實(shí)驗(yàn)設(shè)計(jì)及評價(jià)中的應(yīng)用。
一、分割問題啟發(fā)與遞進(jìn)啟發(fā)
啟發(fā)教學(xué)重在啟發(fā),以學(xué)生為主體,對困難的問題進(jìn)行分割啟發(fā),設(shè)立問題情境,引導(dǎo)學(xué)生質(zhì)疑問題,合作釋疑,歸納總結(jié),最終將問題逐一擊破。最后教師引導(dǎo)學(xué)生對同種類型的問題進(jìn)行類推啟發(fā),在學(xué)生理解的基礎(chǔ)上,進(jìn)一步深挖,達(dá)到理解透徹的目的。
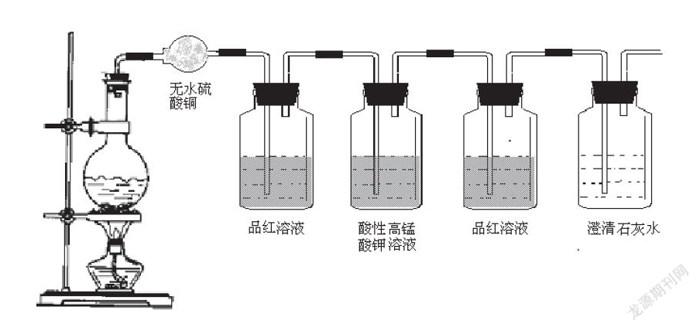
案例一:C+2H2SO4 (濃)=加熱==CO2↑+2SO2 ↑+2H2O
思考:如何設(shè)計(jì)實(shí)驗(yàn),逐一驗(yàn)證上述反應(yīng)產(chǎn)物?
(教學(xué)背景:對于初學(xué)含硫化合物性質(zhì)的高一學(xué)生來說,設(shè)計(jì)實(shí)驗(yàn)逐一驗(yàn)證碳與濃硫酸的反應(yīng)產(chǎn)物,有一定困難,我首先提供出一些實(shí)驗(yàn)裝置,以拋出問題的形式,把設(shè)計(jì)實(shí)驗(yàn)分割成一套套獨(dú)立的檢驗(yàn)裝置,啟發(fā)學(xué)生主動(dòng)思考)
分割啟發(fā)思維:
1.讓學(xué)生說說每個(gè)裝置在檢驗(yàn)過程中所起的作用?
2.驗(yàn)證產(chǎn)物時(shí)應(yīng)有怎樣的前后順序?若裝置順序改變,對驗(yàn)證結(jié)果是否有影響,為什么?
3.CO2和SO2都能使澄清石灰水白色渾濁,檢驗(yàn)CO2時(shí)如何排除SO2的干擾?
學(xué)生積極參與,逐一解決問題,最終成功的把整套實(shí)驗(yàn)裝置完美的鏈接起來。
遞進(jìn)啟發(fā)思維:
①能否把裝有無水硫酸銅的干燥管移到裝有澄清石灰水的試劑瓶后連接呢?請說明理由?
②能否把酸性高猛酸鉀溶液和澄清石灰水間的品紅溶液省掉?若可以,應(yīng)該符合什么條件?
③酸性高猛酸鉀的作用是用來除去二氧化硫,能否用氯水或溴水替代酸性高猛酸鉀呢?
如果可以,分別會(huì)有怎樣的實(shí)驗(yàn)現(xiàn)象?
④證明有二氧化碳產(chǎn)生的實(shí)驗(yàn)現(xiàn)象應(yīng)該怎樣表述?
教師通過遞進(jìn)啟發(fā)性問題引領(lǐng)學(xué)生不斷思考不斷探究,讓學(xué)生覺得化學(xué)課堂太有趣了,就像是在解決“十萬個(gè)為什么”,而老師那里好像永遠(yuǎn)都有無數(shù)個(gè)“為什么”,化學(xué)老師就像是神奇的魔術(shù)師。教師通過一個(gè)個(gè)啟發(fā)性問題的拋出和引導(dǎo)學(xué)生不斷地解決問題,使得師生間、學(xué)生間的情感產(chǎn)生碰撞,拉近了彼此間的距離,進(jìn)而有效地提高教學(xué)質(zhì)量,建立了化學(xué)老師在學(xué)生心中的偶像地位。
案例二:設(shè)計(jì)一套實(shí)驗(yàn)裝置,逐一驗(yàn)證二氧化硫的性質(zhì)。
(教學(xué)背景:在學(xué)生學(xué)習(xí)完二氧化硫的物理性質(zhì)與化學(xué)性質(zhì)之后,引導(dǎo)啟發(fā)學(xué)生,設(shè)計(jì)一套實(shí)驗(yàn)裝置,逐一驗(yàn)證二氧化硫各個(gè)化學(xué)性質(zhì)。)
分割啟發(fā)思維:
1.驗(yàn)證SO2各化學(xué)性質(zhì)分別需要選擇什么裝置?驗(yàn)證過程中能觀察到什么實(shí)驗(yàn)現(xiàn)象?
2.這些裝置需要有怎樣的先后順序?
3.SO2有毒,驗(yàn)證實(shí)驗(yàn)結(jié)束,是否需要尾氣處理,選擇什么試劑對SO2進(jìn)行吸收處理?
有了以上經(jīng)驗(yàn),問題一拋出,學(xué)生馬上開始羅列各個(gè)實(shí)驗(yàn)裝置,①驗(yàn)證SO2是酸性氧化物可選擇紫色石磊試液;②驗(yàn)證SO2的漂白性可選擇品紅溶液③SO2通入硫化鈉溶液中產(chǎn)生黃色沉淀可驗(yàn)證SO2氧化性④SO2使酸性高猛酸鉀褪色、SO2使氯水、溴水褪色都可用來驗(yàn)證SO2的還原性。學(xué)生負(fù)責(zé)設(shè)計(jì),教師負(fù)責(zé)在黑板上把裝置圖畫出來,師生齊力合作,共同完成實(shí)驗(yàn)設(shè)計(jì)。此時(shí)教師可以采用提問的方式,讓學(xué)生自己組織語言,把各個(gè)裝置的作用及實(shí)驗(yàn)現(xiàn)象描述出來,而老師只需在一旁做必要的補(bǔ)充,如此遞進(jìn)啟發(fā),反復(fù)強(qiáng)調(diào),加深了學(xué)生對實(shí)驗(yàn)的理解。
二、假設(shè)啟發(fā)與實(shí)驗(yàn)驗(yàn)證
在設(shè)計(jì)化學(xué)實(shí)驗(yàn)方案時(shí),教師可以鼓勵(lì)學(xué)生大膽做出假設(shè),討論實(shí)驗(yàn)方案,設(shè)計(jì)實(shí)驗(yàn)步驟,依據(jù)實(shí)驗(yàn)操作,觀察實(shí)驗(yàn)現(xiàn)象,做好實(shí)驗(yàn)記錄,實(shí)驗(yàn)結(jié)束時(shí),學(xué)生可以根據(jù)實(shí)驗(yàn)事實(shí)驗(yàn)證實(shí)驗(yàn)假設(shè),最終得出結(jié)論。
案例三:SO2使滴有酚酞的NaOH溶液紅色褪去原理探究。
教師演示實(shí)驗(yàn):將新制的SO2通入滴有酚酞的NaOH溶液中,觀察到溶液紅色褪去。
啟發(fā)問題:產(chǎn)生上述現(xiàn)象原因可能有兩種:①酚酞遇堿變紅,將SO2通入滴有酚酞的
NaOH溶液中,SO2消耗NaOH,削弱溶液堿性,使得溶液紅色褪去。②SO2有漂白性,可能使指示劑失效,能否設(shè)計(jì)實(shí)驗(yàn)證明是哪一種原因產(chǎn)生的褪色現(xiàn)象?如何設(shè)計(jì)實(shí)驗(yàn)?
學(xué)生討論結(jié)果:繼續(xù)向褪色的溶液中滴加NaOH,若溶液恢復(fù)紅色則說明SO2是酸性氧化物,若溶液仍為無色說明SO2有漂白性;教師可以邀請一位學(xué)生上臺(tái)演示實(shí)驗(yàn):往褪色的溶液中繼續(xù)滴加NaOH溶液。
實(shí)驗(yàn)證明:往褪色的溶液中繼續(xù)滴加NaOH溶液,溶液重新恢復(fù)紅色。說明SO2不能漂白酸堿指示劑。
三、對比啟發(fā),謹(jǐn)防混淆
對比啟發(fā)常用于易混淆知識的教學(xué),可通過對知識內(nèi)容的概念,研究對象,本質(zhì)特征進(jìn)行比較,提高學(xué)生對易混知識的鑒別能力,進(jìn)而更好的掌握所學(xué)知識。
案例四:濃硫酸吸水性與脫水性性質(zhì)判斷。
高一新生容易混淆濃硫酸吸水性和脫水性,此時(shí)可應(yīng)用對比啟發(fā)教學(xué)。首先概念對比:吸水性是指濃硫酸吸收現(xiàn)成游離的水分子。脫水性是指濃硫酸將有機(jī)物中的H、O按原子個(gè)數(shù)比2:1(即水的組成比例)脫去。對比結(jié)論:吸水性的對象原來就有水;脫水性的對象原來沒有水。吸水性的本質(zhì)特征:對象由潮濕變干燥;脫水性的本質(zhì)特征:即是碳化,對象由干燥狀態(tài)變黑(有碳生成)。在學(xué)生已有的理論基礎(chǔ)上,輔以實(shí)驗(yàn)分析,能收獲意想不到的效果。
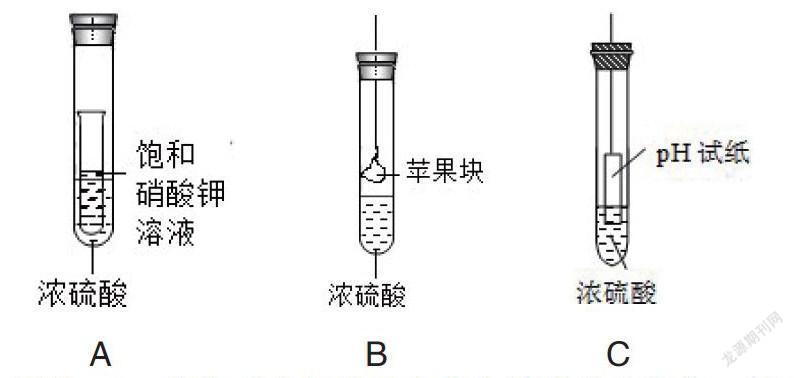
隨堂檢測:下圖所示三種實(shí)驗(yàn)方案,能驗(yàn)證濃硫酸吸水性質(zhì)的是:
解析:A、飽和硝酸鉀溶液中的水被濃硫酸吸收,導(dǎo)致溶劑減少,溶液過飽和,故有白色晶體析出,體現(xiàn)濃硫酸的吸水性。B、蘋果塊中的水分被濃硫酸吸收,蘋果塊會(huì)干癟,體現(xiàn)濃硫酸吸水性。C、pH試紙本身是干燥的,不含水分。但因?yàn)樵嚰埵怯袡C(jī)物,含有碳、氫、氧等元素,濃硫酸能將pH試紙中的氫和氧元素按水的組成脫去,使試紙變黑,體現(xiàn)濃硫酸的脫水性。對比啟發(fā),重在對比,越比較越清楚。
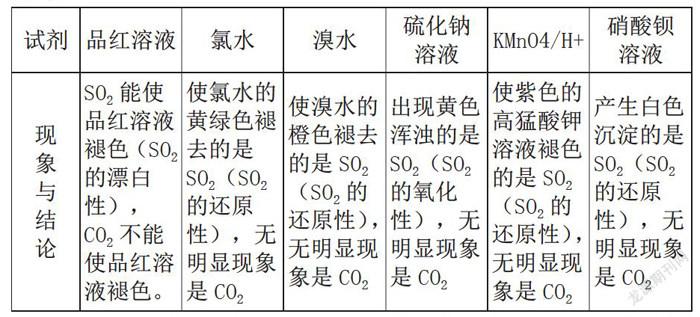
又如:SO2與CO2都是酸性氧化物,二者都能使澄清石灰水變渾濁,并且如果通入過量氣體,則生成的沉淀可以再溶解。為了使學(xué)生能更好區(qū)別掌握這兩種氣體。我們可以對比歸納如下:
通過對知識點(diǎn)的歸納比較,能幫助學(xué)生把學(xué)過的知識聯(lián)系起來,形成知識網(wǎng)絡(luò),固化知識;還能幫助學(xué)生辨析差異,謹(jǐn)防混淆。教師通過設(shè)計(jì)啟發(fā)性問題,或是對復(fù)雜問題進(jìn)行分割,或是大膽提出實(shí)驗(yàn)假設(shè),或是對比啟發(fā)教學(xué),能激發(fā)學(xué)生學(xué)習(xí)興趣,引導(dǎo)學(xué)生更好地完成實(shí)驗(yàn)設(shè)計(jì),學(xué)生探索性、參與性強(qiáng);突出了以學(xué)生為主體,教師為主導(dǎo)的授課方式。在交流互動(dòng)中,學(xué)生的思維方式和思維能力均得到了提高,有利于培養(yǎng)學(xué)生的創(chuàng)新能力,有利于落實(shí)“雙主模式”的教學(xué)。
四、教學(xué)反思
授課過程中,發(fā)現(xiàn)學(xué)生在處理實(shí)驗(yàn)設(shè)計(jì)和評價(jià)時(shí),一般會(huì)存在以下問題:①對實(shí)驗(yàn)原理理解不夠深入;②對儀器選擇,實(shí)驗(yàn)操作不夠自信;③對“題眼”入手,把控不夠精準(zhǔn);④對實(shí)驗(yàn)現(xiàn)象的描述不夠規(guī)范化。這也說明在實(shí)驗(yàn)設(shè)計(jì)及評價(jià)的教學(xué)中,我們還有很大的挖掘空間。
參考文獻(xiàn)
[1] 朱志慧.巧設(shè)情鏡,讓學(xué)生發(fā)現(xiàn)問題并解決問題[J].化學(xué)教與學(xué),2014(11).
[2] 李玉炫.化學(xué)實(shí)驗(yàn)題的評析及實(shí)證[J].化學(xué)教學(xué), 2016(2).
[3] 程遇玲.淺談高中化學(xué)學(xué)科核心素養(yǎng)的培養(yǎng)[J].中學(xué)化學(xué)教學(xué)參考,2017(7).
[4] 教育部.普通高中化學(xué)課程標(biāo)準(zhǔn)(2017年版)[S].北京:人民教育出版社,2018.

