蘿卜紫紅葉色突變體的色素含量及光合特性研究
蒲全明, 楊鵬*, 雍磊, 鄧榆川, 何自涵,林邦民*, 施松梅, 向承勇, 方芳
(1.南充市農業科學院, 四川 南充 637000; 2.西南大學資源環境學院, 重慶 400716)
葉色突變作為植物界中比較常見的突變性狀,其發生頻率相對較高,多由自然突變、插入突變、物理化學誘變等原因引起[1]。葉色突變體被廣泛用于植物光合系統[2-3]、色素合成[4-6]、抗病機制[5]及遺傳發育調控機制[7-8]等方面的研究,也可被作為標記性狀用于輔助育種及雜交種子的生產[9-10],是研究植物葉片色彩變異形成機制、分析鑒定基因功能與創制優異種質的理想材料。
目前,已在水稻[11]、玉米[12]、大豆[13]、小麥[14]、棉花[15]等大田作物和辣椒[16]、番茄[17]、黃瓜[18]、甘藍[19]等蔬菜作物中發現了特征顯著的葉色突變體。其中,水稻與玉米的葉色突變體超過410個[20-21],而辣椒、黃瓜、甘藍、番茄等蔬菜作物的葉色突變體則不超過60個[16-19],已報道的大田作物葉色突變體數量遠高于蔬菜作物。相較于以上植物,蘿卜作為重要的蔬菜作物,其有關葉色突變體的研究鮮有報道。本研究以野生型綠葉蘿卜Ra9為對照,以誘變獲得的蘿卜紫紅葉色突變體mu17為材料,在對突變體植物學性狀進行觀測的同時,測定其光合特性和色素含量,并采用透射電鏡觀察了葉綠體結構,采用qRT-PCR檢測了蘿卜葉片花青素代謝與調控路徑相關基因的表達差異,以期探明蘿卜葉色突變體在植物學性狀、光合特性、光合色素、花青素和葉綠體結構等方面的差異,初步解析蘿卜葉片花青素含量變化的分子機制,為后期定位突變基因、研究基因功能及育種應用奠定基礎。
1 材料與方法
1.1 試驗材料
植物材料為胭脂蘿卜自交系Ra9(WT),由南充市農業科學院通過提純地方胭脂蘿卜品種獲得。蘿卜紫紅葉色突變體mu17為Ra9經化學誘變劑EMS處理后獲得,經多代自交形成穩定遺傳的自交系。2019年10月8日,在四川省南充市農業科學院試驗基地(北緯30°75′,東經106°26′)將蘿卜突變體及其野生型品系于自然條件下播種,各3畦,常規田間管理。
1.2 植物學性狀統計
于播種后45、60、75 d時,分別取野生型Ra9與突變體mu17植株各6株,測定株高、株幅等性狀。
1.3 葉片色素含量測定
蘿卜葉片葉綠素及類胡蘿卜素含量的測定方法:在蘿卜材料播種后45、60、75 d時,由內向外取第4片基生葉的0.5 g葉片鮮樣,經80%丙酮研磨后,黑暗條件下浸提24 h,定容至10 mL;測定470、645、663 nm處的吸光值,并參照李合生[22]的方法計算葉綠素a、葉綠素b、類胡蘿卜素和葉綠素總量。
蘿卜葉片花青素的含量按Gou等[23]的方法進行測定。在蘿卜材料播種后45、60、75 d時,由內向外取第4片基生葉的1 g葉片鮮樣,粉碎后,加入花青素萃取劑(含5%HCl的80%甲醇)4 mL,于4 ℃條件下浸提過夜;于530、620、650 nm波長下測定吸光值。
花青素光密度值(ODλ)計算公式如下。
ODλ=(OD530-OD620)-0.1 × (OD650-OD620)
(1)
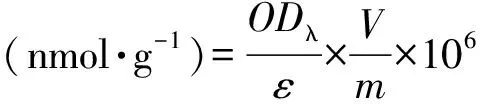
(2)
式中,ε為花青素的摩爾消光系數,4.62×106;V為提取液總體積,mL;m為取樣質量,g。
1.4 光合速率測定
在蘿卜播種后50 d左右,采用便攜式光合作用測量系統(LI-6400XT,Portable Photosynthesis System,USA)于晴朗無風的上午9:00—11:00測定蘿卜葉片的光合速率。每個材料隨機選擇5株,取由內向外第4片基生葉,使用開放氣路測定葉片的凈光合速率(net photosynthetic rate,Pn)、氣孔導度(stomatal conductance,Gs)、胞間CO2濃度(intercellular CO2concentration,Ci)及蒸騰效率(transpiration rate,Tr)。
1.5 透射電鏡觀察葉綠體
在蘿卜播種后50 d左右,取突變體mu17與野生型對照Ra9植株由內到外的第3片基生葉,用鋒利小刀切成大小約為0.5 cm2小塊,置于3%戊二醛固定液中預固定,經1%四氧化鋨再固定。經丙酮逐級梯度脫水后,將樣品先后經過脫水劑和環氧樹脂滲透液的滲透處理,比例分別為3∶1、1∶1、1∶3,每步30~60 min。將滲透好的樣品塊放置模具中包埋后,采用超薄切片機(EM UC7,德國Leica)制成約50 nm厚的超薄切片。室溫下,先用醋酸鈾染色15~20 min,再用枸櫞酸鉛染色15~20 min;最后用JEM-1400PLUS透射電子顯微鏡(日本JEOL)觀察和拍照。
1.6 花青素代謝及調控路徑相關基因的表達分析
以蘿卜播種45 d后的由內向外第4片基生葉為材料,參照植物總RNA提取試劑盒(RNAiso Plus,Takara,中國大連)說明書提取RNA;然后,利用MMLV逆轉錄酶(Takara,中國大連)合成cDNA,稀釋至同一濃度,用于基因表達分析。
依據NCBI已公布蘿卜RsCHS、RsCHI、RsF3H、RsMYB3、RsMYB4、RsMYB114與bHLH155的堿基序列,利用軟件Primer 6.0設計各基因的熒光定量PCR引物(表1);選取RNA聚合酶II基因(RsRPII)作為內參基因[24]。分別以上述cDNA作為模板,用表1中的相應引物,采用TaKaRa SYBR?Premix Ex TaqTM II(Tli RNaseH Plus)試劑盒(寶生物工程有限公司)提供的25 μL反應液體系,通過CFX Manager Software 在熒光定量PCR儀(C1000/CFX96 ,美國Bio-Rad)上進行qRT-PCR反應。反應程序為: 95 ℃預變性30 s;95 ℃變性5 s,退火溫度30 s,40個循環。反應結束后采用2-ΔΔCT法計算相對表達量。
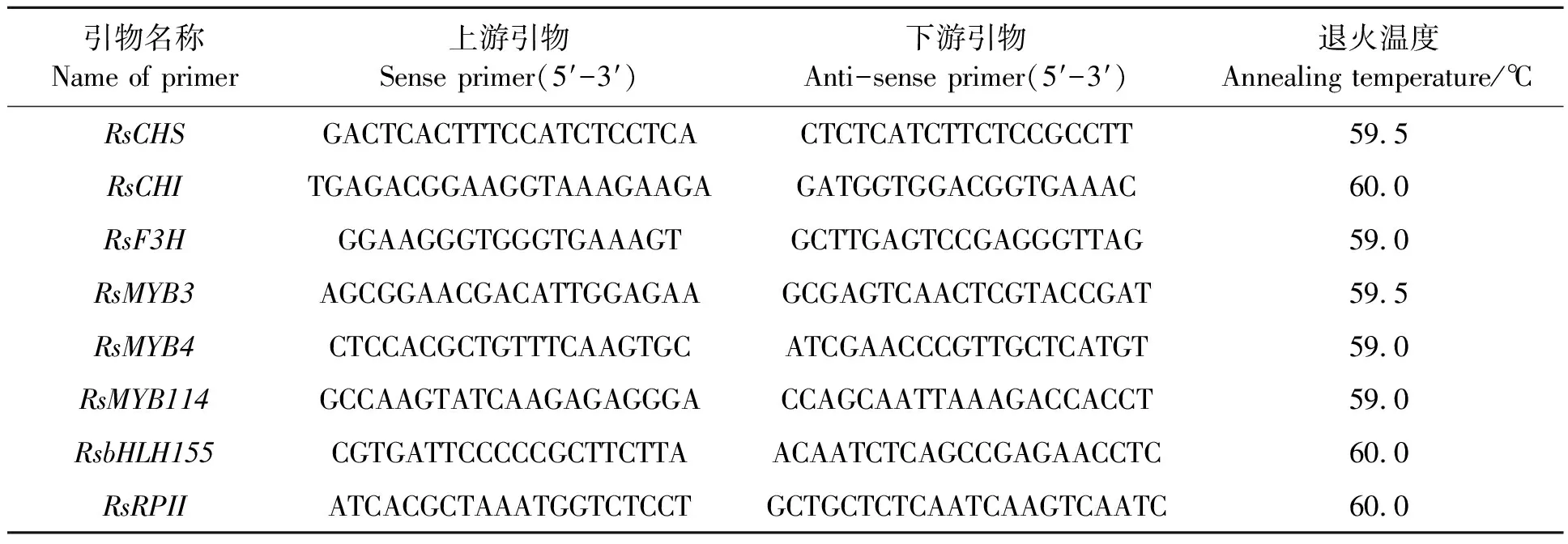
表1 熒光定量PCR引物Table 1 Primers for qRT-PCR
1.7 統計分析
采用軟件Microsoft Excel 2013進行試驗數據的統計分析,通過軟件SPSS 13.0對數據進行方差分析及顯著性檢驗。
2 結果與分析
2.1 蘿卜葉色突變體mu17的表型及植物學性狀
圖1顯示,與野生型Ra9相比,突變體mu17的子葉邊緣、下胚軸及真葉均為紫紅色;葉片在整個營養生長期內沒有轉綠,始終表現為紫紅色。在葉片的生長過程中,雖然野生型Ra9與突變體mu17的葉柄均為紅色,但突變體mu17的葉脈也表現為紅色,而且葉面少刺毛。
除了蘿卜葉片的顏色有明顯區別外,葉色突變體的生長狀況也有一定程度變化。圖2結果顯示,在45 d時,突變體mu17的株高與株幅分別為野生型Ra9的0.71、0.59倍;在60 d時,突變體mu17的株高與株幅分別為野生型Ra9的0.78、0.64倍;在75 d時,突變體mu17的株高與株幅分別為野生型Ra9的0.70、0.74倍,突變體植株相對野生型更加矮小,葉片也明顯變小。由此可見,相比于同一時期的野生型Ra9植株,突變體mu17生長較為緩慢,長勢相對更弱,株高與株幅極顯著低于野生型對照Ra9。

A:野生型Ra9播種2周的植株形態;B:突變體mu17播種2周的植株形態;C:野生型Ra9播種4周的植株形態;D:突變體mu17播種4周的植株形態。A: Plant morphology of wild type Ra9 after 2 weeks of sowing; B: Plant morphology of mutant mu17 after 2 weeks of sowing; C: Plant morphology of wild type Ra9 after 4 weeks of sowing; D: Plant morphology of mutant mu17 after 4 weeks of sowing.圖1 蘿卜野生型Ra9與突變體mu17的形態特征Fig.1 Morphological characteristics of wild type Ra9 and mutant mu17 in radish
2.2 葉片光合特性分析
表2結果表明,mu17的凈光合速率(Pn)明顯低于野生型,為野生型Ra9的88.82%,差異顯著;mu17的氣孔導度(Gs)、胞間CO2濃度(Ci)、蒸騰速率(Tr)均極顯著高于野生型,分別高出野生型Ra9的38.89%、33.20%和39.76%。由此推測,可能是紫紅葉色突變體mu17的CO2利用率較低,導致其光合速率下降。

表2 蘿卜野生型Ra9與突變體mu17的葉片光合參數Table 2 Photosynthetic parameters of wild type Ra9 and mutant mu17 in radish
2.3 葉綠體超微結構的差異分析
圖3顯示,野生型Ra9的葉綠體緊靠細胞壁分布,形狀呈半圓形或紡錘形,類囊體系統分化完全,類囊體堆積緊密,基質、基粒片層分化完全,垛疊較整齊,有淀粉粒;突變體mu17的葉綠體形狀不規則,部分基粒結構分化不完全,基質片層分化較好,有淀粉粒。由此可見,突變體mu17的葉綠體結構發生了一定程度的變化,這也可能是突變體光合速率降低,植株生長緩慢的原因之一。
2.4 葉片色素含量差異
2.4.1光合色素含量比較 表3顯示了不同時期蘿卜葉片光合色素含量。由表3結果可以看出,不同時期紫紅葉色突變體mu17中的葉綠素a、葉綠素b和類胡蘿卜素含量顯著低于野生型對照Ra9的含量。相比于野生型Ra9,播種后45、60、75 d的突變體mu17葉片中葉綠素a含量分別減少了16.28%、18.18%、15.00%,差異均極顯著;葉綠素b減少了14.04%、15.25%、12.07%,差異均極顯著;類胡蘿卜素減少了17.39%、16.00%、8.70%,差異極顯著或顯著。以上結果說明,突變體mu17的總葉綠素含量低于野生型Ra9,且葉綠素a與葉綠素b的降幅相對較大,這也可能是該突變體材料光合速率下降的原因之一。
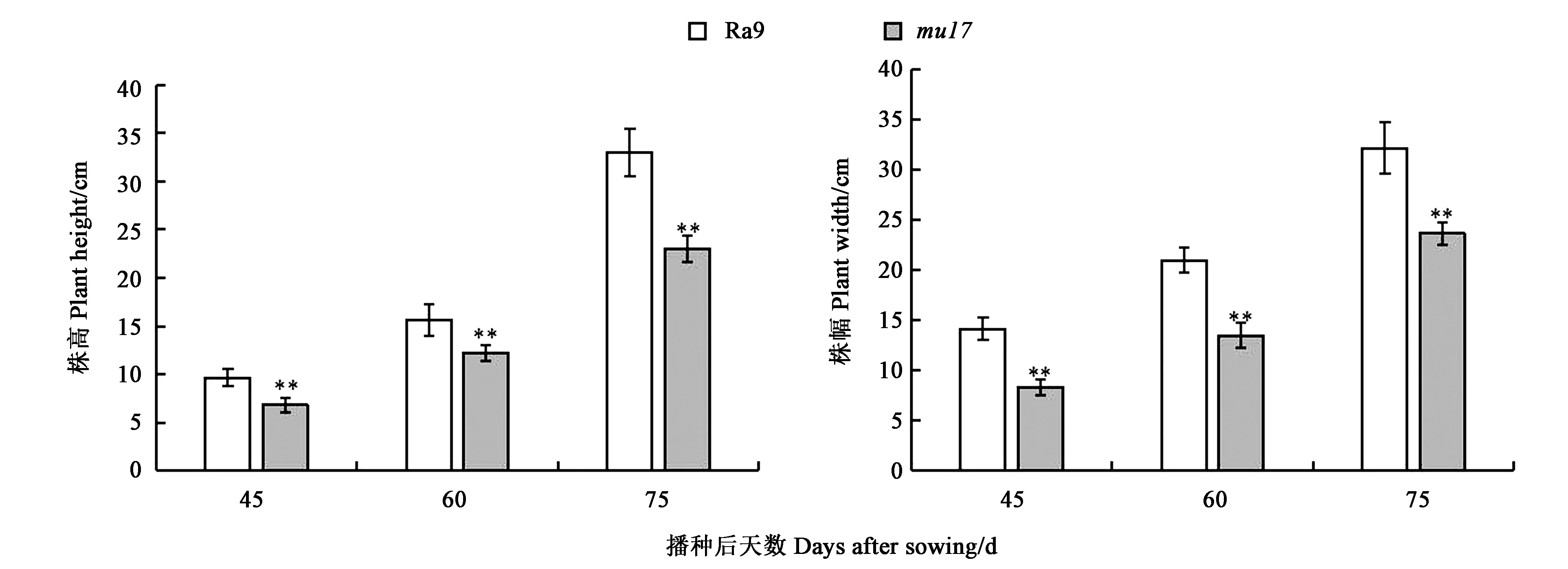
注:**表示在P<0.01水平差異顯著。Note: ** indicates significant difference at P<0.01 level.圖2 不同時期蘿卜野生型Ra9與突變體mu17株高和株幅Fig.2 Plant height and plant width of wild type Ra9 and mutant mu17 in radish at different stages
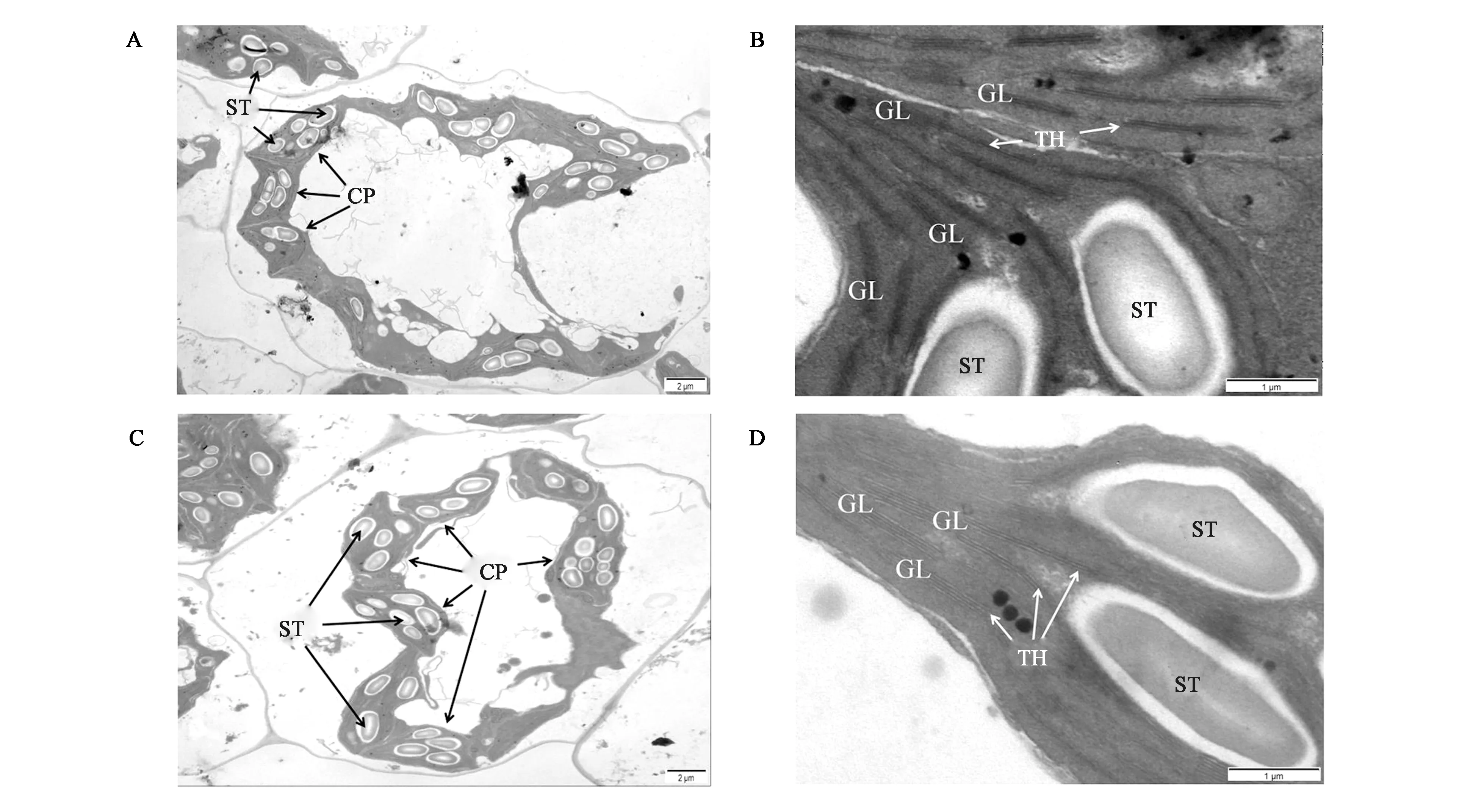
A: 野生型Ra9的葉綠體超微結構(標尺=2 μm);B: 野生型Ra9的葉綠體超微結構(標尺=1 μm);C: 突變體mu17的葉綠體超微結構(標尺=2 μm);D: 突變體mu17的葉綠體超微結構(標尺=1 μm)。CP—葉綠體;ST—淀粉粒;TH—類囊體;GL—基粒片層。A: Chloroplast ultrastructure of wild type Ra9 (Scale bar=2 μm); B: Chloroplast ultrastructure of wild type Ra9 (Scale bar=1 μm); C: Chloroplast ultrastructure of mutant mu17 (Scale bar=2 μm); D: Chloroplast ultrastructure of mutant mu17 (Scale bar=1 μm) ; CP— Chloroplast; ST— Starch granule; TH— Thylakoid; GL— Grana lamellae.圖3 蘿卜野生型Ra9與突變體mu17的葉綠體超微結構Fig.3 Chloroplast ultrastructure of wild type Ra9 and mutant mu17 in radish

表3 蘿卜野生型Ra9與突變體mu17的葉片光合色素含量Table 3 Photosynthetic pigment content in leaf of wild type Ra9 and mutant mu17 in radish
2.4.2花青素含量比較 圖4結果表明,紫紅葉色突變體mu17的花青素含量明顯高于野生型對照Ra9的含量。在播種后45、60、75 d的突變體mu17葉片中花青素含量分別為1.03、1.17、1.34 nmol·g-1,分別是同時期野生型Ra9花青素含量的27、22、25倍,差異極顯著。因此,推測突變體材料中花青素含量的明顯升高,是造成突變體的葉片表現為紫紅色的主要原因。

注:**表示與Ra9相比在P<0.01水平差異顯著。Note:** indicates significant difference at P<0.01 level compared with Ra9.圖4 不同時期蘿卜Ra9與突變體mu17的花青素含量比較Fig.4 Comparison of anthocyanin contents between wild type Ra9 and mutant mu17 in radish at different stages
2.5 花青素代謝相關基因的表達水平差異
花青素代謝異常是導致植物葉色變化的重要原因之一。為了進一步探究蘿卜突變體葉片花青素積累的可能分子機制,以蘿卜突變體mu17及野生型Ra9的葉片為材料,對花青素代謝途徑中的結構基因與轉錄因子進行了熒光定量PCR檢測。
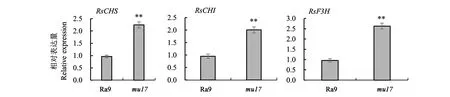
2.5.1結構基因RsCHS、RsCHI、RsF3H的表達分析 圖5結果顯示,基因RsCHS、RsCHI、RsF3H在紫紅葉色突變體mu17葉片中的表達量分別為綠色野生型Ra9葉片的2.33、2.11、2.72倍,上調明顯。由此可見,相對于野生型Ra9,紫紅葉色突變體mu17葉片中的花青素合成途徑相關基因RsCHS、RsCHI、RsF3H均出現不同程度的上調表達。
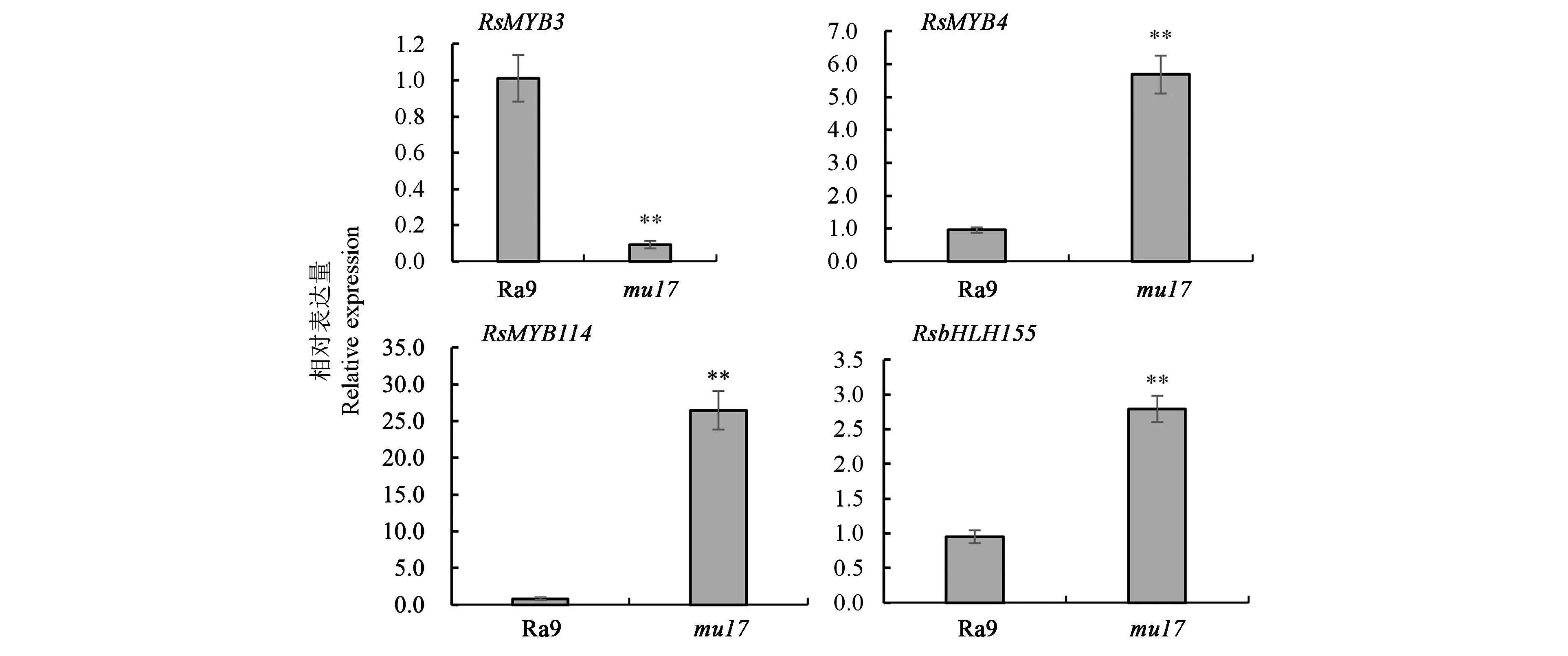
2.5.2轉錄因子RsMYB3、RsMYB4、RsMYB114、RsbHLH155的表達分析 圖6結果表明,基因RsMYB3在突變體mu17葉片中的表達量為綠色野生型Ra9葉片的0.09倍,下調明顯;基因RsMYB4、RsMYB114在突變體mu17葉片中的表達量分別為綠色野生型Ra9葉片的5.96、31.75倍,上調顯著。基因RsbHLH155在突變體mu17葉片中的表達量為綠色野生型Ra9葉片的2.93倍,上調表達明顯。由此可見,相對于野生型Ra9,紫紅葉色突變體葉片中可能參與花青素合成調控的MYB家族基因RsMYB3、RsMYB4、RsMYB114與bHLH家族基因RsbHLH155均出現明顯表達差異。
3 討論
3.1 蘿卜紫紅葉色突變體的表型及生理特性變化
近年來,有關植物葉色突變體的研究越來越多,尤其以水稻[4,20]、玉米[12]、擬南芥[25]、小麥[14]、番茄[8,17]等模式植物中的研究成果最多。研究表明,植物葉綠素代謝紊亂或花青苷代謝異常是葉片顏色突變形成的兩大主要因素[16]。其中,葉綠素代謝紊亂通常會導致葉片褪綠現象,出現黃化、白化、黃綠、淺綠、綠黃、綠白、條紋等褪綠突變體[26];花青苷代謝異常會使葉片花青素積累增多或減少,出現紫葉[14,27]、紅葉[28-29]等彩葉突變體。本研究通過化學誘變獲得一個蘿卜突變體mu17,葉片變為紫紅色,而且在整個營養生長階段均表現為紫紅色,植株生長較緩慢,這與大多數其他作物葉色突變體生長緩慢的表現一致[1]。
注: **表示與Ra9相比在P<0.01水平差異顯著。Note:** indicates significant difference at P<0.01 level compared with Ra9.圖5 花青素代謝途徑中結構基因的表達分析Fig.5 Expression analysis of structural genes in anthocyanin metabolism pathway
注: **表示與Ra9相比在P<0.01水平差異顯著。Note:** indicates significant difference at P<0.01 level compared with Ra9.圖6 花青素合成通路中轉錄因子的表達分析Fig.6 Expression analysis of transcription factors in anthocyanin synthesis pathway
植物體內色素不平衡導致葉片色彩突變的同時,也往往能夠引起葉片光合作用的變化[30]。本研究中蘿卜紫紅葉色突變體mu17的葉片花青素含量明顯高于野生型,是野生型花青素含量的15倍以上,這是突變體mu17葉片表現為紫紅色的主要原因。有研究表明,花青苷能一定程度緩解強光對葉片產生的破壞,具調節光能的作用[31];但花青苷過量積累會影響葉片對光的吸收,導致植物光合能力下降[32]。蘿卜突變體mu17氣孔導度(Gs)、胞間CO2濃度(Ci)、蒸騰速率(Tr)均極顯著高于野生型,但凈光合速率(Pn)明顯低于野生型,這可能與花青素的過量積累導致CO2利用率較低有關。植物葉綠素含量的降低會導致光合作用能力下降,引起植物生長不良[33]。本研究中蘿卜葉色突變體mu17的葉綠素含量明顯低于野生型Ra9,這可能也是其光合作用能力減弱的原因之一。由此可見,花青素含量的積累和葉綠素含量的降低是蘿卜突變體mu17葉色發生變化的主要因素,也是突變體mu17葉片光合作用下降、植株生長緩慢的主要原因。
3.2 蘿卜紫紅葉色突變體的花青素代謝及調控基因表達水平變化
目前,植物花青素的生物合成代謝途徑已被基本闡明,調控花青素合成的分子機制也正在被不斷完善。作為各類常見植物花青苷生物合成的共同前體物質,二氫黃烷醇的生物合成受到查爾酮合酶基因CHS、查爾酮異構酶基因CHI、類黃酮3羥化酶基因F3H的控制。有研究發現,在蘆筍[34]、馬鈴薯[35]、扁豆[36]、甘薯[37]、芹菜[38]、鐵皮石斛[39]、無花果[40]等作物中,富含花青素品種的CHI、CHS、F3H基因表達水平均遠高于普通品種。在十字花科植物中,相較于普通大白菜的白色心葉,紫心大白菜的紫色心葉基因BrCHI、BrCHS、BrF3H的表達量明顯上調[41];紫葉芥菜基因BjCHI、BjCHS、BjF3H在紫色子葉與葉片中的表達量明顯高于綠葉芥菜[42];蘿卜紅色肉質根的RsCHI、RsCHS、RsF3H基因表達量明顯高于蘿卜白色肉質根[43]。本研究中,基因RsCHS、RsCHI、RsF3H在蘿卜紫紅葉突變體mu17葉片中的表達量分別為綠色野生型Ra9葉片的2.33、2.11、2.72倍,上調表達顯著,與前人高花青素植物中基因CHI、CHS、F3H表達量上調的研究結果基本一致,這也說明可能是基因RsCHS、RsCHI、RsF3H的上調表達導致蘿卜紫紅葉突變體mu17葉片花青素的積累。
花青素生物合成的轉錄調控因子主要有MYB、bHLH和WDR 3類,各轉錄因子的表達特征和作用機制各異,且具有物種特異性和多樣性[44]。研究表明,轉錄因子MYB3在藍莓、金柑花青素生物合成中起重要的負調控作用;NtMYB4a通過調節NtCHI、NtCHS、NtF3H等基因的表達水平正向調控煙草花青素的生物合成[45];MYB114的高表達量會導致梨、草莓與煙草花青素含量的升高[46-47]。本研究中,相比于對照蘿卜Ra9的綠色葉片,紅紫葉突變體mu17的RsMYB3基因表達量顯著下調,RsMYB4、RsMYB114基因表達量明顯上調,與上述研究報道結果一致。此外,蘿卜紫紅葉突變體RsbHLH155基因的表達量明顯高于Ra9的綠色葉片。有報道指出,在蘋果與擬南芥中,MdbHLH155通過上調花青素合成基因CHI、CHS、F3H等的表達水平,促進花青素的積累[48]。由此,推測RsMYB3、RsMYB4、RsMYB114、RsbHLH155等轉錄因子通過協同調控蘿卜花青素合成相關基因RsCHS、RsCHI、RsF3H等的表達水平升高,促使蘿卜紫紅葉色突變體花青素大量積累。
葉色突變體為新品種的培育提供了大量優良種質,特異的突變葉色也可作為標記性狀簡化雜交制種、良種繁育的過程[9-10]。目前,葉色突變體在水稻、玉米、大豆、番茄等作物育種方面進行了廣泛發掘與應用。但是,蘿卜的葉色遺傳資源挖掘甚少,對蘿卜葉色突變體的鑒定工作也幾乎沒有。本研究通過化學誘變獲得一個蘿卜的彩葉突變體mu17,并從生理水平與分子水平上初步探究了蘿卜彩葉突變體的葉色變化機理,為即將開展的突變基因精細定位與圖位克隆奠定了良好基礎,為改良和培育蘿卜新品種提供了理論依據。

