加速康復外科理念下結直腸癌圍術期營養藥物治療應用效果*
鄒家鈺,陳小玉,白,廖 娟
(重慶醫科大學附屬永川醫院,重慶402160)
營養不良為術后并發癥的獨立危險因素[1]。2017年,丹麥外科醫師KEHLET[2]首次提出加速康復外科(ERAS)理念,旨在通過多學科協作,結合循證醫學證據,采用最優化的臨床處理措施,減輕手術帶來的心理和生理雙重應激創傷,促進快速康復。本研究中探討了ERAS理念下營養藥物治療在結直腸癌圍術期的應用效果。現報道如下。
1 資料與方法
1.1 一般資料
納入標準:經術前腸鏡活檢及術后病理學檢查確診為結直腸癌,行腫瘤根治性切除術;年齡18~80歲;營養風險篩查(NRS)2002評分≥3分。本研究方案經醫院醫學倫理委員會批準,患者及其家屬均簽署知情同意書。
排除標準:合并有其他嚴重臟器疾病;腸內營養液不耐受;中途自愿退出本研究;心理或精神疾病。
病例選擇與分組:選取我院2016年10月至2018年5月實施結直腸癌根治術的患者37例作為對照組,2019年9月至2020年6月實施結直腸癌根治術的患者39例作為干預組。兩組患者一般資料比較,差異無統計學意義(P>0.05),具有可比性。詳見表1。
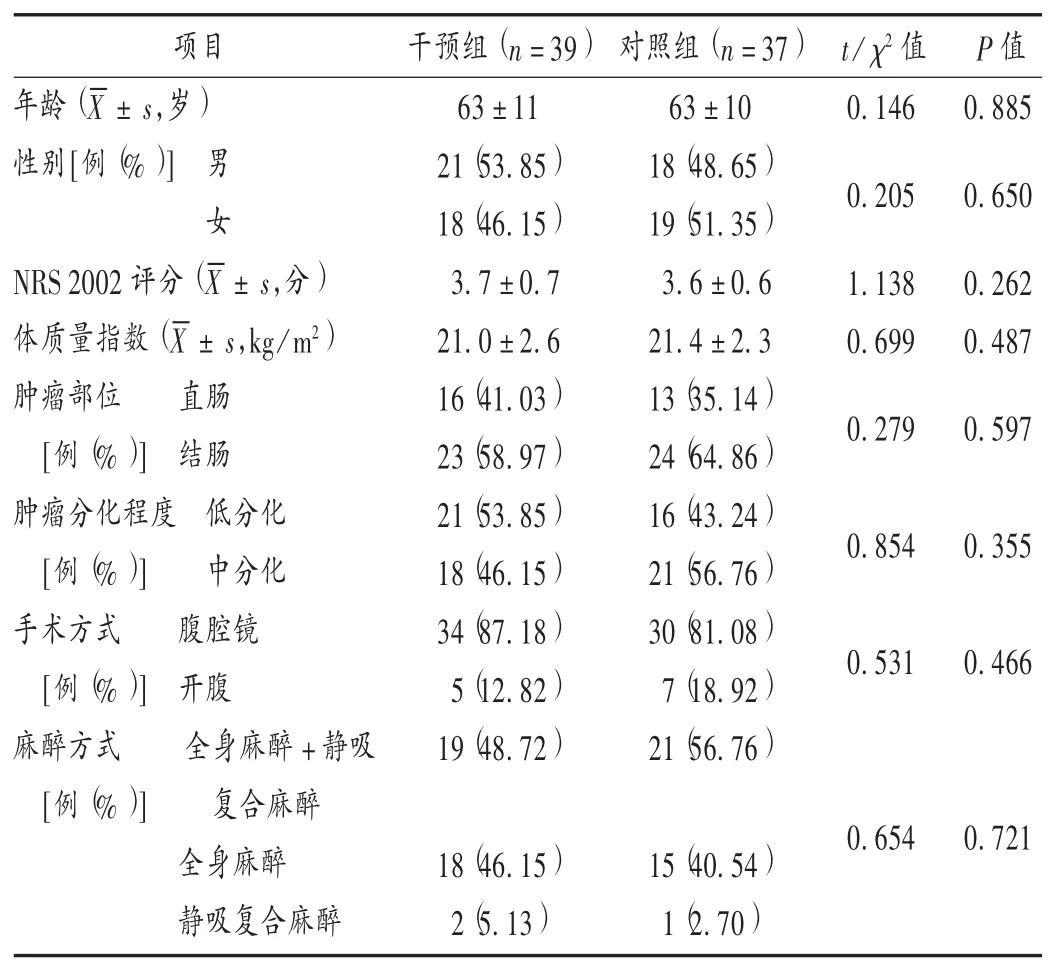
表1 兩組患者一般資料比較Tab.1 Comparison of the patients′general data between the two groups
1.2 方法
兩組患者在入院后24 h內均行營養風險評估,內容包括疾病程度、營養狀況及年齡評分。NRS 2002評分≥3分提示患者存在營養風險。干預組患者采用ERAS圍術期營養藥物治療。成立ERAS小組,制訂營養方案,于術前5 d在三餐間口服腸內營養粉劑(TP,商品名安素,整蛋白型,ABBOTT LABORATORATORIES B.V.,進口藥品注冊證號H20181147,規格為每瓶400 g),依照歐洲腸內腸外營養學會(ESPEN)推薦的腫瘤患者能量需求標準計算,NRS 2002≥3分即有營養風險的患者為30 kcal/(kg·d)(1 kcal=4.184 kJ),目標蛋白質為1.5~2.0 g/(kg·d)[3]。術前1 d下午囑患者口服聚乙二醇電解質散劑行腸道準備。術后6 h,少量進食糖鹽水,術后1 d若無明顯腸脹氣、出血等并發癥,可經口服或經營養管補充腸內營養混懸液(TPF-FOS,ABBOTT LABORATORIES B.V.,進口藥品注冊證號H20150255,規格為每瓶500 mL)250 mL,術后2 d補充500 mL,術后3 d起逐漸加量至目標需要量。根據營養支持五階梯原則,術后早期每日腸內營養支持不能滿足目標需要量的60%,則需腸外營養補充,予靜脈輸注脂肪乳氨基酸(17)葡萄糖(11%)注射液(商品名卡文,Fresenius Kabi AB,國藥準字J20130185,規格為每袋1 440 mL)以達到目標需要量。具體營養支持方案見表2。對照組患者采用傳統圍術期營養支持模式。術前,囑患者進食高蛋白、高能量、易消化食物,如蛋類、禽類、魚蝦類等,對存在嚴重營養不良患者予以腸外營養支持。術前1 d行腸道準備,術后靜脈輸注營養支持藥物(如氨基酸、脂肪乳、葡萄糖等)以滿足每日所需能量及電解質,肛門排氣后開始進食流食,少量多餐,逐步過渡到普通飲食。

表2 ERAS圍術期營養藥物治療方案Tab.2 Nutritional drug therapy scheme based on ERAS during the perioperative period
1.3 觀察指標
生化指標:術后1,3,7 d采集患者晨間空腹靜脈血,檢測其中總蛋白、清蛋白、前清蛋白及淋巴細胞總數。治療效果:記錄患者術后首次肛門排氣、首次排便、住院時間,住院總費用,感染性并發癥(傷口感染、肺部感染、腹腔感染等),吻合口瘺,腸梗阻,藥品不良反應(惡心、嘔吐、胃不適等)發生情況。
1.4 統計學處理
2 結果
結果見表3至表5。
表3 兩組患者術后生化指標比較(±s)Tab.3 Comparison of biochemical indexes between the two groups after surgery(±s)
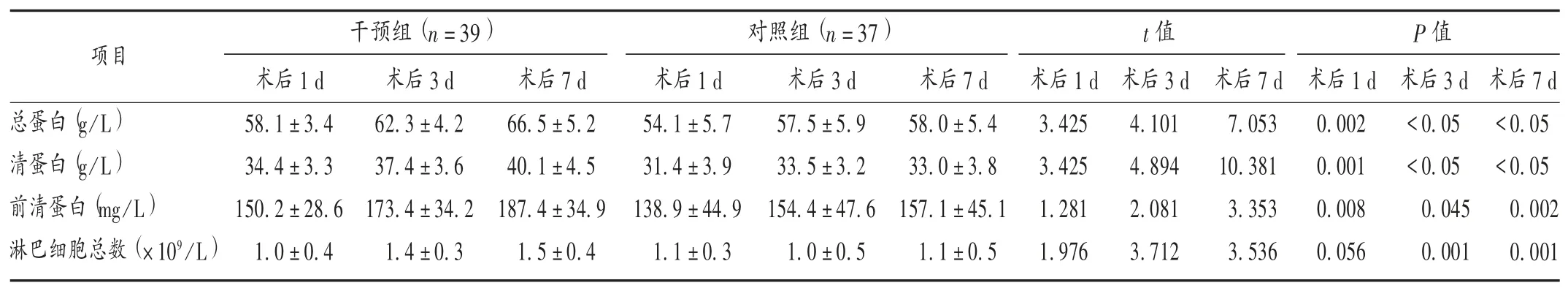
表3 兩組患者術后生化指標比較(±s)Tab.3 Comparison of biochemical indexes between the two groups after surgery(±s)
?
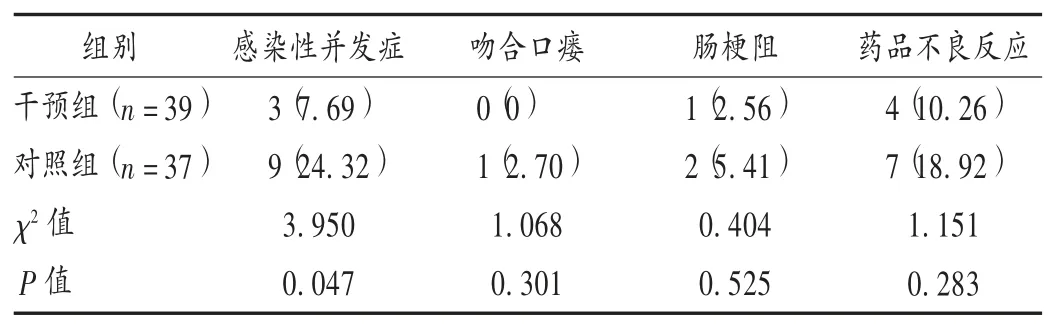
表5 兩組患者術后并發癥及藥品不良反應發生情況比較[例(%)]Tab.5 Comparison of postoperative complications and incidence of adverse drug reactions between the two groups[case(%)]
3 討論
由于腫瘤自身的消耗,消化功能紊亂引起食欲下降,導致營養攝入不足,39.5%的結直腸癌患者存在營養不良風險,且并發癥發生率達62.0%[4]。術前營養不良及術中的創傷、應激等均會損傷機體免疫功能,導致術后出現各種并發癥[5]。因此,及時、有效的營養支持有利于提高患者的營養水平。營養藥物治療作為一種新型治療手段,不僅能提供能量,還可改善免疫功能,參與調理糖代謝紊亂、腸道菌群失調和腸屏障功能障礙[6]。
表4 兩組患者治療效果比較(±s)Tab.4 Comparison of clinical efficacy between the two groups(±s)
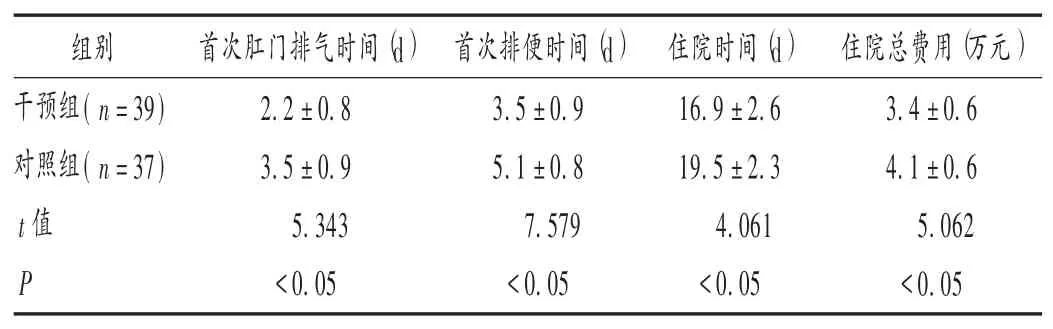
表4 兩組患者治療效果比較(±s)Tab.4 Comparison of clinical efficacy between the two groups(±s)
?
營養治療途徑包括營養教育、腸內營養、腸外營養,其中,腸內營養包括口服營養補充(ONS)和管飼營養;腸外營養包括補充性腸外營養(SPN)和全腸外營養(TPN)[7]。本研究中,干預組患者采用圍術期營養藥物支持治療,即在ERAS理念指導下,根據ESPEN推薦的腫瘤患者目標需要量制訂術前、術后的營養支持方案,通過術前口服安素腸內營養粉劑及術后早期經口或營養管補充TPF-FOS,較傳統的營養管理模式有明顯優勢。總蛋白、清蛋白和前清蛋白是反映機體營養水平的3個重要指標。干預組患者術后營養指標逐步上升,對照組從術后1 d至術后3 d有相對平緩的增長趨勢,術后7 d增長停滯且清蛋白出現緩慢下降。干預組患者術后第1,3,7天的總蛋白、清蛋白、前清蛋白水平均顯著高于對照組,提示術前根據患者的營養狀況進行有計劃的營養干預,能增加患者術中的營養儲備,且在術后早期進食腸內營養并予以腸外營養,可有效提高機體的營養狀況。FENG等[8]研究發現,當機體出現營養不良時,淋巴細胞總數會隨之下降,可將淋巴細胞總數作為測定機體免疫功能的一項指標。本研究中,干預組患者術后3,7 d的淋巴細胞總數均顯著高于對照組,提示術后早期腸內營養能有效改善腸道免疫功能,提高患者機體免疫力。
肛門排氣是胃腸開始蠕動及胃腸道功能恢復的標志[9]。術后早期口服腸內營養制劑,能有效促進胃腸蠕動及門靜脈循環,加速腸道功能恢復[10]。本研究中,干預組患者的住院時間顯著短于對照組,住院總費用顯著低于對照組,提示基于ERAS理念的營養支持有利于患者快速康復,縮短住院時間,減輕經濟負擔。
結直腸癌術后的常見并發癥有肺部感染、腹腔感染、切口感染、吻合口瘺及藥品不良反應(包括惡心、嘔吐、腹脹、腹瀉等)[11]。本研究中,干預組患者的感染性并發癥發生率顯著低于對照組,提示基于ERAS理念的圍術期營養支持提高了機體的營養狀況和免疫功能,調整了機體代謝應激反應,降低了感染風險。兩組患者藥品不良反應的發生率差異無統計學意義(P>0.05),提示結直腸癌患者在術后早期口服腸內營養液是相對安全的。但也有可能是樣本量不足所致,需作進一步的大樣本研究。
綜上所述,基于ERAS理念的圍術期營養藥物支持治療,能改善結直腸癌患者術后的營養水平,提高免疫力,降低感染性并發癥發生率,減輕經濟負擔,促進康復。

