經皮腎通道順行輸尿管軟鏡技術處理回腸輸出道術后輸尿管回腸吻合處狹窄的臨床應用
崔 磊,郭小林,王少剛,楊 歡,李 聰,張加橋
(華中科技大學同濟醫學院附屬同濟醫院泌尿外科,湖北武漢 430030)
膀胱根治性切除術結合回腸輸出道術(Bricker術)是目前治療肌層浸潤性膀胱癌的最常用術式[1],而輸尿管狹窄梗阻是Bricker術后并發癥之一,發生率約為4%~8%[2],常見于輸尿管回腸吻合處,其治療方法主要包括開放手術和腔內手術。盡管開放手術效果更為確切,但由于此類患者以高齡者居多,且已經接受過膀胱根治性切除手術,再次手術的風險及難度均較高,患者的依從性也很差[3];腔內手術主要有經造口逆行途徑和經皮腎穿刺順行途徑2種,逆行途徑為常規入路[4],由于尿流改道后腸黏膜、腸皺襞的影響,經回腸輸出道內逆行尋找輸尿管口的難度大幅增加,手術成功率較低[5]。我們采用經皮腎通道順行輸尿管軟鏡聯合輸尿管硬鏡的手術方式,配合多種手段處理Bricker術后輸尿管回腸吻合處狹窄,取得了較好的療效并總結出一定經驗,現報道如下。
1 資料與方法
1.1 臨床資料回顧2017年1月至2019年12月同濟醫院泌尿外科收治的Bricker術后發生輸尿管回腸吻合處狹窄梗阻的患者16例,左側10例,右側4例,雙側狹窄2例,共計18側手術。其中男性11例,女性5例,年齡61~79歲,平均(68.1±5.2)歲。所有患者發現輸尿管回腸吻合處狹窄梗阻的時間在Bricker術后20~32個月之間,其中9例患者為常規術后復查時發現,7例患者因存在明顯患側腰痛的癥狀而發現。所有患者中11例患者出現腎功能不全,其肌酐平均值為(253.6±85.3)μmol/L。患者于術前結合B超、靜脈尿路造影(intravenous pyelography,IVP)、泌尿系計算機斷層掃描(computed tomography,CT)平掃三維重建、泌尿系CT增強(CT urography,CTU)、磁共振尿路成像(magnetic resonance urography,MRU)等多種檢查明確患側腎積水情況及狹窄梗阻部位,并排除相關手術禁忌證。
1.2 手術方法全身麻醉成功后取健側斜臥位,盡可能架空暴露患側腰部;結合術前影像資料在B超下觀察患側腎臟皮髄質、腎上下極、積水腎盞及腎周臟器,采用SVOF原則穿刺法建立經皮腎鏡工作通道,SVOF原則圖解見圖1。盡量選擇腎后組中、上盞,超聲實時引導下經11肋間或12肋下經腎周/腎臟2步法對目標腎盞穹窿部最高點行垂直穿刺,逐級擴張通道至F18,輸尿管硬鏡進入經皮腎通道內,尋找到輸尿管上段,留置親水導絲,循導絲置入輸尿管軟鏡輸送鞘,利用輸尿管軟鏡進入腎盂,沿順行途徑在輸尿管內向下探查,尋找狹窄梗阻部位。根據狹窄部位情況,選擇適當擴張方式,包括鈥激光切開(200 μm,0.8~1.0 J/15~20 Hz)、球囊擴張(Bard,美國)、軟鏡輸送鞘序貫擴張(F12/14,Cook,美國)。擴張完成后,將親水導絲順行置入回腸輸出道內,由助手在輸尿管硬鏡經回腸輸出道內直視下將導絲拉出造口并固定,順行或逆行置入F6輸尿管支架。輸尿管軟鏡采用OLYMPUS URF-V型號,術后常規留置腎造瘺管。

A:短距原則,穿刺針經過腎實質路徑最短;B:高點原則,穿刺點選擇相對位置最高的腎盞;C:鈍角原則,穿刺方向與腎盞開口方向呈鈍角;D:穹隆原則,腎盞穹隆頂部進針,進針方向與腎盞穹窿垂直。
1.3 術后隨訪所有患者術后3~5 d拔除腎造瘺管,術后3 d復查腹部平片及泌尿系CT以檢查輸尿管支架管位置及腎積水情況,術后7 d復查血肌酐以檢查腎功能恢復情況。術后2~3個月后經回腸輸出道造口拔除輸尿管支架管,每3個月復查1次,隨訪12個月。以患者癥狀明顯減輕、患側腎積水減輕或無明顯加重、血肌酐明顯下降并保持穩定為治療有效的判定標準。
2 結 果
2.1 手術結果18側手術中(16例患者,其中2例為雙側手術),17側順利完成,1側因輸尿管迂曲角度過大,反復多次嘗試仍無法經腔內通過狹窄段而未能完成手術,后擇期改行開放手術,手術完成率為94.4%。17側手術完成病例中,2側以鈥激光切開狹窄段,3側通過球囊擴張治療,12側采用輸尿管軟鏡輸送鞘序貫擴張吻合口狹窄處。手術時間為35~130 min,平均(53.7±16.5)min。
2.2 術后復查情況17側手術完成病例中,患者腰痛癥狀于術后均得到有效緩解。術后3 d復查腹部平片及泌尿系CT,輸尿管支架管位置良好,患側腎積水均有不同程度緩解。術前11例腎功能不全患者于術后7 d再次復查血肌酐,其平均值為(133.7±21.5)μmol/L,較術前有明顯改善。
2.3 術后并發癥完成手術病例中,無患者出現諸如鄰近臟器損傷、感染性休克、失血性休克、腎集合系統穿孔和撕裂傷、輸尿管撕脫斷裂、死亡等嚴重并發癥發生。術后有3例患者出現發熱,經抗生素合理治療后好轉;9例患者術后出現短暫持續性血尿,但血尿程度較輕,經對癥處理后均好轉。
2.4 術后隨訪結果17側手術完成病例均在術后2~3個月內拔除輸尿管支架管。術后隨訪12個月,13側在隨訪期內患側腎積水無明顯加重,腎功能持續穩定。4側術后出現狹窄復發,主要表現為患側腎積水再次加重,復發時間在術后4~6個月。復發患者均擇期行開放手術治療,治療成功率為76.5%。圖2顯示為其中1例患者術前、術后3個月及術后12個月影像學資料對比,效果顯著。
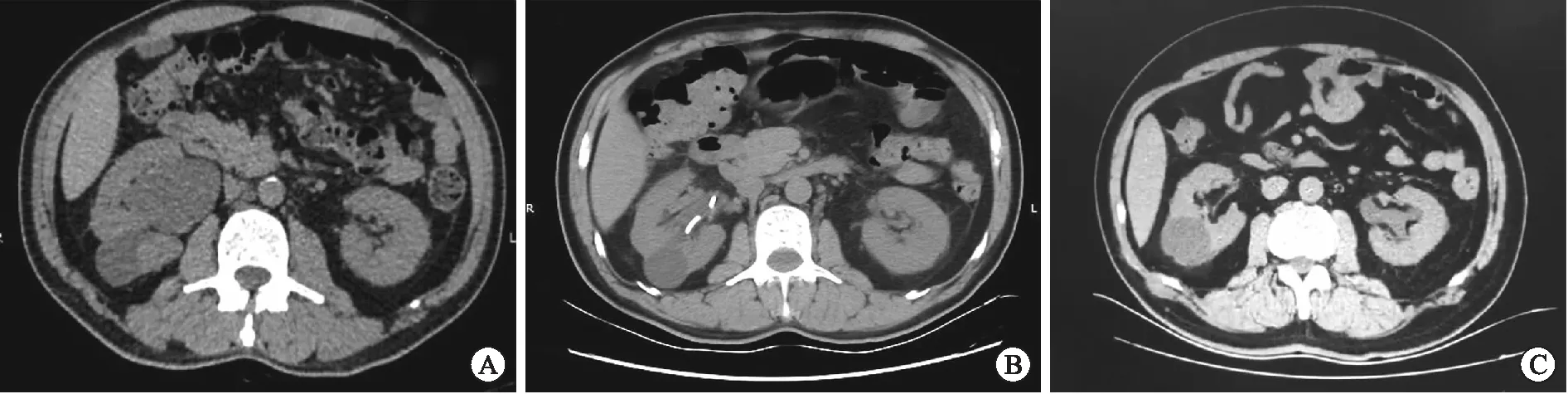
A:患者術前影像,顯示右腎積水;B:患者術后3個月復查影像,右腎積水明顯緩解,右側輸尿管支架管尚未拔除;C:患者術后12個月復查影像,輸尿管支架管已拔除,腎積水未見明顯復發。
3 討 論
膀胱根治性切除術是目前治療肌層浸潤性膀胱癌最常用、最有效的手術方式,而與其相結合的尿流改道術后也有多種選擇,無論是回腸輸出道、結腸輸出道、亦或是輸尿管皮膚造口,都是被認可采用且行之有效的術式選擇[6]。而尿流改道術的復雜程度與圍手術期并發癥具有相關性,研究報道顯示不同術式的并發癥發生率在30%~50%不等[2]。Bricker術具備較好的手術適應證、患者耐受較好、手術操作性較強等特點,目前仍是與膀胱根治性切除術聯合進行的最常用的尿流改道術式之一。由于Bricker術需要將輸尿管與游離的回腸段做吻合,因此術后輸尿管狹窄梗阻是該術式的并發癥之一,而梗阻發生部位常見于輸尿管回腸吻合處,研究報道其發生率約為4%~8%,且該并發癥是接受膀胱根治性切除術的患者術后出現腎功能減退、上尿路梗阻積水的重要危險因素[7]。Bricker術后輸尿管回腸吻合處狹窄的典型臨床表現是嚴重的患側腰痛和反復的尿路感染,但有證據顯示輸尿管回腸吻合處狹窄的患者在前期也可表現為無明顯臨床癥狀,直至出現嚴重的腎功能不全[8]。本組病例中,有9例患者(9/16)是在常規術后復查隨訪時發現的,并無明顯臨床癥狀。Bricker術后出現輸尿管回腸吻合處狹窄的主要原因是尿流改道術中輸尿管周圍的微循環受到不同程度的破壞,持續的缺血狀態導致了輸尿管黏膜及周圍組織的纖維化改變,結締組織瘢痕收縮、粘連、擠壓最終導致狹窄梗阻[9]。另外,一些醫源性的原因如吻合方法不當、輸尿管醫源性損傷,也可導致術后輸尿管回腸吻合處狹窄的發生,而結石梗阻、局部腫瘤復發則是繼發性輸尿管回腸吻合處狹窄的常見原因[10]。
由于接受Bricker術的患者大多為肌層浸潤性膀胱癌患者,因切除范圍擴大、盆腔淋巴結清掃、綜合治療等原因都會在術后出現不同程度的腹腔、腹膜,甚至腸道的粘連,再次行腹腔探查手術的難度大幅增加[11]。有研究報道,腔內手術治療Bricker術后輸尿管回腸吻合處狹窄的成功率在10%~40%,而開放手術的成功率則達到了40%~90%[12]。盡管兩者在手術效果上有明顯的差異,但腔內手術在治療Bricker術后輸尿管回腸吻合處狹窄時,其患者整體耐受和依從性較好、手術難度相對較低、經自然腔道入路不受腹腔粘連的影響、手術風險較低。
Bricker術后患者的尿流輸出道由回腸替代,其內部腸黏膜、腸絨毛、腸皺襞會對逆行途徑的內鏡視野造成嚴重影響,因此采用腔內手術治療Bricker術后輸尿管回腸吻合處狹窄時,經造口逆行途徑在尋找輸尿管吻合口時難度極大,這也是造成腔內手術治療Bricker術后輸尿管回腸吻合處狹窄成功率較低的原因之一[13]。經皮腎穿刺順行途徑則可以避免回腸輸出道內腸黏膜對內鏡探查視野的影響,結合輸尿管軟鏡可增加順行途徑探查上尿路的適用范圍,其主要難點在于術中患側經皮腎穿刺的技巧以及狹窄治療方式的選擇上。通過分析本組病例,我們總結出具有廣泛性的經驗,以適用于經皮腎通道順行輸尿管軟鏡聯合輸尿管硬鏡在Bricker術后輸尿管回腸吻合處狹窄的治療。其適應證主要包括:①Bricker術后輸尿管回腸吻合處狹窄的初發患者;②患者高齡、開放手術風險較高,或患者自身暫不接受開放手術;③Bricker術后接受過腫瘤相關綜合治療,考慮腹腔粘連嚴重。而輸尿管回腸吻合處狹窄多次復發、合并泌尿系感染未得到有效控制、術前檢查考慮腫瘤復發導致狹窄等情況則應列為其行腔內治療的禁忌證。
在經皮腎穿刺操作方面,傳統方式為患者在俯臥位下經B超引導下穿刺,而斜仰臥位下穿刺與傳統俯臥位下穿刺相比,操作需要更細致。在本組病例中,我們借鑒復雜性腎結石行經皮腎鏡碎石術時的穿刺技巧,在斜仰臥位下依然可采用短距(short)、高點(vertex)、鈍角(obtuse)、穹窿(fornix)4個方面相結合的SVOF原則來完成經皮腎穿刺[14]。
在輸尿管狹窄腔內治療方式的選擇上,本組病例中,有2例以鈥激光切開狹窄段,3例通過球囊擴張治療,12例采用輸尿管軟鏡輸送鞘序貫擴張狹窄處。有研究顯示采用球囊擴張治療輸尿管狹窄的有效率在15%~30%,而采用序貫擴張并于術后留置輸尿管支架的方法其有效率在40%左右[15]。不同的治療方式其效果雖各有差異,但與患者輸尿管狹窄程度、狹窄段長度以及患者自身因素等也有著密切關系[16]。
在并發癥方面,采用SVOF原則進行經皮腎穿刺可顯著提高斜仰臥位下穿刺成功率、減少出血,同時以高點和鈍角原則選擇穿刺點和穿刺方向,避免因穿刺通道與輸尿管角度過大而增加手術難度;而經皮腎通道的存在,使軟鏡術中的腎內灌注回流增加,降低腎盂內壓力,在保證視野清晰的同時,降低腎內高壓導致逆行感染的風險。本組病例中,術后有3例患者出現發熱,經抗生素合理治療后好轉;9例患者術后出現短暫持續性血尿,但血尿程度較輕,經對癥處理后均好轉。
綜上所述,經皮腎通道順行輸尿管軟鏡聯合輸尿管硬鏡治療Bricker術后輸尿管回腸吻合處狹窄,通過腔內手術的方式解決肌層浸潤性膀胱癌患者接受膀胱根治性切除術、尿流改道術后的并發癥,具有較好的臨床應用價值。盡管腔內手術治療輸尿管狹窄的遠期效果不如開放手術,而且針對難治性、復發性輸尿管狹窄仍然建議選擇開放手術治療,但腔內手術用于高齡患者時風險較低、患者耐受較好,可以延緩或降低需要行開放手術的可能性[17]。

