1株鴨坦布蘇病毒的分離鑒定及產蛋鴨發病模型的建立
姚 蓉 康 超 鄒 忠 徐巧霞 孫小美 孫小云 金梅林,
1.武漢科前生物股份有限公司,武漢430070;2.華中農業大學動物醫學院,武漢430070
鴨坦布蘇病毒病是由鴨坦布蘇病毒(duck tem?busu virus,DTMUV)感染鴨引起的,是2010年以來在我國主要蛋鴨養殖區陸續暴發的一種急性傳染病,以蛋鴨、種鴨產蛋驟然下降為主要臨床特征,以出血性卵巢炎為主要病變特征[1]。商品肉鴨和育成期的種鴨可在20日齡前發病,表現為神經癥狀,腿腳麻痹、站立不穩,病鴨大多數因飲水、采食困難衰竭死亡,若發生細菌繼發感染則死淘率會增加[2]。鴨坦布蘇病毒病的暴發流行給我國養鴨業造成了重大經濟損失,嚴重危害了我國養鴨業的健康發展[3-5]。加強對DTMUV的分離鑒定及發病模型的建立,不僅能對該病進行監測及防控,也能為鴨坦布蘇病毒病疫苗的研制和疫苗的效力檢驗提供實驗依據[6-7]。
本研究室采集了湖北某鴨場蛋鴨的卵巢病變組織,組織經研磨處理后,經RT-PCR 鑒定,結果為鴨坦布蘇病毒陽性。將組織處理液在SPF雞胚上連續傳代,成功分離鑒定出1 株DTMUV,命名為DT?MUV-DF2 株。通過將DTMUV-DF2 株感染成年鴨建立動物感染模型,結果病毒感染1~3 d,有感染鴨血清中病毒分離率均為100%;病毒感染后卵泡出現變形、破裂或出血等變化,感染后5~10 d 卵巢病變率較高,8~10 d 病變率均為100%。對以上統計數據進行分析,最終確定了該病毒對產蛋鴨的發病模型。
1 材料與方法
1.1 雞胚與試驗動物
6日齡SPF 雞胚和8~10日齡SPF 雞胚均購自北京梅里亞維通實驗動物技術有限公司。
25~40周齡鴨坦布病毒抗體陰性健康易感麻鴨購自湖北隆興湖蛋鴨養殖股份有限公司。
1.2 主要試劑
病毒基因組提取試劑盒購自北京全式金生物科技有限公司;AMV 反轉錄酶、RNase Inhibitor 和DNA Marker DL-2000 均購自寶生物工程(大連)有限公司;dNTP Mixture 購自羅氏公司;TransTaq -T DNA Polymerase 購自全式金生物;青鏈霉素混合液(100×)購自吉諾生物醫藥技術有限公司;GenClean柱式瓊脂糖凝膠DNA 回收試劑盒及質粒提取試劑盒均購自上海生工生物技術有限公司。鴨坦布蘇病毒的鑒定引物序列為NS5-F:5′-GGGGAGGTG?GTTTGGTTAG-3′;NS5-R:5′-GTTCTGGGGCTTTG?GTATC-3′,擴增片段大小為498bp[8-9]。
1.3 樣品的采集和處理
無菌采集病死鴨病變卵巢,剪碎勻漿后按1∶4(v/v)的比例加入滅菌磷酸鹽緩沖液(PBS),反復凍融3 次后,12 000 r/min 離心5 min,取上清加入青鏈霉素,使終濃度均為10 000 單位/mL,4 ℃作用2 h。用0.22μm的濾器過濾除菌,濾過液置-70 ℃以下保存備用[10]。
1.4 樣品的RT-PCR鑒定
取經處理的病料濾過液300μL 至1.5 mL EP 管中,參照病毒基因組提取試劑盒提取病毒RNA,最后用20 μL DEPC 水溶解。反轉錄按AMV Reverse Transcriptase說明書進行。PCR反應體系cDNA 2μL,10×Trans Buffer 2.5 μL,TransTaq DNA Polymerase 0.5μL,上、下游引物各1μL,補H2O 至25μL。PCR反應程序為95 ℃變性5 min 后進行94 ℃變性30 s,54 ℃退火30 s,72 ℃延伸50 s 的30 個循環;最后72 ℃延伸10 min,保存于4 ℃。PCR 產物用0.8%瓊脂糖凝膠電泳檢測,若擴增出498 bp 片段大小則說明RT-PCR擴增結果為陽性[10]。
1.5 病毒分離
將RT-PCR檢測為陽性的病料懸液經尿囊腔接種5 枚8日齡SPF 雞胚,0.2 mL/胚,每日觀察,棄去24 h 內死亡胚,24~96 h 死亡雞胚隨時收獲,96 h 后將未死亡雞胚置4 ℃,且于12 h后收集雞胚尿囊液。對收獲的雞胚尿囊液進行RT-PCR 擴增,若為陽性則置-70 ℃以下保存備用,若為陰性則進行盲傳,盲傳7代后仍為陰性者棄去。
1.6 病毒含量測定(雞胚半數致死量ELD50)
將病毒懸液用滅菌生理鹽水作10倍系列稀釋,取10-3、10-4、10-5、10-64個稀釋度,每個稀釋度經卵黃囊接種6日齡SPF雞胚各5枚,每胚0.1 mL,置濕度60%~65%、溫度37 ℃繼續孵育。逐日照胚并記錄結果,24 h內死亡雞胚不計,統計24 h后死胚數量,一般需要觀察5 d;結果的計算按Reed-Muench法進行計算[11]。
1.7 動物發病模型的研究
1)病毒血癥的研究。將25~40周齡成年蛋鴨隨機分成10組,10只/組,每只鴨經腿部肌肉接種鴨坦布蘇病毒(DF2株)雞胚毒,每只0.5 mL(病毒含量為105ELD50)。攻毒后第1~10日,每日隨機選取一組,經翅靜脈采血后分離血清,每份血清卵黃囊接種5枚6日齡SPF雞胚,每胚0.1 mL。接種后置37 ℃溫箱繼續孵化,24 h內死亡雞胚棄去,統計24~120 h雞胚死亡情況,5枚雞胚至少有4 枚雞胚死亡,則判定這份血清病毒分離為陽性[12-13]。
2)卵泡病理變化。每日對采血后的鴨進行剖殺,觀察并記錄卵泡是否有破裂、出血、變形或壞死等病理變化。統計每日卵泡病變比例,摸索鴨坦布蘇病毒引起的卵泡病變規律。結合病毒分離情況及卵巢病變情況,分析卵巢的病變特征,依據病毒分離及卵泡病變情況確定發病判定標準[14]。
2 結果與分析
2.1 病毒分離及鑒定結果
對采集的樣品進行RT-PCR 擴增,擴增產物經瓊脂糖凝膠電泳,結果顯示,從3份樣品中擴增出了特異性片段,大小為498 bp,與預期結果相符(圖1)。將RT-PCR 檢測為陽性的病料懸液經尿囊腔接種5枚8日齡SPF 雞胚,對收獲的雞胚尿囊液進行RTPCR 擴增,結果在盲傳3 代后RT-PCR 擴增為陽性,記為F1代。在雞胚上連續傳代至F5代,RT-PCR擴增均為陽性(圖2),將獲得的病毒液命名為DF2 株(登錄號為KJ489355.1)。
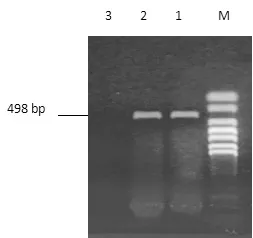
圖1 病料RT-PCR擴增結果

圖2 分離株RT-PCR擴增結果
2.2 病毒在雞胚上的傳代與含量測定
將獲得的DF2 株病毒液在SPF 雞胚上連續傳代,一直到第10 代,結果每一代病毒液的RT-PCR均為陽性,測定各代次病毒液的病毒含量ELD50,結果DF2 株病毒在傳到第5 代時病毒滴度上升到104.5ELD50/mL,在第10 代達到105.0ELD50/mL,說明DF2株在雞胚上的增殖能力較強(表1)。

表1 DF2分離株在SPF雞胚上的增殖滴度(ELD50/mL)
2.3 動物發病模型結果
1)病毒分離。鴨只經病毒感染后前3 d病毒分離陽性率均為100%,從第4天開始病毒分離陽性率開始下降,自第6 天開始,血清病毒分離均轉為陰性(表2)。

表2 感染鴨病毒分離情況
2)卵泡病變情況。鴨只經病毒感染后,每日對已采血的鴨只進行剖殺,結果,有13只鴨無大的卵泡,卵泡直徑均<1 cm,說明卵泡發育處于靜止期,無法判斷病毒感染對卵泡發育的影響,所以卵巢檢查應剔除卵泡發育處于靜止期的鴨[14]。其余87 只鴨卵泡處于生長期,病毒感染后第2日卵泡開始出現破裂、變形、出血或壞死,第5~10 天卵泡病變率較高。對第5~10 天的卵泡病變類型進行統計,結果25.5%(14/55)卵泡破裂、96.4%(53/55)卵泡變形、38.2%(21/55)卵泡壞死(圖3)。詳細結果見表3。
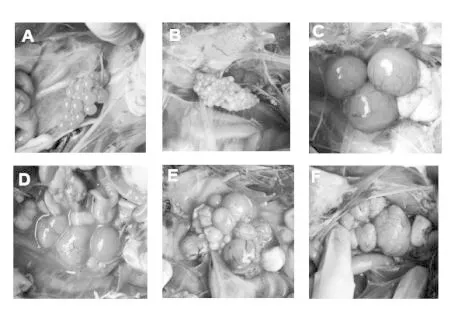
圖3 卵泡病變情況

表3 卵泡病變統計情況
3)發病判定標準的確定。由于產蛋母鴨卵巢發育存在個體差異(卵泡大小、卵泡數量),我們在制定發病判定標準時對這些情況進行了區分,以便于更客觀的評價感染情況。①存在個別母鴨產蛋暫時處于靜止期的生理狀態,此時的卵泡直徑均小于1 cm,卵泡病變情況不易判斷,所以我們在制定卵巢的病變情況時設定了卵泡直徑大于1 cm 的判定條件。②當母鴨產蛋旺盛時卵泡數量過多,在試驗操作過程中會引起個別卵泡非特異性出血,為了更客觀地判定攻毒鴨的發病情況,我們在制定發病判定標準時對此種情況規定為當卵泡數>3 時,變性和壞死卵泡數≥3 判為卵巢病變。③當母鴨卵泡數偏少時無相應的因擠壓等引起的卵泡非特異性出血,我們在制定發病判定標準時對此種情況規定為當卵泡數≤3 時,變性和壞死卵泡數≥1 判為卵巢病變[14]。
綜合以上卵泡病變情況以及病毒血癥規律,我們確定了鴨坦布蘇病毒感染鴨的發病判定標準如下,攻毒后第3日采血分離血清,每份血清卵黃囊接種5枚6日齡SPF 雞胚,0.1 mL/枚,置37 ℃培養箱培養,持續觀察5 d,24 h內死亡雞胚不計,如接種雞胚中有4 枚及以上死亡,則判為病毒分離陽性。病變卵巢的判定:卵泡數>3 個時,變形、出血或壞死卵泡數>2 個,卵泡數≤3 個時,有變形、出血或壞死卵泡。卵巢發育成熟期的鴨,病毒分離和卵巢病變均為陽性則判發病。
3 討 論
2010年以來我國大部分種鴨和蛋鴨養殖地區相繼發生了以減料、產蛋下降和伴有一定死淘率為特征的傳染病,該病發病急,傳播快,死淘率高[15]。該病能引起蛋鴨產蛋率驟降、肉鴨發育遲緩甚至死亡,給我國養鴨業造成了巨大的經濟損失。自該病暴發以來,迅速蔓延至我國大部分鴨養殖地區以及臨近的東南亞地區。DTMUV 宿主范圍廣泛,除了感染鴨、鵝等水禽和雞、麻雀等其他禽類外,也可以感染哺乳動物,具有潛在的公共衛生安全風險[16]。
在本研究中,本研究室從疑似感染鴨坦布蘇病毒的病鴨組織中分離到1 株鴨坦布蘇病毒,在SPF雞胚上增殖穩定后,對產蛋麻鴨進行了攻毒試驗,摸索鴨坦布蘇病毒病的發病情況。在此基礎之上,我們建立了一種鴨坦布蘇病毒病在產蛋鴨上的動物模型,并確定了其發病判定標準,這不僅能在鴨坦布蘇病毒病疫苗的研制過程中提供疫苗的效力檢驗評判標準,也為該病的臨床診斷提供了依據,能有效監測和防控鴨坦布蘇病毒病的流行和蔓延[17]。

