NLRP3炎性體在膽總管結(jié)扎誘導的肝纖維化大鼠模型中的表達特點
周蒙恩, 陳懿榕, 張 娜, 晏 旎, 闕任燁, 李 勇
上海中醫(yī)藥大學附屬市中醫(yī)醫(yī)院 脾胃病科, 上海 200071
肝纖維化是指細胞外基質(zhì)過多沉積,破壞肝臟的生理結(jié)構(gòu),是各種慢性肝病(如慢性病毒性肝炎、酒精性肝病、非酒精性脂肪性肝病等)的共同結(jié)果[1]。晚期肝纖維化可能進展為不可逆轉(zhuǎn)的肝硬化,肝硬化可引起腹水、脾腫大、側(cè)支循環(huán)形成、上消化道出血,甚至導致死亡[2]。NLRP3炎性體是機體固有免疫系統(tǒng)的重要組成部分,參與多種炎性疾病的發(fā)生發(fā)展。研究發(fā)現(xiàn),在丙型肝炎、非酒精性脂肪性肝炎、酒精性肝炎、肝纖維化、肝臟缺血/再灌注損傷等急慢性肝臟疾病發(fā)生發(fā)展過程中都存在著NLRP3炎性體的活化[3-7],而在膽管結(jié)扎大鼠中尚未報道。本實驗通過膽總管結(jié)扎(bile duct ligation, BDL)造成大鼠膽汁淤積性肝纖維化模型,觀察肝纖維化過程中NLRP3炎性體的表達情況。
1 材料與方法
1.1 實驗動物 清潔級雄性SD成年大鼠,65只,體質(zhì)量180~220 g,購自上海斯萊克實驗動物有限責任公司,動物生產(chǎn)許可證編號:SCXK(滬)2012-0002,實驗動物使用許可證編號:SYXK(滬)2020-0014,自由進食飲水,恒溫 (25±2)℃,恒濕,12 h/d,明暗交替。
1.2 試劑和儀器 NLRP3抗體(Cell Signaling Technology,美國),ASC抗體、caspase1抗體(Novus Biologicals, 美國),β-actin抗體(上海碧云天生物技術(shù)有限公司),IL-1β ELISA 檢測試劑盒(Thermo Fisher Scientific, 美國),TGFβ1、α平滑肌肌動蛋白(αSMA)免疫組化試劑盒(北京中杉金橋生物科技有限公司),蘇木素-伊紅染色液(湖南艾佳生物科技股份有限公司),Masson染色液(北京索萊寶科技有限公司),天狼星紅染色液(北京雷根生物技術(shù)有限公司),RT-PCR引物(上海生工生物工程有限公司)。天能EPS300電泳儀(上海天能科技有限公司),RM2016切片機(萊卡公司),多功能酶標儀(Thermo, 美國),Nanodrop2000(Thermo, 美國),S1000 PCR儀(BIO-RAD,美國)。
1.3 實驗方法
1.3.1 分組及模型建立 將65只SD大鼠隨機分為假手術(shù)組和模型組,假手術(shù)組15只,模型組50只,模型組行BDL,假手術(shù)組僅開腹并游離膽總管后關(guān)腹。造模方法參照文獻[8]進行,分別于第3、7、14、21、28天,處死10只模型組,同時處死3只假手術(shù)組。動物處死后取血清、肝組織標本備用。肝組織標本保存于-80 ℃中,部分標本用中性福爾馬林固定12 h后經(jīng)石蠟包埋,3~5 μm厚連續(xù)切片備檢。
1.3.2 肝功能指標 用全自動生化分析儀檢測血清AST、ALT、ALP、DBil、TBA、TBil水平。
1.3.3 肝臟病理組織檢查 病理組織學采用HE染色、Masson染色、天狼星紅-苦味酸染色3種染色方法,取備檢石蠟切片經(jīng)脫蠟、水化、染色、分化、透明、封片、鏡檢,分別觀察病變與纖維化程度。肝纖維化評分標準參照《肝纖維化診斷及治療共識(2019年)》[9]。
1.3.4 免疫組化檢測αSMA及TGFβ1表達 石蠟切片經(jīng)脫蠟、水化,抗原修復(fù)冷卻后,3% H2O2阻斷內(nèi)源性過氧化物酶的活性, 血清封閉,孵育一抗、孵育二抗,DAB顯色,蘇木素復(fù)染、脫水、透明后封片、鏡檢,用Image-Pro Plus 6.0 軟件對肝組織陽性表達面積進行半定量分析。
1.3.5 Western Blot檢測NLRP3炎性體表達
取大鼠肝臟組織裂解后,提蛋白,以SDS-PAGE凝膠(5%濃縮膠,12%分離膠)進行電泳分離膠分離蛋白,并通過半干轉(zhuǎn)法轉(zhuǎn)移至PVDF膜,PVDF膜經(jīng)5%的脫脂奶粉搖床上慢搖2 h封閉,分別與NLRP3抗體、ASC抗體、caspase1抗體4 ℃過夜,室溫孵育二抗2 h,ECL光化學顯色。最后應(yīng)用Image J分析軟件對掃描條帶進行定量分析,計算各蛋白相對表達量。
1.3.6 RT-PCR檢測NLRP3、ASC、caspase1炎性體表達
取大鼠肝臟組織加入Trizol研磨離心取上清,提取總RNA,Nanodrop2000檢測RNA的純度和濃度,各組取2 μl總RNA,按20 μl總反應(yīng)體積,反轉(zhuǎn)錄為cDNA,然后以cDNA為模板分別進行PCR擴增。NLRP3上游引物 5′- GCTGCGATCAACAGGCGAGAC-3′,下游引物5′- AAGGCTGTCCTCCTGGCATACC-3′;ASC上游引物5′-ACAATGACTGTGCTTAGAGACA-3′,下游引物5′-CACAGCTCCAGACTCTTCTTTA-3′;caspase1上游引物5′-AGAGGATTTCTTAACGGATGCA-3′,下游引物5′-TCACAAGACCAGGCATATTCTT-3′;β-actin上游引物5′-CGTTGACATCCGTAAAGACC-3′,下游引物5′-AACAGTCCGCCTAGAAGCAC-3′。采用三步法進行PCR擴增,反應(yīng)結(jié)束后,得到各樣本 CT值,然后利用2-△△Ct計算各組基因的相對表達量。
1.3.7 ELISA檢測IL-1β水平 取肝組織,置于含RIPA裂解液的離心管中裂解蛋白,4 ℃條件下離心,取上清液。按 ELISA 試劑盒說明書操作步驟檢測各組肝組織IL-1β水平。
1.4 倫理學審查 本研究方案經(jīng)由上海市中醫(yī)醫(yī)院醫(yī)學倫理委員會審批,批號: SZY2017018,符合實驗室動物管理與使用準則。
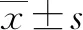
2 結(jié)果
2.1 BDL大鼠血清肝功能檢測 BDL模型組大鼠自BDL術(shù)后血清肝功能各檢測指標顯著提高,并于第3天達最大值(P值均<0.05);第7~28天各指標較3天組下降,但與假手術(shù)組相比仍有升高(P值均<0.05)(表1)。
2.2 大鼠肝臟組織HE染色 假手術(shù)組無炎癥細胞浸潤,肝細胞多,肝小葉結(jié)構(gòu)完整;第3天和第7天BDL組可見匯管區(qū)少量炎細胞浸潤,肝小葉間膽管增生,中央靜脈與肝血竇輕度擴張淤血;第14天起可見匯管區(qū)纖維組織增生,肝小葉間膽管明顯增生,部分分割包繞肝小葉使其結(jié)構(gòu)紊亂,第28天肝小葉結(jié)構(gòu)嚴重破壞,被沉積的膠原分割成大量假小葉(圖1)。

注:a,假手術(shù)組;b,BDL 3 d;c,BDL 7 d;d,BDL 14 d;e,BDL 21 d;f,BDL 28 d。
2.3 大鼠肝臟組織Masson染色 假手術(shù)組肝組織、肝小葉結(jié)構(gòu)清晰,肝細胞索呈放射狀排列;膽總管結(jié)扎3 d后可見少量膠原纖維在匯管區(qū)和中央靜脈分布;第7天匯管區(qū)、肝竇擴大,纖維組織增生,沿匯管區(qū)、中央靜脈向外延伸;第14天匯管區(qū)、肝竇區(qū)、中央靜脈纖維組織增生,面積較前擴大;第21天大鼠肝組織膠原纖維帶明顯;第28天可見肝細胞脂肪樣變,小葉結(jié)構(gòu)紊亂,纖維條索更加粗大明顯,部分互相連接(圖2)。
注:a,假手術(shù)組;b,BDL 3 d;c,BDL 7 d;d,BDL 14 d;e,BDL 21 d;f,BDL 28 d。
2.4 大鼠肝臟組織苦味酸-天狼星染色 假手術(shù)組在中央靜脈壁和匯管區(qū)間見極少量膠原纖維,膽總管結(jié)扎3d后匯管區(qū)可見膠原纖維增生沉積較假手術(shù)組增多,隨著膽管結(jié)扎時間逐漸延長,肝纖維化程度持續(xù)增加,肝內(nèi)膠原沉積在增生的膽管上皮細胞周圍,以匯管區(qū)為中心向肝實質(zhì)延伸,增生的小膽管及其周圍的膠原纖維形成間隔,部分與臨近的增生間隔相互連接、包繞、分割,形成假小葉(圖3)。
注:a,假手術(shù)組;b,BDL 3 d;c,BDL 7 d;d,BDL 14 d;e,BDL 21 d;f,BDL 28 d。
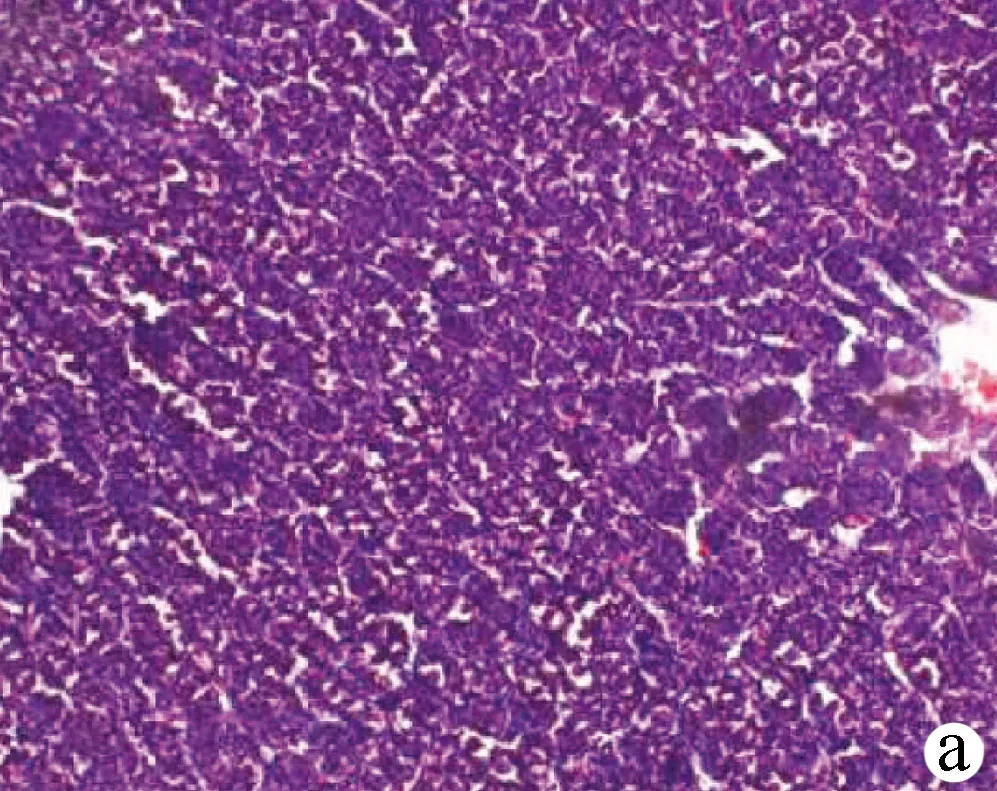
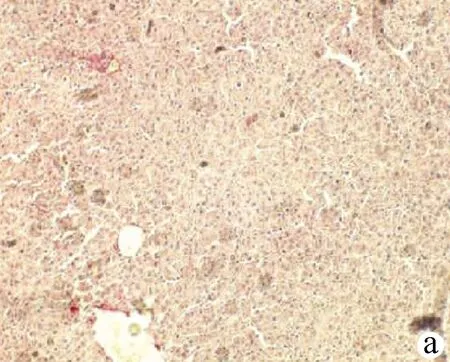
2.5 免疫組化檢測αSMA及TGFβ1在大鼠肝組織中的表達 結(jié)果顯示,假手術(shù)組僅在血管壁平滑肌見少量αSMA表達;BDL第3天,αSMA在血管壁表達明顯;第7天匯管區(qū)的膽管壁亦見αSMA表達、棕黃色顏色加深;第14天αSMA表達較前明顯增多,呈長橢圓形;第21、28天在匯管區(qū)、纖維間隔區(qū)αSMA蛋白沉積明顯、αSMA陽性表達的面積增大,染色明顯加深(圖4)。假手術(shù)組大鼠肝組織中可見少量TGFβ1表達,主要在肝組織的間質(zhì)細胞;BDL第3、7天,大鼠肝組織中匯管區(qū)TGFβ1表達,呈棕黃色胞漿型分布;第14天,TGFβ1表達明顯增強,數(shù)目增多,匯管區(qū)和纖維隔中染色明顯加深,呈斑片狀彌漫性分部(圖5)。
注:a,假手術(shù)組;b,BDL 3 d;c,BDL 7 d;d,BDL 14 d;e,BDL 21 d;f,BDL 28 d。

注:a,假手術(shù)組;b,BDL 3 d;c,BDL 7 d;d,BDL 14 d;e,BDL 21 d;f,BDL 28 d。
2.6 免疫組化半定量及肝纖維化程度評分 結(jié)果提示,免疫組化半定量中,除BDL第3天外,各組與假手術(shù)組相比,差異均有統(tǒng)計學意義(P值均<0.05),且隨時間延長αSMA、TGFβ1表達強度增加;肝纖維化評分比較,各組與假手術(shù)組相比,差異均有統(tǒng)計學意義(P值均<0.05),且隨時間延長肝纖維化程度增加(表2)。

表2 免疫組化半定量及肝纖維化評分
2.7 NLRP3炎性體蛋白表達 與假手術(shù)組比較,除BDL3 d組NLRP3外,余組NLRP3炎性體(NLRP3、ASC、caspase1)蛋白表達均增加(P值均<0.05),隨時間延長,BDL14 d前組間比較,差異均有統(tǒng)計學意義(P值均<0.05),第14天后增高趨于平穩(wěn)(圖6,表3)。

表3 NLRP3炎性體蛋白表達
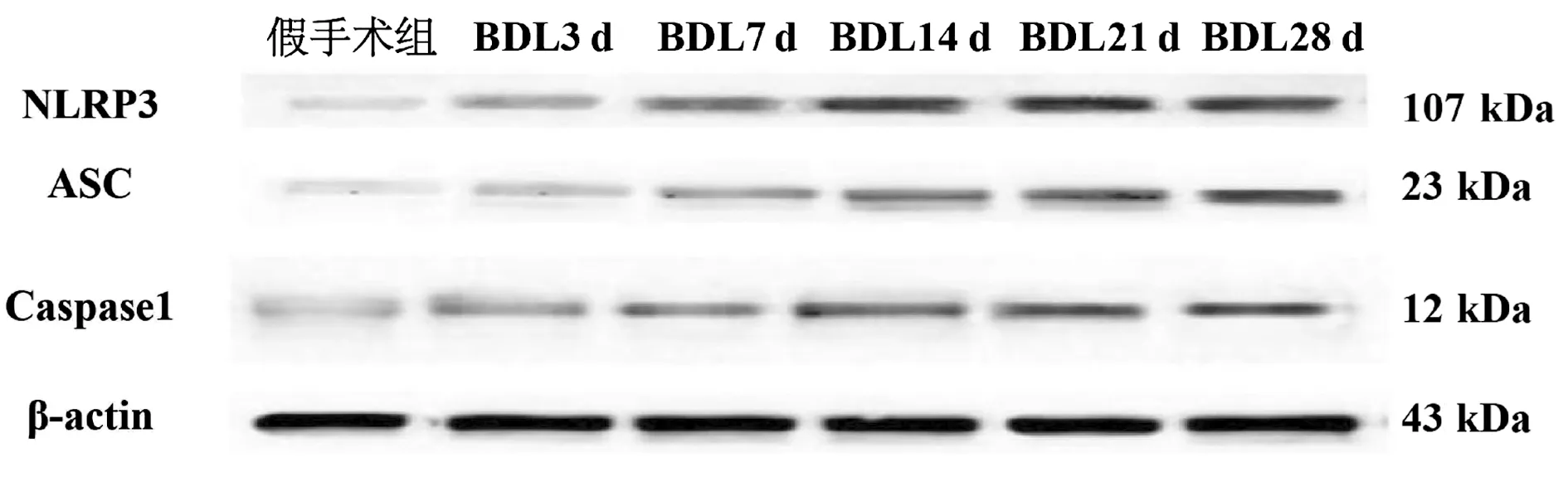
圖6 大鼠肝組織NLRP3炎性體蛋白表達情況
2.8 NLRP3炎性體mRNA表達 與假手術(shù)組比較,各組NLRP3炎性體(NLRP3、ASC、caspase1)mRNA表達均增加(P值均<0.05),隨時間延長,BDL14 d前組間比較,差異均有統(tǒng)計學意義(P值均<0.05),14天后增高趨于平穩(wěn)(表4)。

表4 NLRP3炎性體mRNA表達
2.9 肝組織IL-1β水平 IL-1β在造模后第3天明顯增高,并達到最高值,第7~28天各指標較第3天下降,但與假手術(shù)組相比仍有升高(P值均<0.05)(表5)。
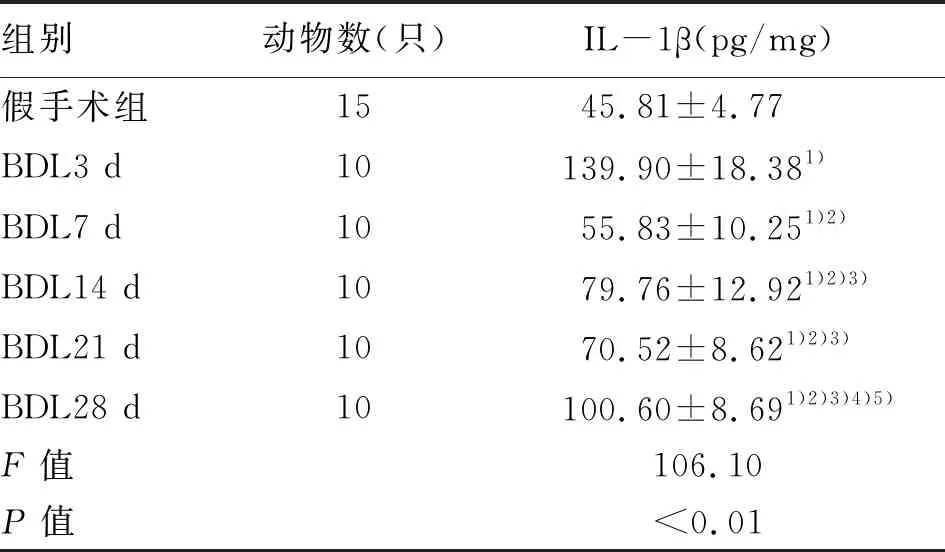
表5 各組肝組織IL-1β水平
3 討論
BDL是制作肝纖維化動物模型的經(jīng)典方法,可導致肝細胞變性、壞死及肝纖維化,最終導致肝硬化[1,9]。膽總管結(jié)扎急性期為3 d,慢性期超過10 d,急性期主要是炎癥開始及免疫細胞浸潤,慢性期主要是免疫細胞浸潤、炎癥和晚期纖維化的變化導致疾病進展[10]。肝臟受傷后,肝星狀細胞被激活分化為產(chǎn)生膠原的肌成纖維細胞,從而導致細胞外基質(zhì)的過度產(chǎn)生,是肝纖維化發(fā)生發(fā)展的重要環(huán)節(jié)[11-12]。而αSMA的表達是肝星狀細胞活化的重要標志[13-14],TGFβ1是參與肝纖維化過程中影響肝星狀細胞活化的最有效介質(zhì)[15],它通過刺激細胞外基質(zhì)的合成和抑制細胞外基質(zhì)的降解,在將靜止的肝星狀細胞轉(zhuǎn)化為纖維化的肌成纖維細胞過程中起著至關(guān)重要的作用[16]。NLRP3炎性體主要是由NLRP3、ASC、caspase1三者相互作用,形成的一個同心的組織,其中ASC層包圍著NLRP3蛋白,而caspase1則附著在外面的ASC層上[17]。NLRP3炎性體是機體固有免疫系統(tǒng)的重要組成部分,能夠識別各種應(yīng)激、外源微生物和內(nèi)源性危險信號,被多種刺激激活[18-19]。NLRP3炎性體被激活后,產(chǎn)生有活性的caspase1,導致IL-1β和IL-18的釋放,介導炎癥反應(yīng)發(fā)生[20]。近來有研究[21]表明,NLRP3炎癥體在肝星狀細胞激活中的作用直接引發(fā)了肝纖維化。
有研究[22-25]顯示,NLRP3炎性體參與慢性阻塞性肺疾病、糖尿病腎病、心血管疾病、炎性腸病以及自身免疫疾病等的發(fā)生發(fā)展。同時在各種急慢性肝病及肝纖維化中也存在NLRP3的表達[26],這將有望成為臨床上治療疾病的新靶點。據(jù)報道NLRP3抑制劑MCC-950可以減輕小鼠實驗性非酒精性脂肪性肝炎中的肝臟炎癥和纖維化[27],caspase1抑制劑在體內(nèi)抑制NLRP3炎癥小體可顯著降低膽管結(jié)扎小鼠肝組織成熟IL-1β水平,減輕肝纖維化程度[28]。但并沒有實驗說明NLRP3炎性體與肝纖維化的相關(guān)性,以及在肝纖維化形成過程中NLRP3炎性體是否持續(xù)活化。
本研究結(jié)果顯示,BDL大鼠模型第3天處于急性期,血清AST、ALT、ALP、DBil、TBA、TBil、肝組織IL-1β水平明顯升高,其后有所下降,考慮后期由急性期轉(zhuǎn)入慢性,在肝臟的自我修復(fù)功能作用下,肝功能指標及IL-1β有所恢復(fù),但仍不能恢復(fù)到正常水平,隨著時間延長炎癥損傷持續(xù)存在。HE染色、Masson染色、苦味酸-天狼星染色,顯示BDL大鼠模型組隨時間延長,可見炎癥細胞浸潤,肝小葉間膽管增生,匯管區(qū)纖維組織增生,后期大量假小葉形成,以及膠原纖維沉積持續(xù)增加,肝纖維化程度評分逐漸增加,提示BDL大鼠模型中存在著肝炎-肝纖維化-肝硬化的動態(tài)演變;免疫組化結(jié)果顯示αSMA、TGFβ1 蛋白隨時間延長表達強度逐漸增加,提示肝纖維化過程持續(xù)加重;BDL大鼠模型組肝組織中NLRP3炎性體蛋白及mRNA表達漸次增高,14 d后趨于平穩(wěn),提示在肝纖維化過程中NLRP3炎性體活化持續(xù)存在,考慮到14 d后肝纖維化向肝硬化方向轉(zhuǎn)變,但NLRP3炎性體仍處于高表達狀態(tài),說明在肝纖維化-肝硬化過程中NLRP3炎性體亦參與其中,但其作用機制仍需進一步探究。
以上結(jié)果顯示 BDL大鼠造模后肝臟損傷,病理學膠原纖維明顯沉積,肝纖維化標志物明顯表達,證實了BDL大鼠模型中存在肝炎-肝纖維化-肝硬化的動態(tài)演變;伴隨著肝纖維化的發(fā)生發(fā)展,NLRP3炎性體蛋白及基因表達明顯上調(diào),并于BDL14 d后處于穩(wěn)定高表達狀態(tài),提示在肝炎-肝纖維化-肝硬化演變過程中存在著NLRP3炎性體的持續(xù)活化,可能與其發(fā)揮促進纖維化的作用有關(guān)。因此從NLRP3炎性體進行研究,探索肝纖維化的機理,有助于阻斷肝纖維化的產(chǎn)生,阻止病情進一步惡化,對臨床肝纖維化的治療及新藥的開發(fā)提供了一定依據(jù)。
利益沖突聲明:本研究不存在研究者、倫理委員會成員、受試者監(jiān)護人以及與公開研究成果有關(guān)的利益沖突。
作者貢獻聲明:周蒙恩、陳懿榕等負責課題設(shè)計,資料分析,撰寫論文;張娜、晏旎、闕任燁等參與收集數(shù)據(jù),修改論文;李勇等負責擬定寫作思路,指導撰寫文章并最后定稿。

