BCLC 0/A期肝細胞癌根治性切除術后復發評分預警系統的建立及其預測價值分析
劉 勝, 唐豪佑, 楊 洋, 曾 新, 黃孝彬, 顧秋紅, 李建水
1 川北醫學院附屬醫院 肝膽外二科, 四川 南充 637000;
2 德陽市人民醫院 重癥醫學科, 四川 德陽 618000
原發性肝癌(primary liver cancer,PLC)是癌癥相關死亡的最主要因素之一,2018最新的GLOBOCAN統計顯示其占所有癌癥死亡8.2%[1]。其中,肝細胞癌(HCC)占90%以上,因起病隱匿,發現較晚,預后欠佳[2]。根據BCLC分期診療指南,0/A期肝癌優先考慮手術切除治療,而稍晚期的則推薦其考慮經肝動脈化療栓塞(TACE)治療,但療效差異較大[3]。因此,早期發現并行根治性切除是HCC患者獲得較長總體生存最重要的治療方法。然而,術后復發轉移卻極大影響療效,研究[4]表明術后5年復發率高達70%,而且目前尚無針對復發后治療優良方案,導致長期存活率低。因此,如何預測術后患者復發風險,建立相關的預警系統來指導患者術后復查及治療顯得尤其重要。根據預測系統為患者擬定個體化復診方案,以達到早期治療、分類干預、降低復發率從而提高生存率的目的。以期為根治性切除BCLC 0/A期肝癌患者獲得更好的術后生存提供參考。
1 資料與方法
1.1 研究對象 回顧性分析2009年1月—2015年1月在川北醫學院附屬醫院接受根治性外科切除術治療的BCLC 0/A期 HCC患者相關資料。納入標準:(1)根據美國肝病學會(AASLD)和歐洲肝病學會(EASL)肝癌治療指南診斷為BCLC 0/A 期的HCC患者,并在第一次診斷后即接受手術切除;(2) Child-Pugh A~B級、ECOG-PS 0分;(3)影像學檢查明確未見遠處轉移。排除標準:(1)BCLC分期更晚者;(2)既往有微波及射頻消融、放化療、靶向藥物等相關治療史者;(3) 伴有嚴重的心、肺、腎功能不全或其他系統惡性腫瘤者;(4)臨床資料不全及失訪者。
1.2 治療方式 開腹手術與腹腔鏡下手術的選擇,在以能更好地達到根治性切除的前提下,根據臨床主刀醫師的經驗及習慣進行選擇。所納入病例的手術均由經驗豐富的教授主刀完成(主刀臺次>100例同類手術)。本研究中根治性外科切除術定義:完全切除腫瘤結節,主要采取解剖性切除,不能行解剖性切除的要求至少達到無肉眼可見腫瘤切緣。根據Couinaud的分類,解剖性切除是指對肝功能儲備滿意的患者進行至少一個節段(即節段切除、扇形切除或半肝切除)的完全切除。非R0切除患者術后予以口服中成藥(半年至一年):十味蒂達膠囊0.9 g(2粒)每天3次、復方斑蝥膠囊750 mg(3粒)每天2次;術前HBsAg陽性患者且病毒滴度高的患者,術前行抗病毒治療待病毒滴度下降后行手術治療;所有術前HBsAg陽性患者術后長期予以抗病毒治療(恩替卡韋0.5 mg每天1次)。復發前,余未行其他方式治療,門診定期復查隨訪。
1.3 數據收集 收集入組患者的一般人口學資料(年齡、性別、體質量等),血液化驗結果(肝腎功能、血常規等),影像學檢查結果(腫瘤數目、血管包膜侵犯、腫瘤最大直徑等)。入組患者均在術后通過住院資料及電話咨詢等方式進行回顧性隨訪統計,咨詢和統計內容包括臨床查體,血液學檢查(腫瘤標志物、血常規、肝腎功能及凝血功能等),影像學檢查(胸部、腹部平掃及增強掃描CT或磁共振等)。總生存期(overall survival,OS)定義為:從患者接受治療之日開始到患者死亡或最后一次臨床隨訪的時間為止。最后一次臨床回顧性隨訪(<5年)無復發則默認該患者5年時間內未復發。
1.4 倫理學審查 本研究方案經由川北醫學院附屬醫院倫理委員會審批,符合醫學倫理學規定。
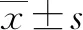
2 結果
2.1 一般資料 共納入232例BCLC 0/A期HCC患者,依據5年內復發狀態分為復發組(103例)和非復發組(129例)。在所有納入研究的根治性切除的BCLC 0/A期HCC患者中,復發部位絕大部分(83.4%)為肝內復發,其次為肺、腹腔,也包括骨、腦、淋巴結等。兩組比較,BCLC 0/A分期差異無統計學意義(P>0.05)。其中性別、年齡、體質量、術前RBC、WBC、PLT、TBil、DBil、腫瘤數、分化程度、并發癥、住院時間差異均無統計學意義(P值均>0.05);而術前AST、ALT復發組明顯高于非復發組,術前Alb復發組明顯低于非復發組(P值均<0.05);復發組HBsAg陽性、包膜侵犯、微血管侵犯(MVI)、腫瘤直徑≥5 cm、肝硬化(中重度)、非R0切除、5年死亡數所占比例顯著高于非復發組(P值均<0.05);復發組的OS明顯低于非復發組(P<0.05)(表1)。

表1 術后5年內復發組與非復發組相關基線資料、并發癥及結局的比較
2.2 影響BCLC 0/A期HCC患者術后5年復發的危險因素 以入組患者的基線資料及術前部分化驗指標為自變量,術后5年內復發狀態為因變量,進行二元logistic回歸分析。單因素分析結果顯示,術前Alb<40 g/L、術前ALT≥40 U/L、MVI、HBsAg陽性、包膜侵犯、腫瘤直徑≥5 cm、肝硬化(中重度)、非R0切除均是根治性切除的BCLC 0/A期HCC患者術后5年復發的影響因素(P值均<0.05)(表2)。

表2 BCLC 0/A期HCC患者行根治性切除術5年復發的logistic單因素分析
將單因素分析有統計學意義的影響因素納入多因素分析,結果顯示, 術前Alb<40 g/L(OR=5.796,P<0.001)、術前ALT≥40 U/L(OR=3.029,P=0.002)、MVI(OR=3.981,P=0.003)、HBsAg陽性(OR=7.829,P<0.001)、包膜侵犯(OR=5.357,P<0.001)、非R0切除(OR=3.048,P=0.018)均為根治性切除的BCLC 0/A期HCC患者術后5年復發的獨立危險因素(表3)。因此,對肝功能異常患者,術前應積極保肝、糾正低蛋白血癥等對癥治療,對于HBsAg陽性、包膜侵犯、MVI、腫瘤直徑≥5 cm、中重度肝硬化、非R0切除的患者告知復發風險,規律按時復診十分關鍵。因此,本研究希望通過對危險因素進行聯合分析,建立患者術后復發的預警系統。

表3 BCLC 0/A期HCC患者行根治性切除術5年復發的logistic多因素分析
2.3 肝癌根治性切除術后復發評分預警系統(PLC-EWSPRS)評分分布及差異 根據危險因素建立PLC-EWSPRS評分系統,其中獨立危險因素賦值為2分,危險因素賦值為1分,該評分系統的閾值為0~14分,統計分析結果顯示復發組最低分2分,最高分14分,平均(8.39±2.58)分;非復發組最低分0分,最高分11分,平均(4.33±2.35)分;即復發組的最低分與最高分均高于非復發組。將其分為0~5、6~10、11~14低中高3個分數段。復發組病例主要分布在中、高分數段,非復發組病例主要分布在低、中分數段,復發組中高分數段所占比例遠高于非復發組,即中高分數段的復發率顯著高于低分段(P<0.05)(表4)。
2.4 診斷預測效能 為了進一步證實PLC-EWSPRS評分系統評分越高,復發風險越大,具有復發風險預測價值,同時評估其對根治性切除的BCLC 0/A期HCC患者術后5年生存狀態是否具有預測價值,本研究對該系統評分進行診斷效能分析。ROC曲線分析結果顯示,預測根治性切除的BCLC 0/A期HCC患者術后5年死亡的AUC(95%CI)為0.672(0.599~0.744),P<0.001;亞組預測低、中、高分數段術后5年死亡的AUC(95%CI)分別為:0.478(0.338~0.619),P=0.595;0.544(0.436~0.652),P=0.425;0.571(0.315~0.826),P=0.770。預測根治性切除的BCLC 0/A期HCC患者術后5年內復發的AUC(95%CI)為0.918(0.883~0.953),P<0.001;亞組預測低、中、高分數段術后5年內復發的AUC(95%CI)分別為:0.796(0.695~0.896),P=0.002;0.859(0.791~0.927),P<0.001;0.944(0.839~1.000),P=0.044。因此,PLC-EWSPRS系統對根治性切除的BCLC 0/A期HCC患者術后5年內生存狀態預測價值有限,各亞組預測無意義(P>0.05);而對術后5年復發具有良好的預測價值,各亞組預測價值仍較高(P<0.05)(圖1、2)。

圖2 PLC-EWSPRS預測術后5年死亡的ROC曲線
3 討論
PLC嚴重威脅著人類的健康,是全球癌癥相關死亡的第三大主要原因[5],根治性外科切除是HCC極其重要的治療方式[6]。HCC治療方式的選擇當前主要以BCLC分期為主要參考標準,其中BCLC 0/A期主要首選根治性手術[3]。雖然已經有研究預擴大BCLC肝癌切除標準,即對BCLC-B甚至BCLC-C期HCC患者也行手術切除治療[7]。已經有部分回顧性分析提出肝切除術能夠使部分BCLC B/C期患者取得可接受的結果[7-8],但還需要大量前瞻性臨床研究加以證實。因此,本研究選擇以BCLC 0/A期HCC患者為研究對象,探究術后復發的相關問題。早期HCC往往具有更大的手術治療機會,掌握手術時機及積極術前準備均十分關鍵[9]。盡管BCLC 0/A期HCC多數具有良好的手術治療指征,本應取得良好的手術效果,然而肝癌切除術后5年腫瘤復發轉移率高達40%~70%[10],本研究術后5年復發率為44.40%,亦在此高發范圍內。并且在本研究中復發組的5年病死率為49.5%,非復發組的5年病死率為22.5%,由此可見術后復發嚴重制約著肝癌患者術后生存。因此,建立一個全面系統的肝癌術后復發預警系統十分關鍵,通過預警系統為患者擬定個性化的治療及復診方案,以達到預防或減少復發、提高OS的目的。
HBV可促進中國人群肝癌的侵襲性[11]。抗病毒治療應貫穿乙型肝炎相關HCC的外科手術前、術后及非手術治療的全過程[12]。既往研究提出術前HBV DNA高負荷是肝癌術后復發的獨立危險因素,術后復發預示著更低的復發后生存率[7],這與本研究證實HBsAg陽性為術后復發獨立危險因素結果一致。Wu等[13]通過多因素分析表明HBV DNA水平>106拷貝/ml與遠期復發(>2年)顯著相關,因此術前降低病毒滴度和術后抗病毒及抗炎治療對降低復發至關重要。有研究[14-15]表明腫瘤直徑與早期復發及MVI發生也顯著相關,而MVI與肝癌預后不良及早期復發亦密切相關[11,16-17]。對腫瘤肌肉壁及距包膜1 cm外的血管被侵潤的患者,術后更加容易復發[18]。但MVI目前只能通過術后病理獲得,具有局限性,迫切需要新的指標和方法來預測MVI的發生[19]。也有更早的研究[20]提出腫瘤直徑≥5 cm為肝切除術后1年內進展導致早期死亡的獨立危險因素。以上都表明腫瘤直徑及MVI與預后不良密切相關。對于肝功能異常的患者,如:低蛋白血癥、轉氨酶升高、高膽紅素血癥等,需要積極糾正后再行手術治療。有學者[21]總結肝內膽管癌及HCC行手術治療時,提出切緣陰性(R0切除)可顯著降低復發、提高生存率,并且如果能夠保留足夠的功能性肝殘余,建議對HCC和肝內膽管癌進行寬切緣的解剖切除,與本研究結果相同,也體現了行R0切除的必要性。要求術者經驗豐富,做到精準解剖十分關鍵。包膜侵犯與HCC患者的總體生存及術后復發密切相關,對于HCC術后化療患者,包膜浸潤為OS的獨立危險因素[22]。以上研究結果均與本研究確立的危險因素吻合,因此將這些危險因素納入預測系統。
面對目前尚無針對術后復發有效預測系統的現狀, PLC-EWSPRS評分系統的建立具有重要意義。并且該系統通過危險因素進行賦值評分加以匯總,綜合臨床指標更加全面具體,比單一因素具有更強的客觀預測價值。在本研究中發現,復發組中高分數段所占比例遠高于非復發組,提示該系統評分越高,復發風險越大,應該引起臨床醫師及患者的注意。根據總體及分層分析的ROC曲線的AUC值可知,PLC-EWSPRS系統對根治性切除的BCLC 0/A期HCC患者術后5年內生存狀態預測價值有限,而對術后5年復發具有良好的預測價值。
本研究為單中心、小樣本的回顧性研究,研究中兩組患者腫瘤數和腫瘤分化程度無顯著差異,與目前共識存在差異,未能納入進行分析,這可能與研究樣本量及病例納入標準不同有關。另外,因目前肝癌術后復發相關預警系統罕見,未能進行預測價值的對比分析。后續還可以擴大納入對象范圍,以BCLC分期進行亞組分析,評估該系統對不同分期患者是否均具有術后復發預測價值。最后,因納入對象的無瘤生存時間不明確病例較多,故未能行時間相關性的Cox回歸分析,在后續驗證中可以進行探究。因此,該系統還需要大樣本、多中心、前瞻性的研究加以完善。但不能否認其在預測術后復發中所表現出的潛在價值。
綜上,PLC-EWSPRS對BCLC 0/A期HCC患者術后5年復發具有良好的預測價值,對根治性切除的BCLC 0/A期HCC患者術后復查及治療策略的制訂具有重要的指導意義。
利益沖突聲明:本研究不存在研究者、倫理委員會成員、受試者監護人以及與公開研究成果有關的利益沖突。
作者貢獻聲明:劉勝負責課題設計,資料分析,撰寫論文;唐豪佑、楊洋、曾新、黃孝彬、顧秋紅參與收集數據和分析,修改論文;李建水負責擬定寫作思路,指導撰寫文章并最后定稿。

