不同干燥方式對油菜蜂花粉色澤、酚酸含量和抗氧化活性的影響
周子丹,彭文君,倪家寶,畢延祥,方小明,*,劉素純,*
(1.湖南農業大學食品科學技術學院,湖南 長沙 410128;2.中國農業科學院蜜蜂研究所,北京 100093)
蜂花粉是由工蜂通過花朵與其身體之間產生的弱靜電場來收集花粉粒,并通過唾液分泌物和花蜜浸濕凝結成粒徑約1.4~4 mm的扁圓形團狀物[1]。蜂花粉含有豐富的碳水化合物、蛋白質、脂類、維生素、礦物質和許多天然活性物質,是一種具有高潛在生物價值的食品,被稱為“天然微型營養庫”[1-2]。由于新鮮蜂花粉水分質量分數較高(可達到30%),并且有高度吸濕性,易黏結成團,甚至容易受到微生物污染[3]。干燥是解決這些問題的最有效方法之一,并有利于提升蜂花粉產品品質和附加值。
蜂花粉干燥過程涉及熱交換、失水、氧氣、光照等因素,其間發生一系列復雜的理化反應,是影響產品品質的關鍵環節。目前常用的蜂花粉干燥方式有自然晾曬、熱風干燥、紅外干燥、冷凍干燥等。Estevinho等[4]比較了熱風干燥和冷凍干燥對蜂花粉脂質、VC、β-胡蘿卜素的影響,發現冷凍干燥可更好地保存生物活性成分;Isik等[5]采用紅外干燥對蜂花粉進行處理,結果表明隨著紅外功率的增加,干燥時間顯著縮短,蜂花粉表面的形態變化增大,且50 W紅外干燥比其他功率水平更能保持蜂花粉的蛋白質、脂肪、總碳水化合物和VC等品質指標含量。干燥溫度為45 ℃時,真空脈動干燥能減少荷花蜂花粉的色澤劣變,同時能較好地保持蜂花粉顆粒微觀結構的完整性[6]。Song Xiaodong等[7]探究了熱風干燥溫度對荷花蜂花粉色澤、抗氧化活性和脂質氧化的影響,結果表明40 ℃時能最大限度地保留荷花蜂花粉的營養成分。因此,不同干燥處理會導致蜂花粉產品的色澤、生物活性成分、抗氧化活性和微觀結構等產生變化。但關于不同干燥方式對蜂花粉品質特性和微觀結構的影響研究相對不足。
微觀結構與宏觀品質特性(如色澤、外觀形態等)密切相關[7-8]。蜂花粉微觀結構的改變,將導致生物活性成分含量出現顯著變化[9]。酚酸化合物是蜂花粉中一種重要的生物活性成分,具有抗氧化、抗炎、抑菌等多種活性功能[10-12],但酚酸化合物性質不穩定,對熱敏感,在受熱情況下極易發生分解、氧化和脫羥基反應,而不同的干燥條件會影響酚酸化合物活性,進而改變食品的營養品質與商品價值[13];因此,適宜的干燥方式對蜂花粉中酚酸類成分的保護至關重要。目前,不同干燥方式對蜂花粉的酚酸化合物的影響鮮見報道。
因此,本實驗研究了自然晾曬、熱風干燥、中短波紅外干燥、真空冷凍干燥和真空脈動干燥對油菜蜂花粉的干燥動力學、色澤、酚酸含量及抗氧化活性的影響,并通過微觀結構觀察揭示油菜蜂花粉水分遷移和品質的變化規律,同時分析油菜蜂花粉抗氧化活性、酚酸化合物與色澤間的相關性,最后通過主成分分析和聚類分析探究不同干燥方式間的差異,為油菜蜂花粉干燥加工提供理論依據。
1 材料與方法
1.1 材料與試劑
新鮮青海油菜蜂花粉(純度為(85.52±0.64)%))采自青海省西寧市蜂場。
綠原酸、對香豆酸、芥子酸、香草酸、沒食子酸標準品(純度>95%) 上海源葉生物科技有限公司;甲醇、乙腈(色譜純) 美國賽默飛世爾科技有限公司;水溶性VE(Trolox)標液(純度>97%)、二硫蘇糖醇(純度>98%)、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、FeSO4·7H2O(純度>99%) 西格瑪奧德里奇貿易有限公司;鐵離子還原力(ferric ion reducing antioxidant power,FRAP)工作液、無水醋酸鈉、冰醋酸、鹽酸、FeCl3國藥集團化學試劑有限公司。
1.2 儀器與設備
真空脈動干燥機、冷凍干燥機、熱風干燥機 中國農業大學工學院農產品加工技術與裝備實驗室;中短波紅外干燥機 泰州圣泰紅外科技有限公司;1290 Infinty II液相色譜系統、6495三重四極桿液相色譜-質譜聯用儀 美國安捷倫科技有限公司;S-3400掃描電子顯微鏡 日本日立公司;CM-5型分光測色計 日本柯尼卡美能達公司;TU-1810紫外-可見分光光度計 北京普析通用儀器有限公司;AR3130電子分析天平 美國OHAUS公司。
1.3 方法
1.3.1 含水率的測定和油菜蜂花粉的不同干燥處理
實驗前將新鮮油菜蜂花粉放入-20 ℃冰柜中冷凍保存,備用。參考文獻[7]測定初始油菜蜂花粉含水率。
分別采用自然晾曬、熱風干燥、中短波紅外干燥、真空脈動干燥和真空冷凍干燥對油菜蜂花粉進行干燥。當油菜蜂花粉恒質量(前后2 次稱量的質量相差小于2 mg)時結束干燥。干燥結束后將油菜蜂花粉取出,冷卻至室溫后密封,于-20 ℃冰柜中冷凍保存,備用。干燥實驗重復3 次。5 種干燥方式的干燥工藝參數設置如下。
自然晾曬(sun drying,SD):在晴朗天氣下(溫度32 ℃、相對濕度68%),將收集的新鮮油菜蜂花粉直接置于陽光下曬干,鋪料厚度為5 mm。晾曬時間為10∶00~16∶00。然后將油菜蜂花粉密封,暫存于干燥器中。
真空脈動干燥[6](pulsed vacuum drying,PVD):輻射板面溫度45 ℃;真空保持時間12 min(常壓保持時間3 min、鋪料厚度5 mm)。
熱風干燥[7](hot air drying,HAD):溫度45 ℃、風速3 m/s、鋪料厚度5 mm。
真空冷凍干燥[14](freeze drying,FD):-40 ℃預冷凍16 h;于25 ℃、50 Pa條件下干燥,鋪料厚度為5 mm。
中短波紅外干燥[15](infrared drying,IRD):溫度45 ℃、功率1 kW、鋪料厚度5 mm。
1.3.2 干燥特性分析
各組油菜蜂花粉在干燥處理過程中每隔20 min取樣,參考文獻[7]測定干基含水率。按式(1)計算油菜蜂花粉的水分比(moisture ratio,MR)[16],記錄油菜蜂花粉的MR隨干燥時間t/min的變化情況,并繪制出干燥動力學曲線。

式中:M0和Mt分別表示物料初始干基含水率和干燥t時刻的干基含水率/(g/g)。
1.3.3 色澤的測定
色澤測定參考Guclu等[17]的方法,并稍作修改。將油菜蜂花粉分別填滿培養皿(直徑為45.3 mm,高度為17.3 mm)中,采用CM-5型分光測色計,經白色反射板校正后測定油菜蜂花粉色度:L*值(亮度)、a*值(紅度)、b*值(黃度)。按式(2)計算各組油菜蜂花粉的色差ΔE。
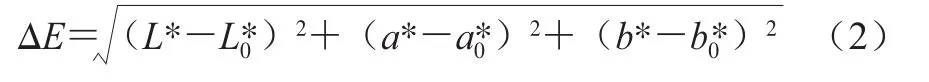
式中:L*、a*、b*值分別為經干燥處理油菜蜂花粉的亮度、紅度、黃度;L0*、a0*、b0*值分別為新鮮油菜蜂花粉的亮度、紅度、黃度。
1.3.4 微觀結構觀察
待所有干燥實驗完成后,7 d內完成微觀結構觀察。取少量經干燥處理后的油菜蜂花粉固定在鋁制載物板上噴金,將制備好的樣品放入樣品室中,抽真空后使用S-3400型掃描電子顯微鏡在10 kV的加速電壓下觀察樣品的微觀結構,同時將新鮮油菜蜂花粉的微觀結構作為對照。
1.3.5 酚酸化合物的液相色譜-質譜聯用分析
1.3.5.1 樣品前處理
稱取(1.00±0.05)g磨碎的待測油菜蜂花粉樣品,加入10 mL 80%(體積分數)甲醇溶液;65 ℃水浴加熱10 min,漩渦振蕩提取2 min,超聲5 min;25 ℃、9 000 r/min條件下離心10 min,用0.2 μm尼龍過濾膜過濾后置于棕色進樣瓶備用。
混合標準溶液的配制:準確稱取1.0 mg的綠原酸、對香豆酸、芥子酸、香草酸、沒食子酸標準品,分別加入1 mL甲醇充分溶解,于-20 ℃保存備用。使用前將各標準品配制成混合標準品溶液。
1.3.5.2 液相色譜-質譜聯用分析
色譜條件:色譜柱:Poroshell 120 SB-Aq(2.1 mm×100 mm,2.7 μm);進樣量:2.00 μL;柱溫:30 ℃;其中,流動相分別為0.1%(體積分數)甲酸溶液(A相)和乙腈(B相),梯度洗脫程序為0.00~0.50 min,5% B;0.51~5.00 min,5%~95% B;5.01~7.00 min,95% B;7.01~8.00 min,5% B;流速:0.300 mL/min。電離模式:負離子模式;霧化壓力:45 psi;干燥氣(N2):15 L/min,250 ℃;鞘流氣(N2):12 L/min,350 ℃;毛細管電壓:3 000 V;噴嘴電壓:1 500 V;采集模式:多反應監測。
1.3.6 抗氧化能力的測定
1.3.6.1 油菜蜂花粉提取液的制備
樣品前處理方法參考Wang Hui等[9]的方法,稍作修改。將油菜蜂花粉粉碎,過60 目篩后稱取(2.00±0.05)g油菜蜂花粉于研缽中,加入13 mL體積分數70%的甲醇溶液,充分研磨,轉移至50 mL離心管,然后于室溫下超聲輔助提取30 min,對提取液進行低溫離心(4 ℃、8 000 r/min,15 min),收集上清液即油菜蜂花粉提取液,置于4 ℃保存,每個樣品重復提取3 次。
1.3.6.2 DPPH自由基清除能力
DPPH自由基清除能力根據Uribe等[18]的方法進行測定,并稍作修改。取油菜蜂花粉提取液2 mL于具塞管中,加入0.10 mmol/L DPPH-乙醇溶液2 mL,在室溫下避光保存30 min。使用紫外-可見分光光度計于517 nm波長處測定吸光度。標準曲線:y=-0.015 1x+0.774 8(R2=0.994 8),其中y為吸光度,x為Trolox濃度/(μmol/L)。油菜蜂花粉的DPPH自由基清除能力結果用Trolox當量表示,單位為mmol/g。
1.3.6.3 鐵離子還原力
FRAP參考Deng Lizhen等[19]的方法測定,并稍作修改。取3 mL FRAP工作液加入盛有0.1 mL油菜蜂花粉提取液的離心管中,放置10 min后用紫外-可見分光光度計于593 nm波長處測定吸光度。標準曲線:y=0.002 4x+0.043 7(R2=0.999 6),其中y為吸光度,x為Trolox濃度/(μmol/L)。FRAP結果用Trolox當量表示,單位為mmol/g。
1.4 數據處理與分析
采用SPSS 22.0及Origin 2021軟件進行數據處理與分析。所有實驗均重復3 次,實驗結果以平均值±標準差表示。采用Waller-Duncan事后檢驗對數據進行顯著性分析,當P<0.05時表示差異顯著。采用Pearson法進行相關性分析。
2 結果與分析
2.1 干燥方式對油菜蜂花粉干燥動力學與微觀結構的影響
經測定,油菜蜂花粉的初始濕基含水率為(0.191 7±0.001 6)g/g。不同干燥方式處理油菜蜂花粉MR隨干燥時間變化的曲線如圖1所示。在干燥前期,干燥MR快速下降;隨著干燥時間的延長,油菜蜂花粉干燥MR逐漸下降,最終趨于恒定。由于干燥后期油菜蜂花粉中大部分自由水散失,水分含量越來越接近其平衡含水率,水分擴散速度明顯降低。對比5 種干燥方式,中短波紅外干燥速率最快,這是因為中短波紅外干燥具有速熱特性,中短波紅外輻射能夠穿透物料表層,且能量直接與物料內部的水分耦合,促進物料內部的不易流動水向自由水轉化,進而加快水分向外擴散遷移[20-23]。中短波紅外干燥油菜蜂花粉微觀結構結果發現,中短波紅外輻射速熱效應使油菜蜂花粉內部的水蒸氣分壓快速增加,導致其細胞表面破裂,促進細胞內部水分擴散。El-Mesery等[21]在研究蘋果片干燥中也發現,相比熱風干燥,紅外干燥顯示出更快的干燥速率。自然晾曬是一種簡單而廉價的方法,但干燥耗時長,在室外環境中容易受到蟲害和微生物污染。微觀結構結果發現,自然晾曬下油菜蜂花粉顆粒表面有微生物聚集。這可能是由于油菜蜂花粉營養豐富、干燥初期水分含量較高,同時長時間暴露在空氣中導致微生物迅速增殖。顧賽麒等[24]在研究自然晾曬干制腌臘魚中也發現,隨著晾曬時間延長菌落總數不斷增加。與中短波紅外干燥相比,低溫(45 ℃)真空脈動干燥油菜蜂花粉微觀結構具有更好的完整性,這與本課題組前期研究結果[6]一致。

圖1 不同干燥方式油菜蜂花粉MR變化曲線及微觀結構Fig.1 Moisture ratio curves and microstructure of rape bee pollen subjected to different drying methods
2.2 干燥方式對油菜蜂花粉色澤的影響
不同干燥方式處理的油菜蜂花粉亮度(L*值)、紅度(a*值)、黃度(b*值)和色差(ΔE)如表1所示。研究表明,色差ΔE大于5時,即使沒有經驗的觀察者也可以通過人眼識別顏色差異[9]。由于采用較優干燥工藝參數,5 種干燥方式ΔE均小于5,因此感官評價未見差異。與新鮮油菜蜂花粉相比,真空脈動干燥油菜蜂花粉L*值與b*值變化不顯著(P>0.05),a*值顯著降低(P<0.05),ΔE最小(0.98±0.04),表明真空脈動干燥能有效地陰止油菜蜂花粉的色澤劣變,這與錢婧雅等[25]對紅棗脆片干燥的研究結果一致。其他4 種干燥處理的油菜蜂花粉的L*值均顯著降低(P<0.05),干燥處理后的油菜蜂花粉色澤均變暗,這可能是由于蜂花粉在干燥過程中的表面收縮會導致花粉顆粒向內折疊,從而導致反射光線的減少,L*值降低[26]。自然晾曬油菜蜂花粉a*值最高,ΔE最高(3.22±0.05)。其較低的干燥速率和較長的熱暴露時間會導致色素降解和非酶褐變的發生,從而發生較嚴重的色澤劣變[27-28]。
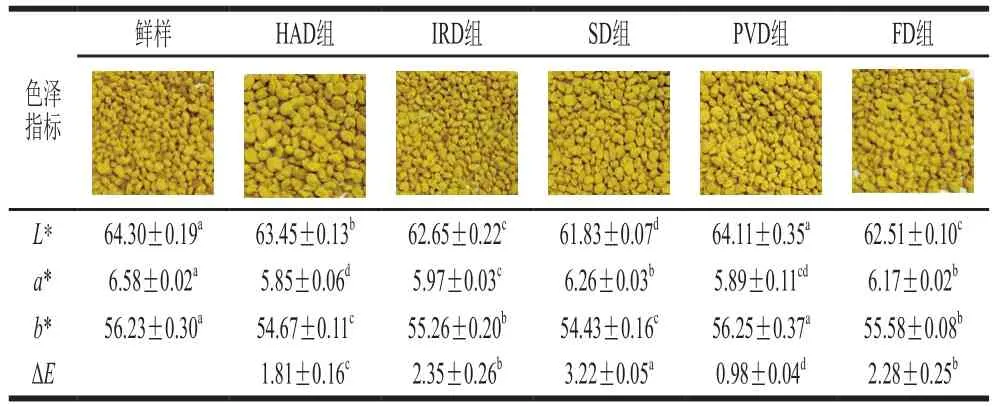
表1 不同干燥方式對油菜蜂花粉色澤的影響Table 1 Effects of different drying methods on color parameters of rape bee pollen
2.3 干燥方式對油菜蜂花粉酚酸化合物含量的影響
酚酸是植物次生代謝產物中含有羧酸官能團的芳香族酚類物質,是蜂花粉中重要的生物活性物質之一[1,29]。如表2所示,油菜蜂花粉中共測得沒食子酸、香草酸、綠原酸、對香豆酸、芥子酸5 種酚酸,與新鮮油菜蜂花粉相比,干燥后酚酸總量顯著增加(P<0.05)。油菜蜂花粉中的酚酸主要為對香豆酸,約占新鮮油菜蜂花粉酚酸總量的80%。與新鮮油菜蜂花粉相比,干燥后花粉中對香豆酸含量變化不明顯,沒食子酸含量增加,綠原酸、香草酸和芥子酸含量顯著增加(P<0.05)。研究表明,當溫度超過70 ℃時,酚酸會受熱降解[30],因此較低的干燥溫度(≤45 ℃)能較好地保護油菜蜂花粉中的酚酸化合物。真空脈動干燥油菜蜂花粉對香豆酸含量最高,為(7 877.90±556.48)mg/kg,且顯著高于冷凍干燥和自然晾曬的油菜蜂花粉。這是因為在真空脈動干燥過程中,干燥室的壓力在真空與常壓之間交替循環,使物料內部形成孔道,有利于提高細胞內部物質的提取率[31]。此外,真空脈動干燥可抑制酶促褐變、氧化等不良生化反應的發生,從而抑制了酚酸等生物活性物質的降解[32]。與其他油菜蜂花粉相比,自然晾曬油菜蜂花粉中香草酸和沒食子酸含量最高,比新鮮油菜蜂花粉分別提高了2.88 倍和2.07 倍。這是由于自然晾曬適宜微生物繁殖,相關研究表明微生物會合成包括酚酸在內的植物多酚[33],可能造成了以香草酸為主的酚酸含量顯著增加。與新鮮油菜蜂花粉相比,中短波紅外干燥花粉中沒食子酸、綠原酸、香草酸和芥子酸的含量顯著增加(P<0.05),這是由于中短波紅外干燥導致花粉細胞結構的破壞(圖1B),有利于細胞內部酚類化合物的釋放,從而提高酚類化合物的提取率[34]。與新鮮油菜蜂花粉相比,5 種方式干燥處理組樣品的綠原酸含量均顯著提高(P<0.05),這可能是植物在受到脫水等非生物脅迫時,會通過生成酚類化合物作為防御機制響應脅迫,其中包括生成以綠原酸為代表的苯丙類化合物[35-36]。
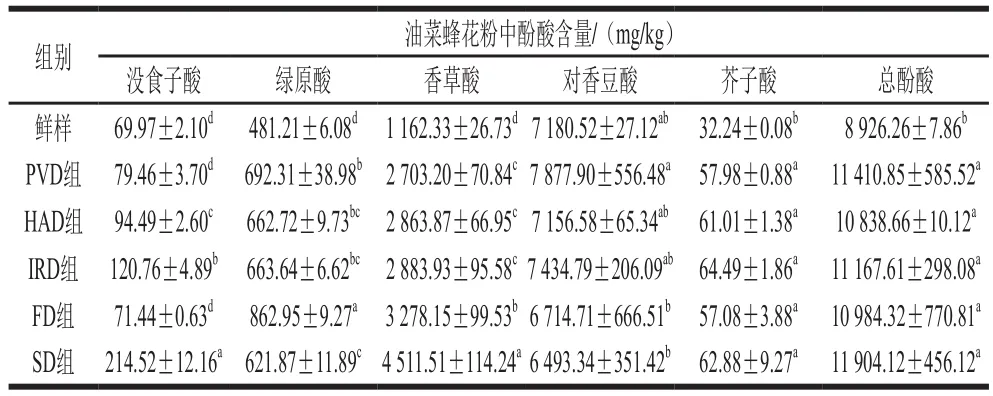
表2 干燥方式對油菜蜂花粉酚酸含量的影響Table 2 Effects of drying methods on the contents of phenolic acids in rape bee pollen
2.4 干燥方式對油菜蜂花粉抗氧化能力的影響
干燥方式對油菜蜂花粉抗氧化活性的影響如圖2所示,5 種干燥方式處理的油菜蜂花粉FRAP與新鮮油菜蜂花粉相比均顯著增加(P<0.05)。其中,真空脈動干燥油菜蜂花粉FRAP最強,FRAP為(1 961.11±4.42)mmol/g,比新鮮油菜蜂花粉提高了24.78%。干燥后油菜蜂花粉FRAP顯著提高,這是由于熱處理可能會破壞共價鍵,使細胞釋放出黃酮類、酚酸化合物和類胡蘿卜素等抗氧化劑[37]。
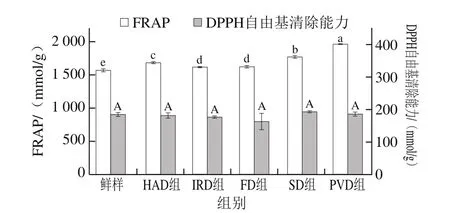
圖2 干燥方式對油菜蜂花粉抗氧化能力的影響Fig.2 Effects of drying methods on antioxidant activity of rape bee pollen
5 種干燥方式處理的油菜蜂花粉清除DPPH自由基的能力差異不顯著。相關研究表明酚酸的抗氧化活性隨著其羥基化程度的增加而增加[38]。而對香豆酸和香草酸作為油菜蜂花粉中主要的酚酸,它們的羥基化程度不高,均只有一個羥基,因此對香豆酸與香草酸在DPPH自由基溶液中給電子能力較弱,顯示出低的DPPH自由基清除能力,可能導致5 種干燥方式下油菜蜂花粉的DPPH自由基清除能力差異不顯著。其中,冷凍干燥的DPPH自由基清除能力最低(163.71±23.73)mmol/g,這可能是由于冷凍干燥處理過程中沒有高溫誘導引起的化學反應,酚類物質在反應過程中產生的各種衍生物有限,不能對DPPH自由基表現出更強的清除能力[13]。因此,油菜蜂花粉復雜的組分和抗氧化活性作用機理的不同導致了FRAP和DPPH自由基清除能力的差別。研究結果表明FRAP法可能更適合評價油菜蜂花粉的抗氧化活性。
2.5 主成分分析結果
基于酚酸化合物含量、色澤和抗氧化活性的實驗結果,對5 種不同干燥方式處理的油菜蜂花粉樣品進行主成分分析,觀察不同干燥方式下樣品的分布。主成分分析的得分圖和荷載圖如圖3所示,第一主成分(PC1)方差貢獻率為51.2%,第二主成分(PC2)方差貢獻率為23.6%,累積方差貢獻率達到74.8%。如圖3A所示,5 種干燥方式的樣品分別位于PCA得分圖的4 個象限。中短波紅外干燥蜂花粉位于PC1和PC2的分隔線上,熱風干燥蜂花粉分布于第二象限。熱風干燥與中短波紅外干燥有較好的聚集性,說明這兩種干燥方式下的油菜蜂花粉品質接近。自然晾曬樣品位于第一象限,真空脈動干燥樣品位于第二象限,除了一個冷凍干燥樣品外,大多數冷凍干燥樣品位于第三象限。結合酚酸化合物含量、色澤和抗氧化活性的實驗結果可知,真空脈動干燥油菜蜂花粉FRAP最強,L*值和對香豆酸含量較高,故真空脈動干燥樣品分布于PC2正向;自然晾曬油菜蜂花粉總色差較大,沒食子酸、香草酸、芥子酸含量較高,故自然晾曬樣品分布于PC1、PC2正向;冷凍干燥油菜蜂花粉綠原酸含量最高,故冷凍干燥樣品分布于PC2負向。綜上,結合色澤、酚酸含量和抗氧化活性進行主成分分析能較好地區分不同干燥方式處理的油菜蜂花粉樣品。
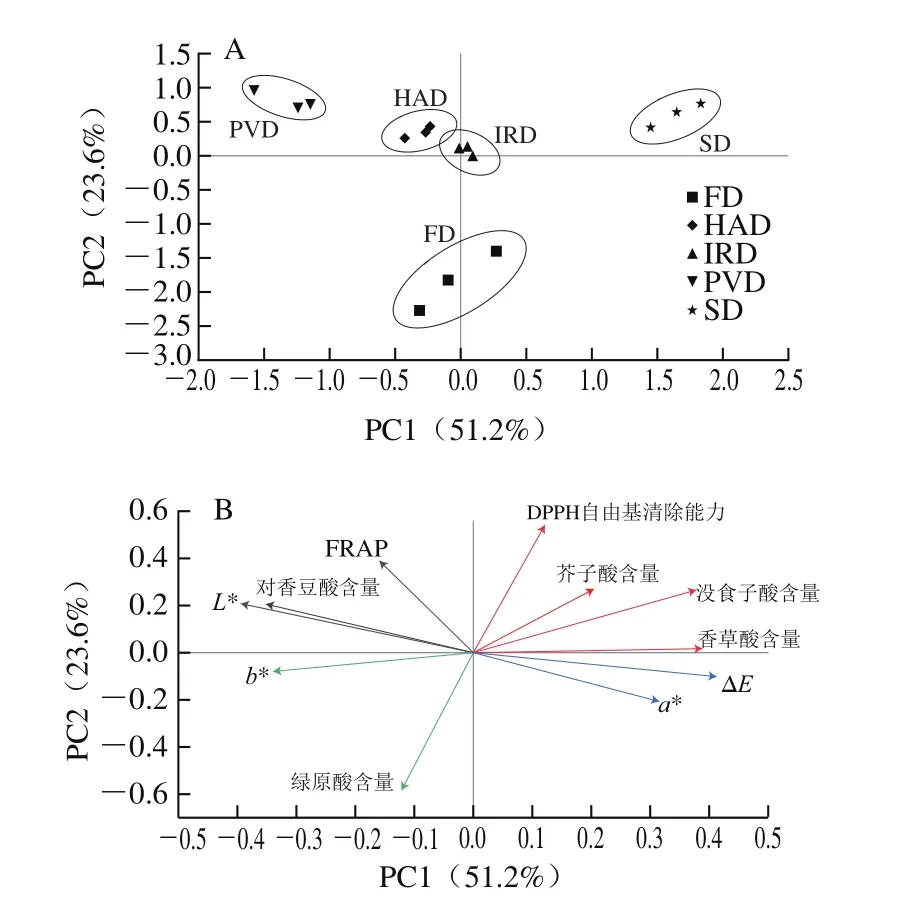
圖3 不同干燥方式的PCA得分圖(A)和荷載圖(B)Fig.3 PCA score plot (A) and loading plot (B) for discrimination of different drying methods
2.6 聚類分析結果
為了驗證主成分分析的結果,采用系統聚類法計算5 種不同干燥方式處理的油菜蜂花粉樣品之間的相似度。聚類分析結果如圖4所示,5 種不同干燥方式被分為3 類:第一類為真空脈動干燥、熱風干燥和中短波紅外干燥;第二類為冷凍干燥;第三類為自然晾曬。其中自然晾曬與其他4 種干燥方式差異最大,相似度為0;冷凍干燥與真空脈動干燥、熱風干燥和中短波紅外干燥的相似度為47.84%,這是由于冷凍干燥的低溫環境與其他3 種熱干燥(45 ℃)有較大的區別;真空脈動干燥與熱風干燥、中短波紅外干燥相似度為61.83%,這是因為真空脈動干燥為變壓(常壓和負壓脈動循環)干燥,而熱風干燥與中短波紅外干燥為常壓干燥;熱風干燥與中短波紅外干燥這兩種干燥方式之間由于干燥溫度相同,并且均為常壓干燥,故相似度較高,達84.11%。聚類分析結果與主成分分析結果相似,同時也綜合體現了5 種干燥方式之間的差異性。
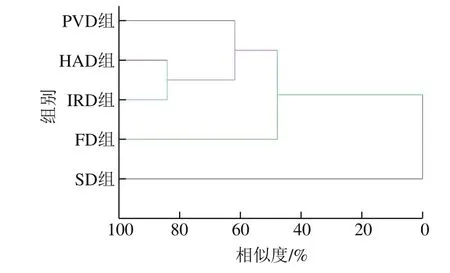
圖4 不同干燥方式的聚類分析Fig.4 Clustering analysis of different drying methods
2.7 相關性分析結果
采用皮爾森雙尾檢驗,對5 種干燥方式處理下的干燥油菜蜂花粉樣品的酚酸化合物含量、色澤參數和抗氧化活性進行相關性分析。相關性分析結果如圖5所示。其中酚酸化合物含量之間存在相關性,芥子酸、沒食子酸含量分別與香草酸含量呈極顯著正相關(P<0.01)。油菜蜂花粉在干燥后的色澤變化與酚酸化合物含量有關。沒食子酸含量與油菜蜂花粉總色差顯著正相關(P<0.05),香草酸含量與總色差極顯著正相關(P<0.01);沒食子酸、香草酸含量與L*值極顯著負相關(P<0.01),與b*值顯著負相關(P<0.05);對香豆酸含量與總色差顯著負相關,與L*值顯著正相關(P<0.05);芥子酸含量與a*值極顯著負相關(P<0.05);沒食子酸、香草酸含量與b*值呈顯著負相關(P<0.05)。但是,DPPH法和FRAP法測定的抗氧化活性與酚酸化合物之間在統計學上無顯著的相關性(P>0.05),這可能是由于除酚酸之外,干燥過程中生成的美拉德反應產物可提高抗氧化活性[34]。此外,Imeh等[39]在不同品種的蘋果和梨的研究中發現,除了多酚以外的其他因素(如β-胡蘿卜素)也有助于提高總抗氧化活性。
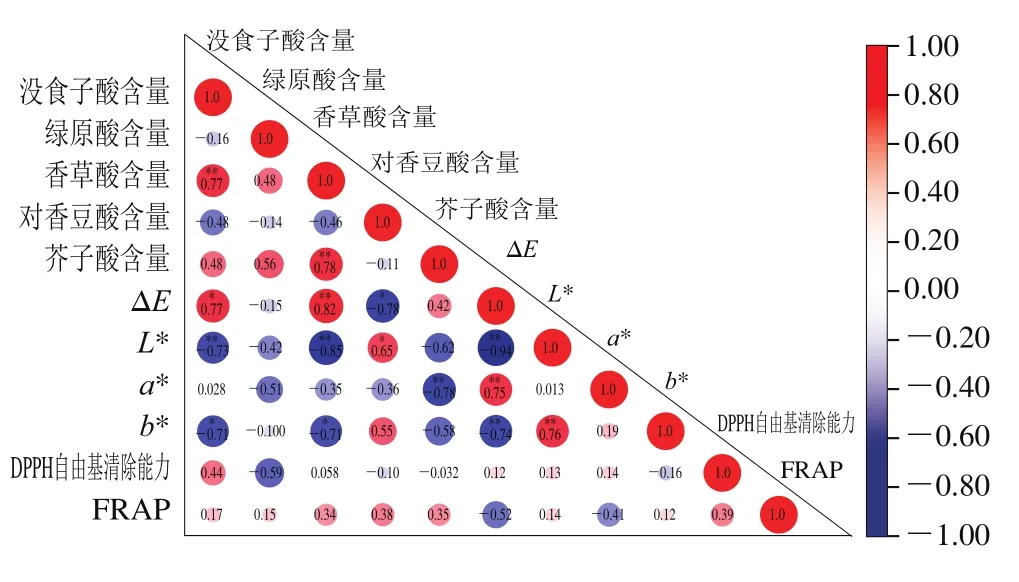
圖5 不同干燥方式處理下油菜蜂花粉色澤、酚酸化合物含量及抗氧化活性的相關系數熱圖Fig.5 Heatmap for Pearson’s correlation coefficients between color,phenolic acid contents and antioxidant activity of rape bee pollen subjected to different drying methods
3 結 論
本實驗探究了不同干燥方式對油菜蜂花粉的干燥動力學、色澤、酚酸化合物含量、抗氧化活性和微觀結構的影響。中短波紅外干燥導致其細胞表面破裂,促進細胞內部水分擴散;自然晾曬耗時最長,色澤劣變最嚴重,并且干燥過程導致油菜蜂花粉受到了微生物污染;真空脈動干燥油菜蜂花粉色澤保持最好,與所有其他干燥樣品相比,真空脈動干燥處理的油菜蜂花粉FRAP顯著增加(P<0.05)。與新鮮油菜蜂花粉相比,所有干燥方式處理下的油菜蜂花粉的沒食子酸含量增加,綠原酸、香草酸和芥子酸含量顯著增加(P<0.05)。通過對色澤、酚酸含量和抗氧化活性進行主成分和聚類分析,較好地區分了不同干燥方式處理的油菜蜂花粉樣品。相關性分析結果顯示,香草酸含量分別與芥子酸含量和沒食子酸含量呈極顯著正相關(P<0.01);對香豆酸含量與總色差顯著負相關,而與L*值顯著正相關(P<0.05)。本研究為蜂花粉干燥工藝的選擇及品質調控提供了理論依據和實驗參考。

