miR-133b靶向調控FOXL2對COV434細胞遷移增殖的影響
孫樹棟 劉俊 蘇薇潔
人類FOXL2是一個單外顯子基因,長度約為2 700 bp,定位于3q23區域,其編碼的蛋白包含1個forkhaed DNA結合區,此結合區含有101個氨基酸,主要表達于發育的眼瞼、胎兒的卵巢顆粒細胞及成人的卵巢[1-2]。小瞼裂綜合征(Blepharophimosis Syndrome,BPES)是一種以眼瞼異常為主要表現的先天性疾病,主要表現為上瞼下垂、瞼裂狹小、反向型內眥贅皮、內眥間距增寬,是一種常見的常染色體顯性遺傳病。FOXL2最早作為BPES的致病基因被克隆定位,同時也是部分卵巢早衰(Premature ovarian failure,POF)患者的致病基因。大量研究表明,部分BPES患者中存在FOXL2的基因突變;進一步研究發現,FOXL2基因作為人類常染色體基因,不僅僅參與了BPES的發生發展,還在類固醇代謝、子宮內膜的發育、抑制卵巢顆粒細胞分化過程中發揮作用[3-4],其生物學效應亦表現在卵巢周期性發育及其功能維持上[5]。FOXL2是首次被發現的脊椎動物中標記卵巢分化的性別雙態性指示物,也是最早被發現的在影響卵巢發育及保持卵巢功能穩定方面發揮重要作用的基因。
miRNA是生物體高度保守的非編碼小分子RNA,長度約為17~26 bp,其作用靶點為目的基因3′UTR區域,與此區域結合后通過發揮生物學效應(即基因沉默[6])在基因轉錄水平上負向調控其表達[7]。主要作用方式為降解目的基因的miRNA或抑制目的基因翻譯。生物信息學研究表明,人類可能有超過90%的基因受到miRNA的調控,幾乎參與了調控人類生長發育的各個階段。目前,miRNA對基因的調控功能以及FOXL2在卵巢顆粒細胞分化和卵巢發育中的作用已基本明確;同時,miR-133b能對FOXL2產生靶向調控作用。但是,關于miR-133b通過調控FOXL2基因的表達,繼而影響卵巢顆粒細胞腫瘤(Granulosacell tumor,GCT)的發生發展的研究較少。因此,本試驗通過建立用Lipofectamine 3000分別瞬時轉染miR-133bmimics及NC mimics的高轉染效率模型,探索miR-133b對人卵巢顆粒腫瘤細胞(COV434)中的FOXL2 基因進行靶向調控的作用,及其對COV434細胞遷移增殖的影響。
1 材料和方法
1.1 材料
COV434細胞株(武漢普諾賽生命科技有限公司);Lipofectamine 3000 Reagent、DMEM培養液、MTT細胞增殖檢測試劑、Opti-MEM ReducedSerum Medium、牛血清(GIBCO公司,美國);MiR-133bmimics(英濰捷基貿易有限公司);RIPA裂解液(北京索萊寶科技有限公司);逆轉錄試劑盒和RT-PCR試劑(TaKaRa公司,日本);BCA 蛋白定量試劑盒(博士德生物有限公司);0.05% Trypsin-EDTA (華美生物工程公司);Western blot試驗所用抗體、內參(英格恩生物技術公司);本試驗相關引物由生工生物工程(上海)有限公司合成。
1.2 方法
1.2.1 COV434細胞培養
將人COV434細胞株接種于含10%胎牛血清的L-DMEM 培養基中,置于5%CO2、37 ℃、飽和濕度的恒溫培養箱中培養。每48 h應用0.05% Trypsin-EDTA消化傳代1次。本試驗選用的COV434細胞均處于指數生長期。
1.2.2 細胞轉染
試驗分為miR-133b轉染組(COV434細胞轉染miR-133bmimics)、空白對照組(COV434細胞無任何轉染)、陰性對照組(COV434細胞轉染NC mimics)。轉染前24 h將COV434細胞接種于6孔板中,接種濃度為3×105/mL,然后根據Lipofectamine 3000轉染說明書,配制轉染液,將轉染液對應加入到miR-133b轉染組及陰性對照組,加液同時晃動培養板,充分混勻后,置于5%CO2、37 ℃、飽和濕度的培養箱中孵育培養12 h,熒光倒置顯微鏡下觀察轉染效率。
1.2.3 生物信息學預測
通過miRNA 靶基因預測網站(http://www.targetscan.org/vert_72/)預測miR-133b是否作用于靶基因FOXL2。
1.2.4 實時熒光定量PCR檢測
根據FOXL2生物信息設計引物,具體引物序列見表1。轉染48 h后收集每孔中的COV434細胞,抽提細胞總RNA,抽提方式為Trizol法,抽提產物檢測后,進行逆轉錄反應,cDNA模板為逆轉錄反應所得產物,內參對照為GAPDH,PCR擴增體系為25 μl。按98 ℃ 5 min,98 ℃ 30 s,60 ℃ 30 s,68 ℃ 30 s,設置40個循環,在熒光定量PCR儀中進行擴增。PCR擴增結束后,測算不同組的FOXL2mRNA相對表達量,計算方法為2-ΔΔCt。

表1 實時熒光定量PCR所用引物序列Table 1 Primer sequences of real-time PCR
1.2.5 Western blot檢測目的蛋白
轉染成功48 h后,用RIPA裂解液裂解COV434細胞,抽提細胞總蛋白,測定各孔細胞的蛋白濃度,一抗孵育(FOXL2和GAPDH),加入封閉液后搖床過夜;洗膜,加入二抗,搖床中孵育1 h。使用Image J軟件對條帶的灰度值進行計算并統計分析,使用目的蛋白FOXL2的灰度值除以內參GAPDH的灰度值,以校正誤差,所得結果為目的蛋白FOXL2的相對表達水平。
1.2.6 細胞遷移能力檢測
接種轉染COV434細胞24 h后,利用200 μL無菌槍頭垂直于孔板設計劃痕,PBS漂洗細胞3次,放入37 ℃、5%CO2培養箱中培養,依次觀察0 h、24 h的細胞遷移情況,使用Image J軟件隨機劃取6~8條水平線測定細胞平均遷移距離。
1.2.7 MTT法檢測細胞增殖情況
將COV434細胞接種于96孔板,每組4~5個復孔,按轉染說明分別對miR-133b轉染組及陰性對照組轉染miR-133bmimics、NC mimics,轉染成功后,每孔內加入20 μL MTT(5 mol/L),培育4 h,移除孔內培養液,加入150 μL二甲基亞砜,繼續培育4 h,使結晶物充分溶解。取出96孔板,將其置于酶聯免疫檢測儀上,震蕩15 s,然后在490 nm下測量光密度值(OD),繪制增殖曲線并計算細胞增殖率。細胞增殖率=miR-133b轉染組OD值/陰性對照組OD值×100%。
1.2.8 統計學分析
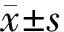
2 結果
2.1 COV434細胞轉染結果
熒光顯微鏡下,轉染12 h后2種質粒逐漸出現比較清晰的紅色熒光,其數量隨時間而增長,48 h后達到峰值(圖1)。

圖1 miR-133b轉染COV434細胞后12 h、48 h的熒光表達情況Fig.1 Fluorescence expression of miR-133b after transfection of COV434 cells at 12 h and 48 h
2.2 預測miR-133b作用于靶基因FOXL2的結果
預測分析結果顯示,miR-133b在FOXL2 的3′UTR 區域存在2個結合位點,miR-133b與FOXL2的互補序列如圖2所示。

圖2 miR-133b作用于FOXL2的預測結果Fig.2 Bioinformatics predicted whether miR-133b acted on the FOXL2 gene
2.3 熒光定量PCR檢測結果
如圖3所示,陰性對照組與空白對照組比較,FOXL2mRNA的表達無統計學差異(P>0.05);miR-133b轉染組與空白對照組、陰性對照組比較,FOXL2mRNA的表達均有顯著差異(P<0.05)。
2.4 Western Blot 檢測結果
圖4顯示,陰性對照組與空白對照組相比,FOXL2蛋白的表達量無明顯下降,差異無統計學意義(P>0.05)。miR-133b轉染組與空白對照組相比,FOXL2 蛋白的表達量下降40.3%;miR-133b轉染組與陰性對照組相比,FOXL2 蛋白的表達量下降36.8%,差異均具有統計學意義(P<0.05)。

*:與miR-133b轉染組相比,P<0.05。*: Compared with miR-133b transfection group, P<0.05.圖3 RT-PCR檢測miR-133b轉染COV434后FOXL2 mRNA的表達Fig.3 RT-PCR detection of FOXL2 mRNA expression after miR-133b transfected to COV434

A:Western blot結果;B:半定量分析;*:與miR-133b轉染組相比,P<0.05。A: Results of Western blot; B: Semi-quantitative analysis; *: Compared with miR-133b transfection group, P<0.05.圖4 Western blot法檢測miR-133b轉染COV434后FOXL2的蛋白水平Fig.4 Western blot detection of the FOXL2 expression after miR-133b transfected to COV434
2.5 細胞遷移能力比較
圖5表明,空白對照組24 h細胞遷移距離為(16.482 4±1.485 2)dmm,陰性對照組為(17.251 9±1.234 6)dmm、miR-133b組為(11.601 8±1.115 9)dmm。miR-133b轉染組24 h的COV434細胞遷移距離均短于空白對照組及陰性對照組(P<0.05),陰性對照組與空白對照組比較,則無統計學差異(P>0.05)。
2.6 MTT法檢測細胞增殖
MTT法檢測結果(圖6)顯示,陰性對照組與空白對照組相比,COV434細胞增殖能力無顯著變化,兩組間差異無統計學意義(P>0.05);miR-133b轉染組COV434細胞的增殖明顯受到抑制,48 h后增殖能力下降明顯,與空白對照組及陰性對照組相比差異顯著(P<0.05)。

A:劃痕試驗結果(10×);B:細胞遷移距離分析;*:與miR-133b轉染組相比,P<0.05。A: Results of scratch test (×10); B: Cell migration distance analysis; *: Compared with miR-133b transfection group, P<0.05.圖5 miR-133b轉染COV434后的細胞遷移情況Fig.5 Cell migration after miR-133b transfected to COV434

*:與miR-133b轉染組相比,P<0.05。*: Compared with miR-133b transfection group, P<0.05.圖6 MTT法檢測miR-133b轉染COV434細胞的增殖情況Fig.6 MTT detection of the cell proliferation after miR-133b transfected to COV434
3 討論
miRNA是一類由內源基因編碼的小分子RNA,在多種先天性及后天性疾病中均可發揮生物學效應,主要作用方式為調控基因表達,但目前尚未發現其調控基因表達的能力與其來源之間的明確的相關性[8]。miRNA調控機制復雜,且調控范圍較廣,與細胞增殖分化、細胞凋亡、脂肪代謝等各種生物學進程相關,可以調控體內大部分編碼基因。研究顯示,miRNA參與了多種惡性腫瘤的發生發展,其中有多種miRNA參與了生殖系統惡性腫瘤的發育調控[9-11]。研究表明,miR-133b在部分胃癌、肺癌組織中的表達下調,過表達的miR-133b能夠顯著抑制這些腫瘤細胞的增殖、轉移及侵襲[12-13]。然而,Qin等[14]發現,miR-133b在宮頸癌的發生發展中起到促進作用,可通過調控宮頸癌細胞的增殖引起宮頸癌的浸潤轉移。與之相反的是,Liu等[15]的研究顯示,過表達的FOXL2基因可能表現為一種抑癌基因,通過靶向調控來抑制宮頸癌的增殖、轉移及侵襲。Wang等[16]研究顯示,在miR-30家族中,絕大部分成員均能發揮對FOXL2的調控作用,其中miR-30a對FOXL2表達的調控主要起抑制作用。在卵巢顆粒腫瘤細胞系中,與對照組相比,同樣在miR-30a的干預下,Ago2基因敲除組卻能使目的基因FOXL2的表達顯著上調,可以推測Ago2基因可能是miR-30a的作用靶點。由此可見,miRNA作為FOXL2 的重要調控因子,其調控方式及對象均呈現多樣性。
卵巢性索-間質腫瘤又稱性腺間質腫瘤,在育齡期以及絕經后女性中多發,具有惡性程度低、晚期易復發等特點,以卵巢顆粒細胞腫瘤(Granulosa cell tumor,GCT)最為常見。2014年,世界衛生組織(World Health Organization,WHO)將卵巢GCT分為成年型和幼年型。成年型表現為因子宮內膜的病理性變化而導致的月經紊亂,幼年型主要表現為雌激素水平失衡引起的性早熟。研究表明,在成年型卵巢GCT的諸多致病機制中,FOXL2基因的部分堿基突變是重要的非獨立致病因素[17-19]。FOXL2基因突變引發一系列的轉錄、編碼、翻譯的改變,使得重要的細胞通路TNF-β通路表達下調,繼而誘導卵巢GCT的發生并促進其發展[20]。Kim等[21]研究發現,在卵巢GCT中,突變型FOXL2基因在腫瘤細胞調亡的進程中不能發揮調控誘導作用,因此推測FOXL2基因突變作為重要致病機制,在卵巢GCT的發病進程中發揮重要作用。Pierini等[22]以FOXL2作為卵巢GCT免疫治療的靶向標志物,將FOXL2cDNA與破傷風毒素的免疫增強域融合來開發質粒DNA疫苗,延緩了小鼠腫瘤的進展,且不影響小鼠的生殖功能。對FOXL2基因測序結果進行分析發現,在成年型卵巢GCT患者中,不但存在諸如C.402C→G突變等個別的堿基突變,還出現了FOXL2 DNA錯配修復等一系列DNA編輯缺陷[23],由此可見,在卵巢GCT發生發展的進程中,FOXL2基因突變不是獨立因素。Dai等[24]的研究表明,miR-133b與卵巢顆粒細胞中FOXL2介導的雌二醇釋放之間存在直接聯系,miR-133b參與了促卵泡激素誘導的雌激素產生,miR-133b通過直接靶向3'UTR來下調顆粒細胞中FOXL2的表達,從而抑制FOXL2介導的StAR和CYP19A1的轉錄抑制,進而促進雌二醇的產生。動物試驗證實,miR-383可通過抑制細胞周期蛋白cyclin D1、cyclin B、CDK1、CDK2、CDK4的表達,使得卵泡顆粒細胞在G0/G1期便出現細胞發育變慢甚至停滯,從而對卵泡顆粒細胞的發育增殖產生明顯的抑制作用[25]。FOXL2是卵巢顆粒細胞中的關鍵轉錄調節因子,ChIP-seq分析發現,FOXL2的結合位點位于與其靶基因距離較遠的非編碼區,而這些被調控的靶基因大部分參與了細胞的遷移與增殖,同時發現其靶基因Phactr1的表達下降,而Phactr1與肌動蛋白的細胞骨架動力學直接相關[26]。研究顯示,miR-133b在hela細胞中也存在明顯的生物學效應,可通過靶向調控FOXL2降低其mRNA表達,從而促進宮頸癌細胞的增殖[27]。但目前尚未有miR-133b在COV434細胞系中的研究報道。因此,本研究設計合成miRNA-133bmimics,瞬時轉染入COV434細胞中,研究miR-133b對FOXL2基因的表達調控。結果顯示,通過在COV434細胞系中過表達miR-133b,能夠靶向抑制人卵巢顆粒腫瘤細胞中FOXL2的表達,FOXL2mRNA和蛋白的表達量顯著下降,充分佐證了miR-133b在FOXL2基因調控中發揮的重要作用。
BPES主要表現為先天性眼瞼發育異常,可分為兩型:Ⅰ型患者同時伴有卵巢功能早衰,Ⅱ型患者僅有眼瞼畸形。隨著對BPES基因學研究的不斷深入,FOXL2基因已經被確定為BPES的致病基因。BPES患者的FOXL2基因出現了大量的移碼突變、錯意突變等基因突變[28],但仍有部分伴有卵巢功能早衰的Ⅰ型患者未發現FOXL2的突變,所以相關研究延伸到了FOXL2的功能及其調控機制方面。作為轉錄因子,FOXL2不僅對下游靶基因進行調控,同時其表達又受到上游STAT3的調控[29]。本實驗結果表明,在COV434中過表達的miR-133b通過高選擇性靶向調控,能夠顯著抑制FOXL2基因的表達,進而在抑制COV434細胞的增殖與遷移過程中發揮重要作用,揭示了miR-133b、FOXL2以及COV434細胞增殖遷移之間的關系,對明確BPES的發病機制以及卵巢GCT的發生發展具有重要的基礎研究價值。
miRNA無論在腫瘤的發生還是浸潤轉移過程中均扮演重要角色,其中一部分miRNA分子發揮促癌基因的作用,在促進腫瘤細胞增殖的同時加速腫瘤的浸潤轉移,而另一部分miRNA分子的作用恰恰相反,發揮著抑癌基因的作用[30-32],對腫瘤細胞增殖和浸潤轉移起到抑制作用,并能誘導腫瘤細胞凋亡,加速腫瘤的消失。FOXL2基因不僅參與了人類顱面部和卵巢的發育,在BPES及卵巢早衰的發生發展中也具有重要作用。本研究驗證了miR-133b作為調控因子能抑制FOXL2的表達,通過抑制其表達來抑制COV434細胞的遷移增殖。需要說明的是,miR-133b靶向調控FOXL2抑制COV434細胞增殖與遷移的具體作用機制,以及miR-133b在GCT和其他類型惡性腫瘤中的功能,仍需進一步探索。

