益氣活血解毒中藥調控VEGF通路抑制單側輸尿管結扎大鼠對側腎臟淋巴管生成的研究
高曉萌,趙綺悅,劉子騫,劉令今,陳格格,郝 娟,王香婷,2,3,許慶友,2,3*
1河北中醫學院研究生學院;2河北省中西醫結合肝腎病證研究重點實驗室;3河北中醫學院中西醫結合學院,石家莊 050091
近年來,慢性腎臟病(chronic kidney disease,CKD)發病率明顯增高,依據國家及人種不同為7%~12% ,其中中國的發病率為10.8%[1]。就CKD病因而言,單側梗阻性腎臟損傷持續進展可以導致慢性腎衰竭的發生,其病理改變是腎間質纖維化(renal interstitial fibrosis,RIF)[2]。益氣活血解毒中藥是在總結國家級名老中醫趙玉庸教授治療腎臟病的經驗基礎上,結合腎臟病理改變及炎癥損傷機制,采用黃芪15 g、茯苓10 g、芍藥12 g、地龍6 g、僵蠶6 g、黃芩10 g、金銀花10 g、大黃6 g組成,具有補虛扶正、解毒通絡的作用,用于慢性腎臟病的治療獲得滿意的臨床效果。動物實驗研究證實益氣活血解毒中藥可以抑制氧化應激、炎癥損傷等途徑減輕梗阻性腎病損傷,還可以調控自噬等途徑減輕對側腎臟的損傷[3-5]。本研究發現益氣活血解毒中藥可以調控VEGF途徑,抑制單側輸尿管梗阻(unilateral ureteral obstruction,UUO)大鼠對側腎臟淋巴管生成,減緩腎臟病進展。本研究采用UUO制備梗阻性腎病實驗動物模型,給予益氣活血解毒中藥及醛固酮受體阻斷劑依普利酮治療,觀察鈉氯協同轉運蛋白(Na+-Cl-cotransporter,NCC)、血管內皮生成因子C(vascular endothelial growth factor C,VEGF-C)、血管內皮生長因子受體-3(vascular endothelial growth factor receptor-3,VEGFR-3)、淋巴管內皮透明質酸受體(lymphatic vessel endothelial hyaluronic acid receptor-1,LYVE-1)、平足蛋白(podoplanin,PDPN)等淋巴管新生相關指標以及α-平滑肌肌動蛋白(alpha-smooth muscle actin,α-SMA)、波形蛋白(vimentin)等細胞表型轉化指標的表達,探討梗阻性腎病大鼠對側腎臟淋巴管新生并參與腎間質纖維化的通路以及中藥的保護機制。
1 材料與方法
1.1 動物及分組
清潔級雄性Wistar大鼠40只,7周齡,體重200±20 g,購買于河北醫科大學實驗動物中心,動物生產許可證號:SCXK(冀)2018-004。按照體質量對大鼠進行編號,根據隨機數字表隨機分為假手術組(Sham)、單側輸尿管結扎組(UUO)、依普利酮治療組(EPL)和中藥治療組(TCM),每組10只。購買后于河北中醫學院動物室適應性飼養一周,動物使用許可證號:SYXK(冀)2017-005,光照時間為7∶00~18∶00。自由飲食,環境溫度24±1 ℃,濕度55%±5%。
1.2 儀器和設備
RM2245型石蠟切片機(德國Leica公司);CTS SP8激光共聚焦掃描顯微鏡(德國Leica公司);ODYSSEY雙色紅外激光成像掃描儀(美國LICOR公司);DYY-12C型電泳儀及電泳槽(北京六一儀器廠);半干轉膜儀(美國 BIO-RAD公司);臺式高速冷凍離心機(上海力申儀器公司),VANOX DM-10AD型顯微照相儀(日本OLYMPUS株式會社)。
1.3 藥物與試劑
依普利酮飼料,美國Pfizer公司產品,輝瑞公司提供原粉,由日本Research Diets Inc公司根據動物的進食量與藥物用量100 mg/kg/d按1.25 g/kg加入飼料中,折合成大鼠藥物用量為100 mg/kg/d[6,7];益氣活血解毒中藥(組成:黃芪2 袋、茯苓2袋、芍藥2袋、地龍1袋、僵蠶1袋、黃芩2袋、金銀花2袋、大黃1袋)由廣東一方制藥有限公司提供中藥配方顆粒,規格為每袋裝2.0 g,相當于臨床使用量飲片10 g。按比例混勻煎煮15 min,水煎液含生藥0.43 kg/L,參照徐叔云《藥理實驗方法學》折合大鼠用量為14 g/kg/d給藥。NCC抗體(Abcam公司,批號GR3274565-3);VEGF-C抗體(Immunoway公司,批號YT5297);VEGFR-3抗體(Immunoway公司,批號YT5878);LYVE-1抗體(Novus公司,批號1808R01);PDPN抗體(Bioss公司,批號AD06234578);Vimentin抗體(Abcam公司,GR3186827-16);α-SMA抗體(Abcam公司,批號GR3252482-10);GAPDH抗體(Epitomics公司,批號Y123103P);β-actin抗體(Abcam公司,批號GR305367-39)。
1.4 造模方法及給藥
實驗動物適應性喂養1周后,UUO組、EPL組和TCM組采用結扎單側輸尿管方法復制梗阻性腎病模型,異氟烷吸入麻醉后,于左側中腹部切開皮膚,游離左側輸尿管,在輸尿管上1/3處用絲線結扎,切斷輸尿管,逐層縫合皮膚;Sham組僅游離輸尿管但不結扎。術后1天開始給藥,EPL組給予依普利酮100 mg/kg/d加入飼料中喂養,TCM組化瘀解毒中藥煎劑14 g/kg/d灌胃,Sham組和UUO組給予等量普通飼料。10天后,異氟烷吸入麻醉,股動脈取血,摘取對側腎臟(右側腎臟),沿縱軸切開,部分組織4%多聚甲醛中固定、石蠟包埋,切片行常規HE、Masson及免疫組化染色;部分組織OCT包埋,切片行常規免疫熒光染色;剩余組織-80 ℃保存備用,用于分子生物學檢測。
1.5 指標檢測方法
1.5.1 HE、Masson染色觀察腎臟纖維化改變
HE染色:將石蠟切片置于二甲苯脫蠟,梯度乙醇復水至蒸餾水;PBS清洗,蘇木精滴染5 min;PBS清洗,伊紅復染3 min,蒸餾水稍洗30 s,常規乙醇梯度脫水、二甲苯透明后,中性樹膠封固。光學顯微鏡觀察細胞形態。
Masson染色:將石蠟切片置于二甲苯脫蠟,梯度乙醇復水至蒸餾水;PBS清洗,蘇木精滴染5 min;PBS清洗,Masson麗春紅酸性復紅液復染5 min,2%冰醋酸水溶液浸洗片刻,1%磷鉬酸水溶液分化3~5 min,不經水洗,苯胺藍復染5 min,以0.2%冰醋酸浸染片刻,常規乙醇梯度脫水、二甲苯透明后,中性樹膠封固。光學顯微鏡觀察膠原表達。
1.5.2 免疫熒光法檢測NCC、LYVE-1、VEGF-C、VEGFR-3、α-SMA、Vimentin的表達
將冰凍切片用PBS沖洗3次,加入0.01 mol枸木緣酸緩沖液(PH6.0)進行抗原修復;滴加10%山羊血清,室溫孵育1 h;傾倒多余的山羊血清,滴加一抗(濃度為1∶100),4 ℃過夜;PBS清洗,滴加二抗(避光),37 ℃恒溫水浴箱內孵育1 h;滴加DAPI液(避光)室溫孵育10 min;滴加抗熒光衰減封片劑(避光)封片。
1.5.3 免疫組化法檢測LYVE-1、PDPN、VEGF-C、α-SMA、Vimentin的表達
采用免疫組化法觀察腎組織中LYVE-1、PDPN、VEGF-C、α-SMA、Vimentin的表達,石蠟切片脫蠟入水,修復抗原后加入一抗,4 ℃過夜;PBS清洗3次,每次5 min,滴加生物素標記的二抗,37 ℃孵育30 min,同上清洗3次,滴加辣根過氧化物酶標記鏈酶卵白素工作液,37 ℃孵育30 min,同上清洗3次,DAB顯色3~5 min,自來水充分沖洗,終止顯色;蘇木精復染,脫水,透明,封片。顯微鏡下觀察蛋白表達的位置及染色強弱,以鏡下出現棕黃色為陽性表達,同時以PBS替代二抗作為陰性對照。
1.5.4 Western blot檢測NCC、VEGF-C、VEGFR-3、α-SMA的表達
取新鮮腎臟組織100 mg,用預冷的生理鹽水沖洗,加入含蛋白酶及磷酸酶抑制劑的裂解液400 μL,勻漿取上清,測蛋白濃度后,根據檢測指標以20~50 μg樣品進行電泳,電泳后轉膜,5%脫脂牛奶封閉,加入一抗NCC、VEGF-C、VEGFR-3、α-SMA(1∶500~1∶1 000),4 ℃過夜,清洗,室溫孵育二抗(1∶20 000),洗掉多余二抗后Odyssey紅外顯影儀掃描顯影,與所得內參進行比較。
1.6 統計學方法
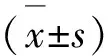
2 結果
2.1 腎臟組織病理學改變
由圖1HE染色結果可知:Sham組大鼠腎臟結構未見明顯異常,腎間質少量炎性細胞浸潤,腎小管無擴張;UUO組可見間質出現水腫情況,較多炎性細胞浸潤,部分腎小管上皮細胞空泡變性或出現壞死脫落,腎小球未見明顯病變;EPL組及TCM組腎臟損傷較UUO組輕微。Masson結果顯示:Sham組腎間質僅有少量纖維成分,結構清晰;UUO組腎間質膠原成分增多;EPL組及TCM組與UUO組比較,腎間質膠原成分有所減少。
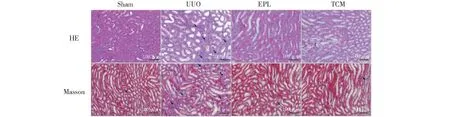
圖1 HE、Masson染色觀察UUO大鼠對側腎組織病理改變Fig.1 The pathomorphology of contralateral kidney of UUO rats by HE and Masson staining (Scale bar=100 μm)
2.2 免疫組化法檢測α-SMA、Vimentin的表達
免疫組化法顯示Sham組α-SMA及Vimentin僅表達于血管,腎間質及上皮細胞表達較少;UUO組表達明顯增強,腎間質及上皮細胞可見到陽性表達;EPL組及TCM組α-SMA、Vimentin局部呈中度表達,間質可見少量表達,較UUO組明顯減弱(見圖2)。
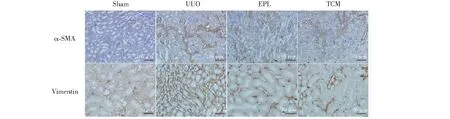
圖2 免疫組化染色檢測UUO大鼠對側腎組織α-SMA、Vimentin的表達Fig.2 Expression of α-SMA and Vimentin in contralateral kidney of UUO rats with immunohistochemistry
2.3 免疫熒光法檢測NCC的表達
由圖3可知,NCC僅在Sham組對側腎臟的遠曲小管管腔親水側表達;UUO組大鼠對側腎臟NCC表達明顯增強;EPL組及TCM組表達范圍及強度較UUO組明顯減弱。
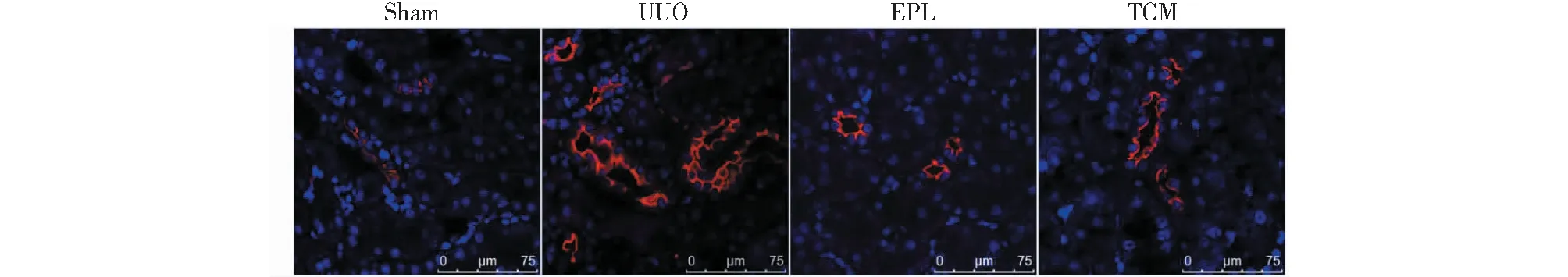
圖3 免疫熒光檢測UUO大鼠對側腎組織NCC表達Fig.3 Expression of NCC in contralateral kidney of UUO rats with immunofluorescence(Scale bar=75 μm)
2.4 免疫熒光及組化法檢測VEGF-C的表達
VEGF-C在Sham組大鼠對側腎臟表達較弱;在UUO組VEGF-C表達明顯增強,主要見于腎小管上皮細胞、腎間質細胞;EPL組及TCM組VEGF-C的表達較UUO組明顯減弱(見圖4)。
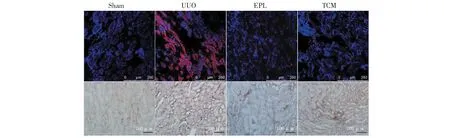
圖4 免疫熒光及免疫組化檢測UUO大鼠對側腎組織VEGF-C的表達Fig.4 Expression of VEGF-C in contralateral kidney of UUO rats with immunohistochemistry and immunofluorescence
2.5 免疫熒光及組化法檢測VEGFR-3、LYVE-1、PDPN的表達
VEGFR-3、LYVE-1、PDPN在Sham組大鼠對側腎臟表達較弱;在UUO組VEGFR-3、LYVE-1、PDPN表達明顯增強,主要見于對側腎臟血管周圍和腎小管間質;EPL組及TCM組VEGFR-3、LYVE-1、PDPN的表達較UUO組明顯減弱(見圖5)。
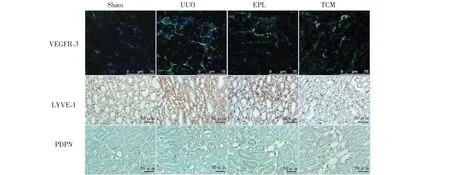
圖5 免疫熒光及免疫組化檢測UUO大鼠對側腎組織VEGFR-3、LYVE-1、PDPN的表達Fig.5 Expression of VEGFR-3,LYVE-1 and PDPN in contralateral kidney of UUO rats with immunohistochemistry or immunofluorescence
2.6 免疫熒光法檢測LYVE-1與α-SMA及Vimentin的表達
由圖6可知,免疫熒光染色及激光共聚焦顯微鏡觀察LYVE-1與α-SMA 共表達,結果顯示Sham組大鼠僅在對側腎臟血管周圍、腎小管間質有少量LYVE-1(綠色)表達;UUO組對側腎臟血管周圍及腎小管間質LYVE-1表達明顯增多,與α-SMA(紅色)表達相關并呈現共表達(黃色);EPL組及TCM組LYVE-1與α-SMA表達均較UUO組減弱。LYVE-1 與Vimentin的共染結果與α-SMA相似(見圖7)。
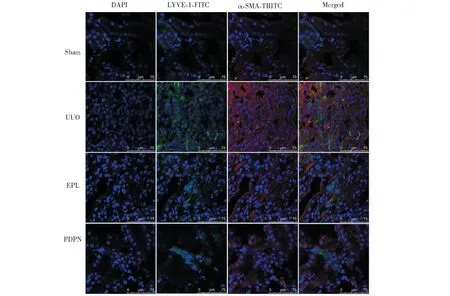
圖6 免疫熒光檢測大鼠腎組織LYVE-1與α-SMA表達Fig.6 Expression of LYVE-1 and α-SMA in UUO rats with immunofluorescence(Scale=75 μm)
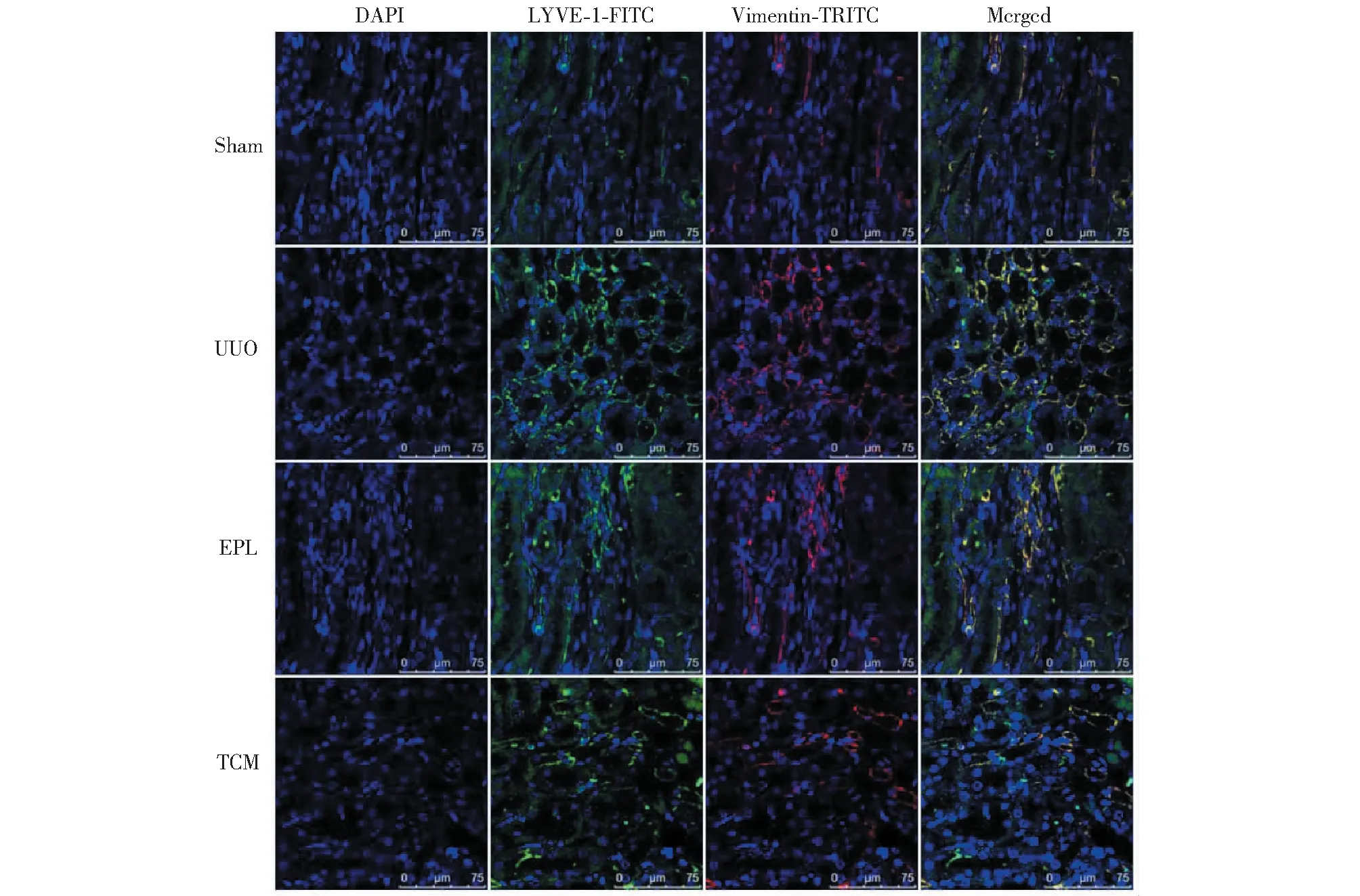
圖7 免疫熒光檢測大鼠腎組織LYVE-1與Vimentin表達Fig.7 Expression of LYVE-1 and Vimentin in UUO rats with immunofluorescence(Scale=75 μm)
2.7 Western blot檢測NCC、VEGF-C、VEGFR-3和α-SMA的表達
由圖8與表1可知,UUO組NCC、VEGF-C、VEGFR-3、α-SMA的表達均較Sham組顯著升高,差異有統計學意義(P<0.05);與UUO組相比,EPL組及TCM組NCC、VEGF-C、VEGFR-3、α-SMA的表達顯著降低,差異有統計學意義(P<0.05)。
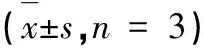
表1 UUO大鼠對側腎組織NCC、VEGF-C、VEGFR-3和α-SMA蛋白Western blot灰度相對比值Table 1 Western blot gray scale relative ratios of NCC,VEGF-C,VEGFR-3 andα-SMA in the contralateral kidney of UUO rats = 3)
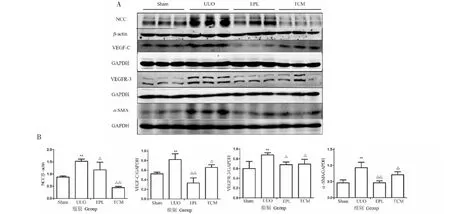
圖8 Western blot檢測UUO大鼠對側腎組織NCC、VEGF-C、VEGFR-3和α-SMA表達Fig.8 Expression of NCC,VEGF-C,VEGFR-3 and α-SMA in contralateral kidney of UUO rats with Western blot注:A:UUO大鼠對側腎組織NCC、VEGF-C、VEGFR-3和α-SMA 等蛋白Western blot數據;B:A中蛋白的灰度統計結果。與Sham組比較,*P<0.05,**P<0.01;與UUO組比較,△P<0.05,△△P<0.01。Note:A:Western blot data of proteins such as NCC,VEGF-C,VEGFR-3 and α-SMA in the contralateral kidney of UUO rats;B:Gray-scale statistical results of the protein in A.Compared with Sham,*P<0.05,**P<0.01;Compared with UUO,△P<0.05,△△P<0.01.
3 討論與結論
近年來,慢性腎臟病發病率明顯升高,現已成為全球關注的危害健康的公共性問題。依據流行病學資料,目前我國農村慢性腎臟病最為常見的原因是梗阻性腎病,其病理改變為腎間質纖維化[8]。我們的前期實驗表明細胞增殖、細胞焦亡、巨噬細胞的集聚及表型轉化參與對側腎臟的損傷,近期研究發現淋巴管新生也在對側腎臟纖維化過程中發揮著重要作用[9]。
在正常腎臟中,淋巴管僅分布在小葉間和弓形動脈周圍,皮質腎小管間質區域若無損傷也少有淋巴管分布。然而,在腎小管間質纖維化和炎性損傷區域,淋巴管生成明顯且管腔內充滿單核細胞,生成的數量與腎小管間質損傷程度有關[10,11]。目前公認的淋巴管標志物有:淋巴管透明質酸受體1(LYVE-1)、平足蛋白(PDPN)以及血管內皮細胞生長因子受體3(VEGFR-3)。LYVE-1是一種主要表達于淋巴管內皮細胞上的膜蛋白,廣泛分布在淋巴管內外腔面,參與淋巴管內皮細胞從組織攝取并轉運透明質酸鹽進入淋巴液的過程;PDPN是一種存在于腎小管膜上皮細胞上的黏液樣跨膜糖蛋白,主要表達在人腎足突細胞、肺Ⅰ型上皮細胞和成骨細胞以及淋巴管內皮細胞,但僅出現在小淋巴管;VEGFR-3屬于受體酪氨酸蛋白激酶家族的淋巴管內皮標志物,為血管內皮細胞生長因子VEGF-C的特異性受體,主要表達于淋巴管內皮細胞[12]。動物實驗表明,UUO術后10天,UUO組大鼠對側腎臟淋巴管內皮標志物LYVE-1、PDPN及VEGFR-3表達明顯增強,說明淋巴管生成出現較早;考慮到細胞表型轉化如腎小管上皮細胞、足細胞、血管內皮細胞等出現肌成纖維細胞樣轉化參與腎間質纖維化的形成[13],為了證實淋巴管內皮細胞是否存在類似改變,我們采用LYVE-1與細胞表型轉化標志物α-SMA及Vimentin共染。α-SMA在腎組織表達的高低可以間接反應肌成纖維細胞的數量,因此α-SMA被廣泛作為向肌成纖維細胞表型轉化的一項指標;Vimentin是上皮細胞向肌成纖維轉化過程中的產物,腎臟疾病時,Vimentin的表達程度與腎小管損傷情況相關,因此Vimentin是間質纖維化的間質細胞表達肌成纖維細胞的標志性蛋白[14]。結果顯示UUO組大鼠LYVE-1與α-SMA、Vimentin均呈現共表達,說明淋巴管內皮細胞發生肌成纖維細胞樣轉變,參與了梗阻性腎病對側腎臟纖維化的形成。
在眾多信號通路中,VEGF-C/VEGFR-3途徑是淋巴管生成最為關鍵的途徑[15]。VEGF有6個亞型,A、B、C、D和E,其中參與淋巴管新生的主要是C和D,腎小管上皮細胞等分泌VEGF-C和VEGF-D作用于淋巴管內皮的同源受體VEGFR-3,誘導淋巴管和血管的生成[16,17]。VEGFR-3是淋巴管內皮表達的酪氨酸激酶,是淋巴管的標志物,VEGF-C與VEGF-D均可與之結合刺激其表達,其中VEGF-C的作用更為明顯[18]。實驗結果證實,結扎大鼠單側輸尿管,對側腎臟VEGF-C表達明顯增強,與淋巴管內皮標志物LYVE-1、VEGFR-3、PDPN的表達呈同樣趨勢;抑制VEGF-C的分泌可以減少UUO大鼠腎臟淋巴管的生成、抑制炎癥損傷,減輕腎間質纖維化。
VEGF-C的過表達與組織水腫、缺血缺氧相關[19],水鈉潴留是引起缺血缺氧的常見因素,NCC過表達參與這一病理生理改變。NCC是鈉氯離子協同轉運蛋白,主要表達在遠端小管,其親水的核心部分位于腎小管管腔側,依據管腔與細胞間的鈉離子梯度差異,將鈉、氯離子共同運轉到小管細胞內[20]。醛固酮調節NCC的表達,可引起鈉氯離子吸收過多導致組織水腫、缺血缺氧,刺激腎小管上皮細胞等分泌VEGF-C,促進淋巴管新生[21-23]。
經過臨床驗證,中醫中藥在治療慢性腎臟病方面發揮著重要作用。慢性腎臟病屬于中醫水腫、尿血、尿濁等范疇,病至后期進展為癃閉、關格等,總歸脾腎虧虛、濕邪濁毒內蘊所致。根據“久病必虛”“久病必瘀”“久病入絡”的中醫理論,結合臨床實踐和現代研究,我們認為“虛、毒、瘀”是慢性腎臟病的基本病機,“虛為本,瘀為果,毒為兇”,因此擬定了益氣活血解毒中藥的治療。“整體觀念”是中醫學的基本特點,人體的各個組成部分之間生理上不可分割,病理上相互影響。腎臟病尤其是輸尿管梗阻引起的單側腎臟損傷,不僅影響自身,也可以影響對側,對側受損是導致慢性腎衰竭的重要因素,通過對“健側”腎臟的保護對于慢性腎病的治療具有臨床參考價值。
我們之前的研究已經證實,在長期實驗中,UUO大鼠對側腎臟出現巨噬細胞向成肌纖維細胞轉化,加重了對側腎臟的纖維化[24];在短期實驗中,UUO大鼠對側腎臟出現細胞增殖、細胞凋亡等現象,參與了對側腎損傷[9,25,26]。本實驗進一步證明,單側腎臟損傷后對側腎臟的改變與淋巴管生成有關,在梗阻后早期就發生了改變,盡管程度較輕,但隨著梗阻時間的延長,會出現明顯的纖維化改變。MR激活后,上調鈉氯離子協同轉運蛋白NCC的表達,導致水鈉潴留引起組織缺血缺氧,刺激腎小管上皮細胞分泌VEGF-C誘導淋巴管生成,增生的淋巴管內皮細胞發生表型轉化(α-SMA、Vimentin),參與間質纖維化形成。益氣活血解毒中藥可調控VEGF通路,下調LYVE-1、VEGFR-3、PDPN的表達,抑制淋巴管內皮細胞表型轉化,從而達到減輕腎間質纖維化的作用。
致謝:本實驗主要在河北省中西醫結合肝腎病證重點實驗室完成,在此對實驗室的各位老師及同學的幫助致以衷心的感謝!

