年齡對水合氯醛誘導的小鼠可逆性晶狀體混濁及Na+-K+-ATP酶表達的影響
秦 柏,張俊芳,楊 梅,吳劉萍,康麗華,張國偉,石海紅,管懷進
?KEYWORDS:lens opacity; chloral hydrate; age; Na+-K+-ATPase; mice
0引言
小鼠是眼科研究中最常用的實驗動物之一,很多眼科檢測需要將小鼠鎮靜麻醉后進行,但水合氯醛、戊巴比妥鈉、七氟醚等常用鎮靜麻醉劑均可引起小鼠急性可逆性晶狀體混濁,嚴重影響眼底照相、視覺電生理、光相干斷層掃描(OCT)等檢查的結果[1]。研究表明藥物、麻醉劑、溫度、供氧、鈣、pH值和脫水等多種因素均可影響小鼠晶狀體的透明度,但其具體機制尚不明確[2]。研究顯示Na+-K+-ATP酶在維持晶狀體的透明性中具有重要的作用,并參與糖皮質激素誘導的可逆性晶狀體混濁和糖尿病白內障[3-4]。本研究應用青年小鼠及老年小鼠,探討晶狀體年齡相關性改變對水合氯醛引起的小鼠可逆性晶狀體混濁的影響及可能機制。
1材料和方法
1.1材料
1.1.1實驗動物與分組3月齡雄性C57BL/6小鼠12只,體質量25~30g,設為青年組;24月齡雄性C57BL/6小鼠12只,體質量29~35g,設為老年組;小鼠均購自南通大學實驗動物中心。實驗期間小鼠飼養溫度23℃±2℃,相對濕度40%~70%,12h明暗交替照明,自由飲食飲水。本研究實驗動物的使用嚴格遵循《實驗動物管理條例》的規定。本研究通過南通大學實驗動物倫理委員會批準(批準號:20190926-001)。
1.1.2試劑和儀器水合氯醛和多聚甲醛(上海生物工程有限公司);兔抗小鼠Na+-K+-ATP酶多克隆抗體(美國abcam公司,ab76020),免疫組化顯色試劑盒(上海Gene Tech公司),裂隙燈顯微鏡(瑞士HAAG-STREIT BQ900)。
1.2方法
1.2.1水合氯醛誘導小鼠急性可逆性晶狀體混濁水合氯醛注射前10min,復方托吡卡胺滴眼液散瞳,裂隙燈顯微鏡觀察,排除眼前節和晶狀體異常小鼠。4%水合氯醛溶液(400mg/kg)腹腔注射,在注射后10、20、30、45、60、90、120min用裂隙燈觀察晶狀體混濁程度,并拍攝照片。觀察間隙,應用生理鹽水點眼,保持角膜濕潤,實驗過程中室溫保持23℃。
1.2.2晶狀體混濁程度分級水合氯醛注射后晶狀體的混濁程度評估參照Bermudez等[2]方法,并在其基礎上增加了晶狀體混濁消退評級。晶狀體混濁程度分為4個等級:無混濁(0級);輕度混濁(1級),晶狀體混濁僅限于晶狀體前縫(anterior lens suture)附近;中度混濁(2級),晶狀體混濁局限在前縫范圍內;重度混濁(3級),晶狀體前皮質全部混濁。晶狀體混濁消退程度分為3個等級:輕度消退(-1級),晶狀體中央及前縫混濁消退;中度消退(-2級),晶狀體混濁消退范圍局限在晶狀體前縫范圍內;完全消退(-3級),晶狀體混濁消退區域超過晶狀體前縫范圍至完全透明,見圖1。雙眼晶狀體混濁程度不一致時以混濁較為嚴重的眼記錄等級。
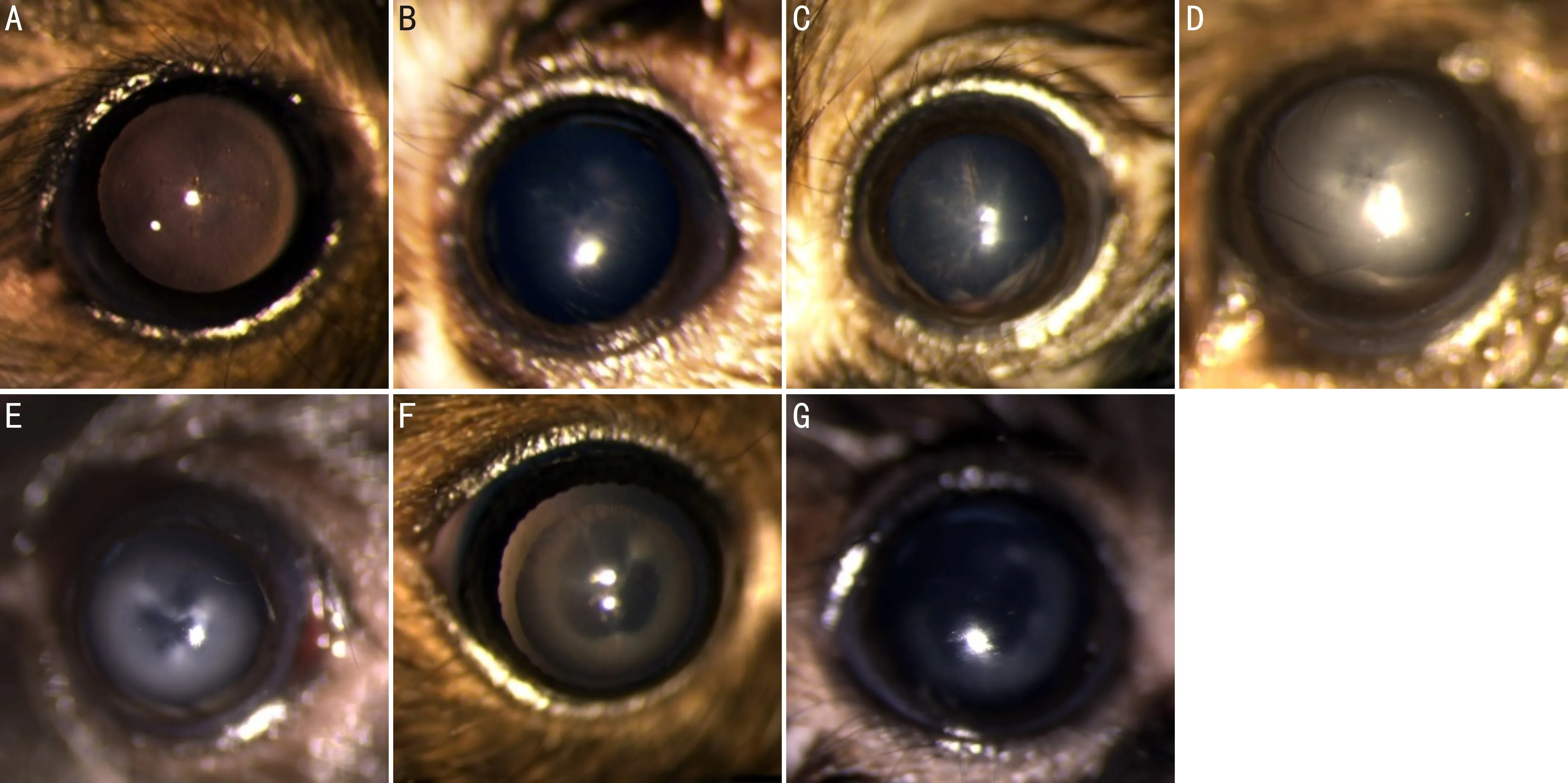
圖1 晶狀體混濁程度及消退分級 A:無混濁(0級);B:輕度混濁(1級);C:中度混濁(2級);D:重度混濁(3級);E:輕度消退(-1級);F:中度消退(-2級);G:重度消退(-3級)。
1.2.3晶狀體蘇木素-伊紅染色在水合氯醛注射前、注射后45min分別頸椎脫臼處死小鼠各2只,隨后立即摘取眼球,用Davidson固定液固定2h后,再經4%多聚甲醛溶液固定過夜,常規梯度酒精脫水、浸蠟、包埋,4μm厚度連續切片,二甲苯脫蠟,梯度酒精水化,蘇木素-伊紅(HE)染色,光學顯微鏡拍照。
1.2.4晶狀體Na+-K+-ATP酶免疫組織化學染色取水合氯醛注射前、注射后45min的小鼠眼球石蠟切片,經常規脫蠟、水化,檸檬酸鹽緩沖液煮沸10min進行抗原修復,PBS緩沖液洗3次,每次5min;體積分數3% H2O2溶液37℃孵育10min,阻斷內源性辣根過氧化物酶(HRP);PBS緩沖液洗3次,每次5min;滴加封閉液,37℃孵育2h;除去封閉液,滴加兔抗小鼠Na+-K+-ATP酶抗體(1∶100),4℃孵育過夜;室溫復溫2h,PBS緩沖液洗3次,每次5min;滴加HRP標記聚合物(二抗),37℃孵育30min;除去二抗,PBS緩沖液洗3次,每次5min;新鮮配置的DAB顯色1min,充分水洗;蘇木素復染,水洗;1%鹽酸酒精分化,水洗;梯度酒精脫水,二甲苯透明,自然干燥后中性樹膠封片。光學顯微鏡下觀察Na+-K+-ATP酶在晶狀體上皮細胞(lens epithelial cells, LECs)及纖維的表達并拍照。
2結果
2.1兩組小鼠對水合氯醛注射鎮靜的反應兩組小鼠水合氯醛腹腔注射后角膜反射消失,翻正反射消失,記錄為起效時間。翻正反射出現,開始出現步態移動,記錄為蘇醒時間。老年組小鼠體質量顯著高于青年組小鼠體質量,差異有統計學意義(t=9.6623,P<0.01),兩組小鼠水合氯醛注射的起效時間(t=0.8514,P>0.05)和蘇醒時間差異均無統計學差異意義(t=0.3933,P>0.05),見表1。
表1 兩組小鼠體質量、水合氯醛注射的起效和蘇醒時間
2.2兩組小鼠水合氯醛注射后晶狀體混濁和消退的進展兩組小鼠水合氯醛注射后均出現不同程度的晶狀體混濁。水合氯醛誘導的晶狀體混濁是從晶狀體前縫開始,逐漸向周圍擴散,最終導致整個晶狀體前皮質淺層混濁。晶狀體混濁在注射后約10min開始出現,注射后約30~45min混濁達到高峰,注射后60~90min晶狀體混濁開始消退,消退從中央部分開始,逐漸向周圍擴散,直到注射后120~150min混濁全部消退,部分小鼠在蘇醒前晶狀體混濁全部消退,部分小鼠在蘇醒后混濁部分消退。多數小鼠右眼晶狀體混濁較左眼略嚴重。兩組小鼠在水合氯醛注射后10、20、30、45、60、90、120和150min晶狀體混濁程度分布見圖2。青年組小鼠混濁出現早,持續時間長,混濁厚重,呈乳白色;老年組小鼠晶狀體混濁出現略晚,持續時間短,混濁略輕,呈灰白色,薄霧狀。注射后10min,青年組小鼠晶狀體混濁程度0級2只,1級10只,老年組小鼠晶狀體混濁程度0級9只,1級3只;注射后90min,青年組小鼠晶狀體混濁程度輕度消退(-1級)5只,中度消退(-2級)6只,完全消退(-3級)1只,老年組小鼠晶狀體混濁程度中度消退(-2級)5只,完全消退(-3級)7只。注射后10、90min兩組晶狀體混濁程度均有顯著性差異(10min:Z=1.966,P=0.0493;90min:Z=-2.082,P=0.0373)。水合氯醛注射后45min晶狀體3級混濁代表性圖片見圖3。
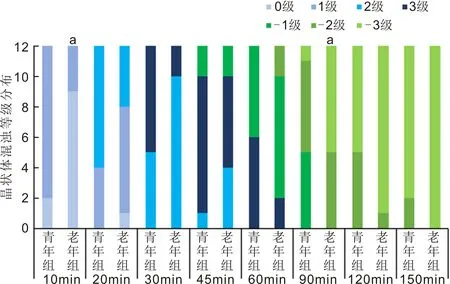
圖2 兩組小鼠水合氯醛注射后不同時間點晶狀體混濁分布情況 aP<0.05 vs 青年組。

圖3 青年小鼠及老年小鼠水合氯醛注射后45min眼前節照相 A:青年組小鼠晶狀體混濁,混濁厚重,呈乳白色;B:老年組小鼠晶狀體混濁,混濁輕薄,呈薄霧狀。
2.3水合氯醛誘導小鼠晶狀體的病理改變裂隙燈檢查發現水合氯醛注射后青年組小鼠與老年組小鼠晶狀體的混濁程度差異明顯,為探究其機制我們將水合氯醛注射前和注射后45min晶狀體混濁3級的兩組小鼠眼球進行病理組織學檢查。HE染色可見水合氯醛誘導的晶狀體混濁主要病理改變在晶狀體前皮質,但晶狀體核及后皮質無明顯改變。水合氯醛注射前,青年組小鼠晶狀體纖維排列規則;注射后45min,青年組小鼠晶狀體纖維排列欠規則,囊膜下淺皮質間出現大量水泡。水合氯醛注射前老年組小鼠晶狀體纖維呈老年性改變,纖維腫脹變性;注射后45min,老年組小鼠晶狀體纖維排列紊亂,前皮質下少量水泡聚集,但明顯少于青年組小鼠,見圖4。
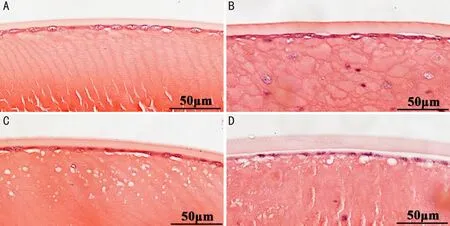
圖4 水合氯醛注射前后小鼠晶狀體病理改變(HE染色) A:水合氯醛注射前青年組小鼠晶狀體;B:水合氯醛注射前老年組小鼠晶狀體;C:水合氯醛注射45min后青年組小鼠晶狀體,混濁3級;D:水合氯醛注射45min后老年組小鼠晶狀體,混濁3級。
2.4兩組小鼠麻醉后LECs的Na+-K+-ATP酶表達HE染色發現水合氯醛注射后晶狀體前皮質有大量水泡積聚,這可能是導致晶狀體混濁的主要原因。LECs中Na+-K+-ATP酶主動轉運Na+和K+,維持離子的平衡對于晶狀體透明性的維持十分重要。為探討Na+-K+-ATP酶是否參與水合氯醛誘導的急性可逆性晶狀體混濁,我們進行了Na+-K+-ATP酶的免疫組織化學染色。結果顯示,水合氯醛注射前,兩組小鼠Na+-K+-ATP酶在LECs呈低表達;水合氯醛注射后45min,兩組小鼠LECs的Na+-K+-ATP酶的表達顯著增加,而且老年組小鼠LECs的Na+-K+-ATP酶的表達增加更為顯著,見圖5。

圖5 免疫組織化學檢測水合氯醛注射前后小鼠晶狀體的Na+-K+-ATP酶的表達 A:水合氯醛注射前青年組小鼠晶狀體Na+-K+-ATP酶低表達;B:水合氯醛注射前老年組小鼠晶狀體Na+-K+-ATP酶低表達;C:水合氯醛注射后45min青年組小鼠晶狀體混濁3級,Na+-K+-ATP酶表達增加;D:水合氯醛注射后45min老年組小鼠晶狀體混濁3級,Na+-K+-ATP酶表達顯著增加。
3討論
嚙齒類動物的急性可逆性晶狀體混濁是個相對古老的問題,早在20世紀60年代就有研究者報道了這一現象。研究顯示水合氯醛、戊巴比妥鈉、七氟醚、氯胺酮-甲苯噻嗪等麻醉劑均可引起小鼠急性可逆性晶狀體混濁[5-6],而且溫度、氧供、脫水、pH值、小鼠品系等多種因素也可影響晶狀體混濁的進展[7]。研究顯示,不同麻醉鎮靜藥物誘導的晶狀體混濁進展過程相似,推測可能與麻醉劑導致的體溫下降相關[8]。藥物、氣體[9]、脫水[10]等因素也會引起人晶狀體出現可逆性混濁,但其具體分子機制尚不清楚。
水合氯醛是動物實驗中的常用鎮靜藥物,也是兒童眼科檢查的常用鎮靜藥物[11]。其鎮靜效果穩定,作用持續時間長,能降低新陳代謝,抑制體溫中樞,使體溫下降。水合氯醛注射后小鼠會出現眼瞼閉合障礙、眼球突出,注射后10~20min開始出現晶狀體混濁,注射后30min晶狀體顯著混濁,并持續至注射后約60min,注射后60~90min晶狀體混濁開始消退,直至小鼠蘇醒前后,晶狀體混濁全部消退[5]。既往研究顯示水合氯醛誘導的急性可逆性晶狀體混濁可能與麻醉效應[5]、角膜脫水[12]和溫度[2,13]等因素有關。研究顯示應用低滲生理鹽水[8]、透明質酸鈉[14]、卡波姆[1]等滴眼液可以緩解麻醉劑誘導的晶狀體混濁程度[1,14],應用角膜接觸鏡、眼瞼縫合等方法也可以減緩或阻止晶狀體混濁的形成[12]。有研究者推測是由于麻醉狀態下小鼠無法瞬目,淚膜蒸發,角膜缺水而導致晶狀體循環出現障礙,滴眼液、接觸鏡及閉合眼瞼等方法可以抑制淚液的蒸發,減輕角膜脫水,進而延緩晶狀體混濁的進展。環境溫度下降顯著增加晶狀體混濁的程度和進展,環境溫度升高顯著降低晶狀體混濁的程度和進展,室溫達到37℃時,大部分小鼠不形成晶狀體混濁[2,13]。本實驗過程中保持室溫23℃,用生理鹽水點眼來保持角膜濕潤,盡量減少晶狀體混濁的影響因素。本研究發現水合氯醛注射后青年組小鼠和老年組小鼠晶狀體混濁進展過程相似,但青年組小鼠晶狀體混濁進展速度更快,混濁程度更高,提示晶狀體年齡相關性改變對水合氯醛誘導的晶狀體混濁具有一定的影響。
水合氯醛等鎮靜麻醉劑誘導的急性晶狀體混濁的確切分子機制尚不明確。晶狀體的液體穩態對晶狀體透明性有重要影響,其中主要包括水循環和離子交換。水通道蛋白1(aquaporin 1, AQP1)、Na+-K+-ATP酶和Ca2+-Mg2+-ATP酶的活性對維持晶狀體液體穩態具有重要的作用。Gu等[8]應用活體激光共聚焦顯微鏡和OCT發現水合氯醛誘導晶狀體混濁主要改變晶狀體前皮質,本研究的結果也顯示水合氯醛誘導的混濁晶狀體前皮質下大量水泡積聚,晶狀體的水含量/離子濃度改變可能參與水合氯醛誘導晶狀體混濁。既往研究顯示AQP1主要表達在LECs,水通道蛋白0(aquaporin 0,AQP0)主要表達在晶狀體纖維[15],水合氯醛誘導的可逆性晶狀體混濁,LECs中AQP1表達減少,推測LECs的水和離子的轉運可能參與可逆性晶狀體混濁[16]。Na+-K+-ATP酶在LECs及纖維中均有表達,其活性在LECs中顯著高于晶狀體纖維[17],但其蛋白表達與酶的活性并不完全一致。Na+-K+-ATP酶是否參與水合氯醛誘導的晶狀體混濁尚未見報道,本研究發現水合氯醛注射前青年組小鼠和老年組小鼠LECs中的Na+-K+-ATP酶均呈現低表達,水合氯醛注射45min后兩組LECs中的Na+-K+-ATP酶的表達增加,而且老年組LECs的Na+-K+-ATP酶的表達增加更為顯著,這可能與老年小鼠晶狀體混濁較青年組較輕相關。
麻醉劑可影響神經元的Na+-K+-ATP酶的活性[18],麻醉后Na+-K+-ATP酶活性降低是否會導致其表達代償性增加,目前尚不可知。Na+-K+-ATP酶的活性檢測比表達檢測更有意義,本研究的不足之處在于未進行Na+-K+-ATP酶的活性檢測。但本研究提示Na+-K+-ATP酶參與了水合氯醛誘導的可逆性晶狀體混濁的形成,晶狀體年齡相關性改變對水合氯醛誘導的晶狀體混濁形成具有一定影響。

