預熱超聲對菠蘿蜜種子分離蛋白起泡性及結構的影響
周若楠,張彥軍,鐘俊楨*,周 磊,劉 偉,劉成梅
(1.南昌大學食品科學與技術國家重點實驗室,江西 南昌 330047; 2.中國熱帶農業科學院香料飲料研究所,海南 萬寧 571533)
菠蘿蜜(Artocarpus heterophyllus Lam)屬桑科,又稱“木菠蘿、樹菠蘿”,其果實清甜可口,香味濃郁,營養價值高,被譽為“熱帶水果皇后”,廣泛種植于墨西哥、馬來西亞等熱帶國家[1]。在我國主要種植于海南、云南等熱帶和亞熱帶等地區。菠蘿蜜種子占果實總重量的8%~15%,是淀粉(67%)和蛋白質(20%)的良好來源[2]。菠蘿蜜含有許多植物化學物質,如木質素、異黃酮、多酚等,它們具有優異的生物活性,如抗衰老、抗高血壓、抗癌和抗氧化等[3]。研究發現菠蘿蜜種子分離蛋白(Jackfruit Seed Isolate Protein,JSPI)中的必需氨基酸占總氨基酸的48.39%,高于大豆蛋白(37.79%),其中蘇氨酸、纈氨酸、苯丙氨酸含量均高于大豆蛋白,其它必需氨基酸含量與大豆蛋白無異。作為世界上最重的水果,其種子產量高,但只有少量被用來食用,大部分被丟棄,既造成了資源的浪費,又降低了菠蘿蜜的經濟效益[4]。
由于植物蛋白在人類健康和營養中的重要作用,使其作為食品加工中的一種功能成分的需求越來越大。起泡性是蛋白質重要的功能性質之一,對蛋糕、冰激凌、飲料等起泡性要求較高的食品十分重要,已逐漸成為研究熱點[5]。動物蛋白,如蛋清蛋白和乳清蛋白,具有良好的起泡性被廣泛用做發泡劑。但動物蛋白價格昂貴,應用成本高,可以考慮用優質的植物蛋白作為替代品[6]。菠蘿蜜具有優異的功能和營養特性,可以成為一種新的蛋白來源。但與動物蛋白相比,JSPI的起泡性較差,在食品工業中的應用不如動物蛋白。所以改善JSPI的起泡性,擴大在食品工業中的應用,具有重要的科研意義和經濟意義。
改善起泡性的方法包括化學、物理或酶法改性等。化學改性可能會產生或引入有毒或影響食品風味的物質;酶法改性會使蛋白質在酶解過程中產生苦味肽,影響產品的風味和口感;物理改性作用時間短、安全性好,對蛋白質營養價值損失小[7]。超聲是一種綠色、安全、高效的新型非熱物理技術,超聲引起的空化效應會導致高溫、高壓、高剪切能波和湍流,從而改變蛋白質的功能和結構性質[8]。Feng等[9]發現在pH 2.0~10.0條件下,超聲(400,600 W)可以顯著提高李子分離蛋白的起泡能力和泡沫穩定性。Xiong等[10]發現超聲后的豌豆蛋白,起泡能力從145.6%提高到200.0%,泡沫穩定性從58.0%增加到73.3%。Flores-Jiménez等[11]也得出類似的結論。超聲可以作為改善蛋白質起泡性的技術手段,在蛋白質的開發與利用上具有廣闊的應用前景和潛力[12]。
本研究針對JSPI的起泡性,通過預熱超聲技術改善JSPI的起泡性,并探究結構對起泡性的影響,期望拓寬JSPI在食品領域中的應用,也為超聲改性蛋白方面提供一些新的理論參考。
1 材料與方法
1.1 材料與試劑
菠蘿蜜種子 海南萬寧(熱帶香料飲料作物研究所);其它化學試劑均為分析純。
1.2 主要儀器與設備
GA92-IIDB超聲波細胞粉碎機 無錫市上佳生物有限公司;F-7000熒光分光光度計 日本日立公司; MOS-450光譜儀 法國Biologico;T 25 digital高速分散機 德國IKA公司; NanoZsp電位儀 英國Malven公司;Ms3000LvAeros激光衍射粒度分析儀 英國Malvern公司;Synergy H1酶標儀 美國Bio Tek 公司。
1.3 試驗方法
1.3.1 菠蘿蜜種子分離蛋白(JSPI)制備
參考Zhang等[13]的方法制備JSPI。用研磨機將菠蘿蜜種子研磨成粉,在室溫下風干過篩(40目)。用石油醚對種子粉(1:5,V/w)脫脂并得到脫脂粉。將脫脂粉(1:10,w/V)分散在蒸餾水中,用1 mol NaOH調節至pH 10.0,攪拌1 h,在4 800 r·min-1條件下離心15 min。取上清液,用1 mol HCl調節至pH 4.3,在4 ℃條件下保持1 h。在4 800 r·min-1條件下離心15 min收集沉淀物,再用1 mol NaOH 調節至pH 7.0使沉淀物溶解。用透析袋(7 kDa)透析24 h,將樣品冷凍干燥。
1.3.2 起泡性條件優化
(1) 預熱溫度
將JSPI(5%,w/v)溶于蒸餾水中,室溫下攪拌1 h。在50 ℃~80 ℃條件下,用磁力攪拌水浴鍋加熱30 min,用冰水浴快速冷卻至室溫,將樣品冷凍干燥。
(2) 超聲功率及超聲時間
將JSPI(5%,w/v)溶于蒸餾水中,室溫下攪拌1 h。分別在超聲功率200,400,600 W,超聲時間10,20,30 min(脈沖時間為2 s,關閉時間為2 s)條件下處理JSPI,超聲探頭在液體表面1.5 cm以下,冰水浴中進行并每10 min更換1次冰水,處理后的樣品冷凍干燥[14]。
1.3.3 起泡性及泡沫穩定性
參考Somruedee等[15]的方法測定起泡性。蛋白樣品(20 mg·mL-1)溶于0.01 mol磷酸緩沖液(pH 9.0)中,取15 mL蛋白溶液倒入50 mL量筒中。用高速分散機攪打1 min,轉速為20000 r·min-1。起泡能力以2 min后泡沫的體積與初始體積的百分比表示。泡沫穩定性以30 min后泡沫的體積與2 min時泡沫體積的百分比表示。
起泡性(%)=[(V0-15)/15]×100;
泡沫穩定性(%)=[(V1-15)/(V0-15)]×100;
其中V0是2 min時泡沫體積,V1是30 min時泡沫體積。
1.3.5 SDS-PAGE凝膠電泳
參考Ma等[16]的方法測定在還原和非還原條件下的SDS-PAGE。制備12%的分離凝膠和4%的濃縮凝膠。取30 μL蛋白溶液(2 mg·mL-1),加入10 μL 4×含β-巰基乙醇或4×不含β-巰基乙醇的上樣緩沖液,沸水浴加熱7 min,離心2 min。在凝膠泳道加入10 μL樣品或5 μL Mark。電壓調整為80 V,15 min后再調至120 V,運行40 min。用考馬斯亮藍(R-250)染色50 min,再用脫色液脫色至條帶清晰可見。
1.3.6 圓二色譜
參考Zheng等[17]的方法測定蛋白質二級結構。用0.01 mol磷酸鹽(pH 9.0)緩沖液配制0.1 mg·mL-1的蛋白溶液,路徑長度為1 mm,掃描波長范圍為190~240 nm。在25 ℃條件下進行測定,以0.01 mol磷酸鹽(pH 9.0)作為空白對照。采用Dichro Web網站的CONTIN程序對蛋白質二級結構進行擬合分析并計算出二級結構含量。
1.3.7 熒光光譜
參考He等[18]的方法測定蛋白質的三級結構。用0.01 mol磷酸鹽(pH 9.0)緩沖液將蛋白樣品配制成0.1 mg·mL-1的蛋白溶液,激發波長280 nm,激發和發射的狹縫寬度均為2.5 nm,掃描速度1 200 nm·min-1,在25 ℃條件下記錄290~450 nm波長范圍內的發射光譜。
1.3.8 表面疏水性測定(H0)
參照Haskard等[19]的ANS探針法測定蛋白質的表面疏水性。蛋白樣品用0.01 mol磷酸鹽(pH 9.0)緩沖液配制成0.04~0.12 mg·mL-1的蛋白溶液。取50 μL 8.0 mmol·L-1的ANS加到4 mL的蛋白溶液中,激發波長390 nm,發射波長470 nm。以熒光強度對蛋白濃度作圖,斜率即為蛋白質分子的表面疏水性指數(H0)。
1.3.9 電位、粒徑測定
蛋白樣品用0.01 mol磷酸鹽(pH 9.0)配制成0.1 mg·mL-1蛋白溶液,在25 ℃條件下測定溶液電位。蛋白樣品(0.1 g·mL-1)溶于蒸餾水中,遮光率為8%~12%,泵速為2000 r·min-1,分散相折射率和吸收參數分別為1.330和0.001[9],測定樣品粒徑。
1.4 數據分析
所有實驗重復3次,實驗數據表示為平均值±標準差。所有統計數據使用SPSS Statistics 21.0統計軟件進行分析,Tukey法計算平均值之間的顯著性差異(P<0.05)。用Origin 8.5軟件用于數據繪制。
2 結果與分析
2.1 起泡性條件優化
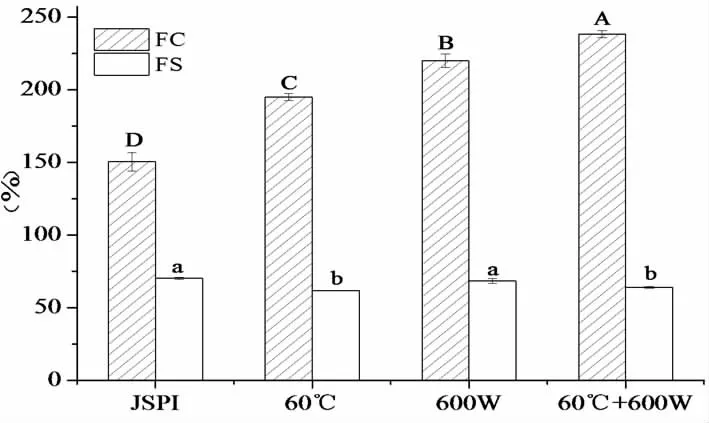
從圖1(A)中,隨著預熱溫度的升高,JSPI的起泡能力先增強后下降,60 ℃時的起泡能力最好,為200%。50 ℃(55.95%),60 ℃(57.71%),70 ℃(47.71%)時的泡沫穩定性沒有顯著差異(P>0.05),80 ℃時的泡沫穩定性最差,為42.34%。圖1(B)中,起泡性隨超聲功率的增加而增加,600 W時的起泡能力為216.45%,泡沫穩定性(66.79%)與400 W(63.39%)的沒有顯著性差異(P>0.05)。200 W處理的起泡能力(158%)和泡沫穩定性(59.55%)最差。圖1(C)中,超聲20與30 min的起泡性無明顯差異(P>0.05),均高于10 min時的起泡性。不同處理時間對泡沫穩定性沒有顯著性差異。由以上分析得到最佳條件:預熱溫度60 ℃,超聲功率為600 W,超聲時間20 min。在此基礎上,還研究了60 ℃與600 W共同處理JSPI,探究JSPI起泡性與其結構之間的關系。

其中(A),(B),(C)分別為不同預熱溫度、超聲功率及超聲時間對JSPI起泡性的影響。不同大寫字母FC有顯著性差異,不同小寫字母表示FS有顯著差異(P<0.05)。
2.2 起泡性及泡沫穩定性
起泡性是指蛋白在快速攪打后吸附到水-空氣界面,分子部分展開,大量空氣進入,在氣-液界面形成一層薄而堅韌的膜,并形成氣泡[6]。泡沫穩定性可以通過在一定時間內,泡沫體積變化量來表示,根據起泡能力和泡沫穩定性測定泡沫的質量[20]。影響起泡性的因素很多,如蛋白種類、pH、表面疏水性、凈電荷等。圖2中,與未處理的JSPI相比,600 W超聲處理后的起泡能力增加了45.25%,泡沫穩定性沒有顯著性差異(P>0.05)。超聲的空化效應使蛋白質發生變性,并通過增加泡沫的粘結性和柔韌性改善起泡能力和泡沫性能[21]。Alejandro等[22]發現高強度超聲處理的蠶豆蛋白,起泡能力從145.8%增加至258.3%。Mei等[23]發現超聲處理的乳清蛋白,起泡能力提高了18%,泡沫穩定性提高了35%。60 ℃處理JSPI的起泡能力增加了29.64%,泡沫穩定性下降至61.81%。Chao等[24]發現豌豆蛋白在80 ℃~100 ℃處理后,在任何pH條件下其起泡能力都較低。在pH 5.0條件下,50 ℃和70 ℃處理都有較高的起泡能力。60 ℃+600 W超聲處理的JSPI起泡能力增加了58.44%,表明熱處理和超聲對JSPI起泡能力表現為協同作用,泡沫穩定性下降至64.00%。Morales等[25]研究發現,超聲(750 W)與70 ℃,80 ℃,85 ℃共同處理大豆分離蛋白的起泡能力均高于單獨超聲或單獨溫度處理。適當的升高溫度可以改善超聲對蛋白質修飾的作用,從而進一步提高起泡性[25]。
FC:起泡能力;FS:泡沫穩定性。
2.3 SDS-PAGE凝膠電泳
圖3中,在非還原條件下,JSPI的分子量主要在17~26 kDa之間(Line 1)。由于JSPI中存在二硫鍵,在β-巰基乙醇作用下出現了新的條帶,主要集中在10~17 kDa之間(Line 5)。與未處理的JSPI相比,600 W處理的JSPI的電泳圖譜沒有發生明顯變化(Line 1與Line 3,Line 5與Line 7),這表明600 W超聲不能改變使JSPI的分子量。Hu等[14]研究發現超聲處理的大豆分離蛋白的電泳圖譜沒有明顯變化。Flores-Jiménez等[11]也得出相似的結論。然而,Jambrak等[26]報道,蛋白分子量發生改變是由于超聲的空化效應引起較高的剪切應力和湍流效應,導致蛋白分子結構分裂所致。Resendiz-Vazquez等[27]研究得出超聲(200,400,600 W)可以使JSPI分子量發生變化。該結論與本研究結果不同,可能與蛋白的種類、來源和超聲條件有關。經過60 ℃處理的JSPI(Line 2,4,6,8)均出現了一條新的分子量條帶(a,d,b,e),可能是加熱使可溶性蛋白分子聚集,形成大分子量蛋白。60 ℃+600 W處理的JSPI(Line 4, 8)在熱處理和超聲處理的共同調控下有條帶消失(c, f),可能是熱處理后的可溶性蛋白在超聲的空化作用下空間結構被破壞,導致條帶消失。安然[28]研究發現,與未處理的相比,熱處理(60 ℃,80 ℃,100 ℃)的可溶性大豆分離蛋白進行超聲處理(600 W)后,在電泳圖譜上可以看出11S蛋白的B亞基含量顯著降低。從圖譜中可以看出,熱處理和超聲都沒有破壞JSPI的二硫鍵。
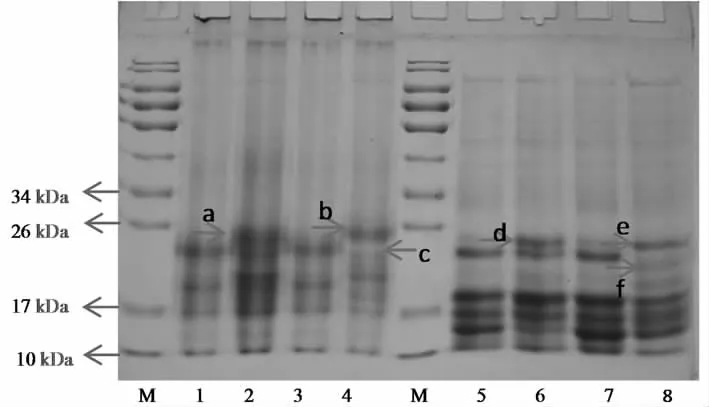
非還原性條件:Line 1-4:JSPI;60 ℃;600 W;60 ℃+600 W;還原性條件:Line 5-8:JSPI;60 ℃;600 W;60 ℃+600 W。
2.4 圓二色譜
從表1中看出,JSPI的二級結構主要為β-折疊和不規則卷曲。經過處理的JSPI均表現出α-螺旋和β-轉角含量下降,β-折疊和無規則卷曲含量上升。蛋白質的二級結構既取決于氨基酸的局部序列,也取決于分子不同部分之間的相互作用,超聲處理可以破壞這些相互作用,導致二級結構變化[9]。熱處理對蛋白二級結構的損失具有時間依賴性,較長的加熱時間,二級結構的損失更大。α-螺旋含量減少表明蛋白分子在加熱時發生變性,而β-折疊含量增加表明變性分子重新排列并結合成更穩定的產物[29]。Fan等[30]研究發現,隨著熱處理時間增加,β-乳球蛋白的α-螺旋和β-轉角含量減少,β-折疊含量增加。較高的β-折疊和無規則卷曲含量會使蛋白分子柔性增加,結構變松散,蛋白分子內部的疏水位點暴露在環境中,疏水性增強,可以在一定程度上提高蛋白的起泡性[31]。計等[6]研究得出,大豆蛋白的起泡性與α-螺旋和β-轉角含量成負相關,與β-折疊和無規則卷曲含量呈正相關。此外,β-折疊含量與蛋白三級結構有關,β-折疊含量增加可以誘導色氨酸殘基從親水環境轉移到疏水環境中,從而表現出更高的熒光強度[30]。
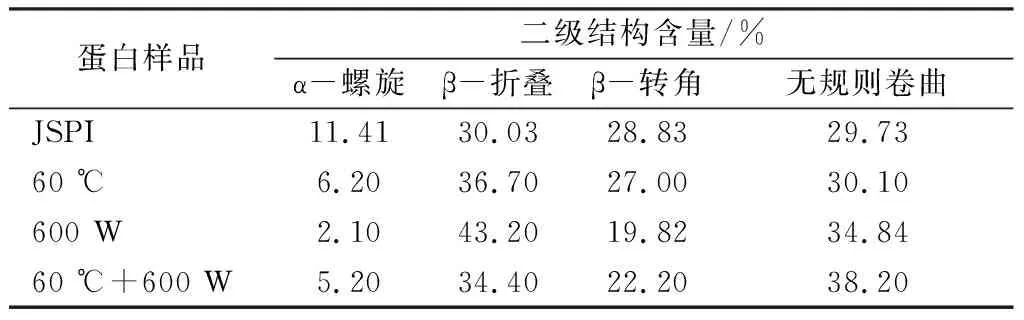
表1 4種蛋白樣品的二級結構含量
2.5 熒光光譜
蛋白質的熒光主要來自芳香族氨基酸,通過測量酪氨酸和色氨酸所處微環境中的變化,可以表征蛋白質的三級結構變化[32]。從圖5中可以看出,600 W處理的JSPI的熒光強度增強,表明超聲可以促進JSPI分子展開,暴露了更多的色氨酸殘基,這導致微環境的非極性增加,熒光強度增強[33]。60 ℃處理出現了最高的熒光強度和最大紅移量(△λ=3 nm),表明熱處理對JSPI的結構變化作用更為明顯,處于內部疏水環境的色氨酸和酪氨酸殘基暴露出來。60 ℃+600 W處理的熒光強度有所下降,可能是60 ℃和600 W超聲共同作用,使JSPI發生較大的變性,導致部分色氨酸和酪氨酸暴露在親水環境中。熒光強度增強與圓二色譜結果中β-折疊含量的增加相對應,進一步可以證明,JSPI結構變松散,內部的疏水基團暴露在分子表面[34],疏水基團的暴露導致疏水性增加,進而可以改善JSPI的起泡性質。
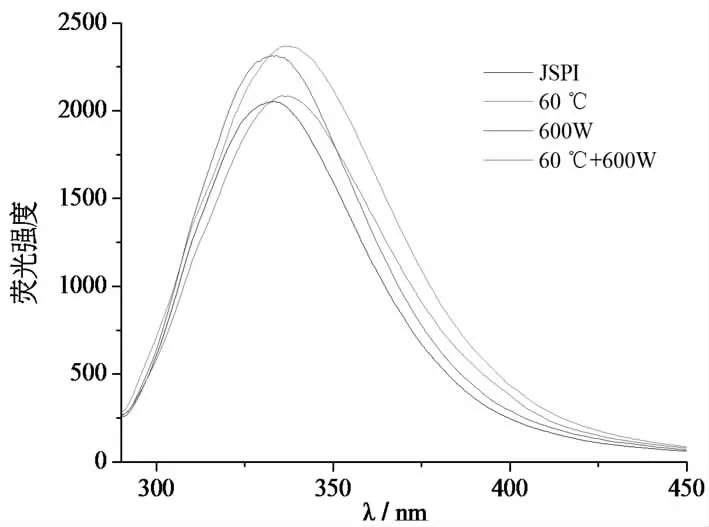
圖4 4種蛋白樣品的熒光光譜圖
2.6 表面疏水性(H0)
表面疏水性反映了疏水基團的暴露,表面疏水性指數(H0)可以看作是蛋白分子表面疏水基團數量的一個指標,影響著蛋白質的結構和功能性質,較松散的蛋白結構和多肽鏈的展開可以暴露出更多的疏水腔和基團,較高的疏水性可以改善蛋白質的起泡性和乳化性[35]。圖5中,600 W處理的JSPI的H0增加了46.58%,表明超聲可以誘導JSPI分子展開,減少分子間締合,使更多的疏水區域暴露在溶劑環境中[14]。60 ℃處理JSPI的H0增加了60.35%,熱變性可以將蛋白質解離成亞單位,分子結構展開,暴露出更多的疏水基團[36]。F.Peyrano等[36]曾報道,在70°C,pH 10.0時,豇豆分離蛋白H0的最大增量為149%,90°C處理的H0增量為74%~81%。經過60 ℃+600 W處理的JSPI的H0則有最大增量,為96.34%,表明熱處理和超聲對JSPI的H0也表現為協同作用。表面疏水性增加可以改善JSPI的起泡性。
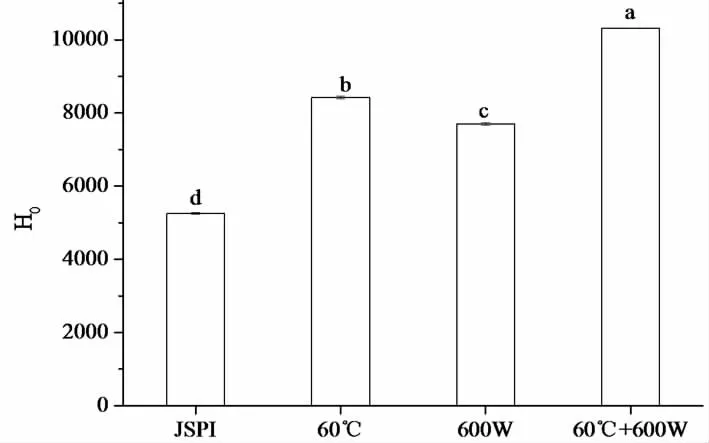
圖5 4種蛋白樣品的表面疏水性(H0)
2.7 電位
蛋白質溶液表面的基團具有電離作用,在酸性溶液中帶正電荷,在堿性溶液中帶負電荷[37]。當電位絕對值低時,表明溶液體系中的蛋白質分子表面帶有負電氨基酸的含量低,表面電荷少,分子間容易聚集形成沉淀,導致溶液體系不穩定;表面電荷越多,說明蛋白質分子間的靜電斥力越強,通過破壞和抑制蛋白質分散體的進一步聚集,可以維持溶液體系的穩定[38,39],也有助于維持蛋白泡沫的穩定性。從圖7中可以看出,600 W處理后JSPI的電位從-22.03 mV增強至-24.53 mV,這是因為較高強度的超聲作用會破壞蛋白質分子聚集體,使帶有負電的氨基酸更多的暴露在蛋白分子表面,表面負電荷增加。Bahman等[40]曾報道,超聲后的小米蛋白濃縮物的電位從-32.9增強至-42.2 mV。60 ℃處理后JSPI的負電位值增加,說明熱處理會出暴露更多的疏水氨基酸,蛋白質分子表面電荷減少。60 ℃+600 W處理的負電位值最高,可能是兩種條件作用下,使更多的疏水氨基酸暴露在外部環境中,電荷量下降。負電位值增加,會導致溶液體系不穩定,泡沫穩定性下降。
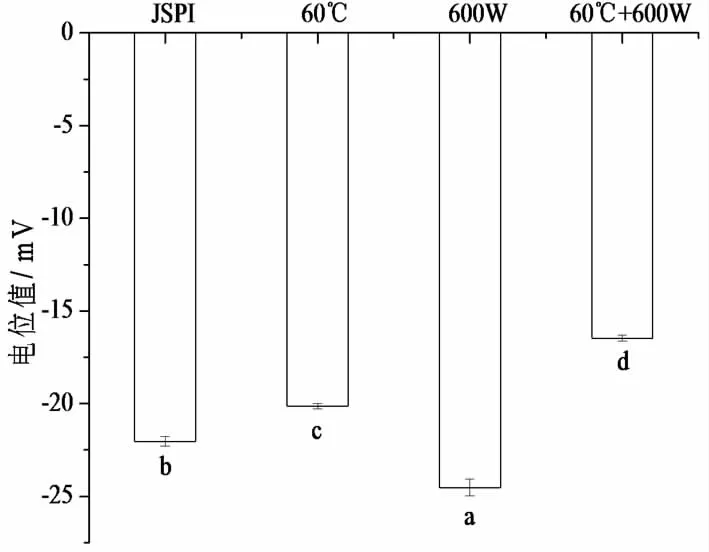
圖6 4種蛋白樣品的電位圖
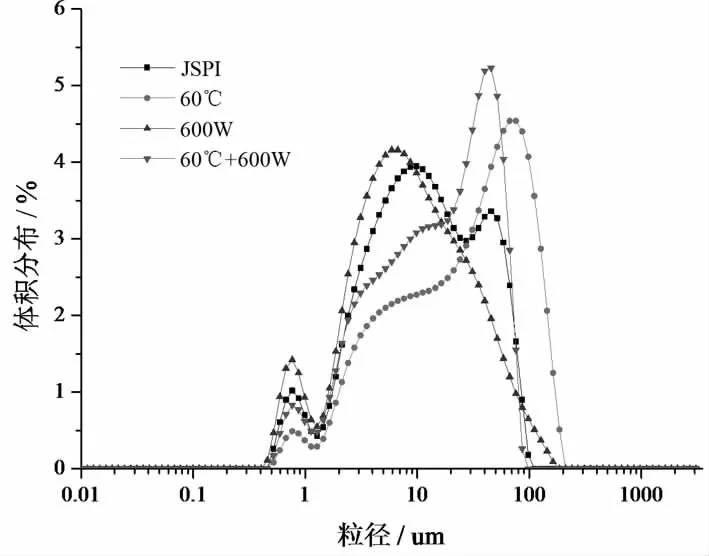
圖7 4種蛋白樣品的粒徑圖
2.8 粒徑
從圖8中看出,JSPI的粒子分布主要在1~100 nm之間,在0.5~1 nm之間有較少的分布。600 W處理后JSPI在0.5~1,1~100 nm粒徑峰升高,且1~100 nm的粒徑峰向粒徑小的方向偏移,說明超聲作用可以將JSPI分解成更小的蛋白顆粒。Jambrak等[26]曾報道,在超聲頻率20 kHz條件下,乳清蛋白顆粒尺寸減小,比表面積增加,40 kHz處理的顆粒尺寸則顯著減小。60 ℃處理的JSPI在0.5-1 nm和1~10 nm處的粒徑峰下降,大于100 nm的粒徑體積增多,且在100 nm處出現了最高峰,表明熱處理使JSPI分子聚集形成了大分子蛋白顆粒。Xiong等[41]研究發現,熱處理后的牛奶血清蛋白的粒徑峰從68變化到92 nm,乳鐵蛋白和牛奶血清混合物的粒徑峰從79變化到125 nm。60 ℃+600 W處理JSPI的粒徑分布基本介于600 W處理和60 ℃處理之間,說明超聲處理分散了部分60 ℃處理形成的大分子蛋白聚集體。Morales等[25]探究了大豆分離蛋白粒徑與起泡性的關系,超聲處理的大豆分離蛋白粒徑減小,同時起泡性也顯著增加。80 ℃,超聲和80 ℃處理后的粒徑增加,但起泡性也顯著增加。該研究指出,在較低的比例下,粒徑較高的蛋白群體也可以提高起泡性。本研究也得到相似的結論,粒徑減小或較低比例存在的大分子蛋白均可以增加JSPI的起泡性。粒徑的部分變化與SDS-PAGE圖譜中蛋白分子量的變化一致。
3 結論
本研究在最佳起泡性性條件下探究了結構變化對JSPI起泡性的影響。起泡性結果發現,60 ℃+600 W處理的JSPI起泡性增加了58.44%,高于600 W超聲(45.25%)和60 ℃ (29.64%),表明兩者對JSPI起泡性表現為協同作用,但泡沫穩定性沒有提高。結構變化對起泡性有顯著的影響。SDS-PAGE結果表明,600 W超聲沒有改變JSPI分子量,60°C處理使部分可溶性蛋白分子聚集,形成了較大分子量蛋白。圓二結果表明,起泡性的增強與β-折疊和無規則卷曲含量增加有關,較高的β-折疊和無規則卷曲含量會使蛋白分子柔性增加,結構變松散,疏水性增強,在一定程度上提高起泡性。熒光強度增強和表面疏水性(H0)增加進一步說明,起泡性增加與蛋白結構變松散,內部的疏水基團的暴露有關。電位值會影響泡沫的穩定性,電位絕對值越大表明蛋白質分子間的靜電斥力越強,可以有效阻止蛋白質分散體的聚集,維持體系的穩定。粒徑大小也在一定程度上影響起泡性,粒徑減小或在較低比例下,粒徑較大的蛋白分子均可以提高JSPI的起泡性。本研究采用預熱超聲技術JSPI起泡性進行改性處理,期望拓寬JSPI的應用范圍,促進菠蘿蜜產業的發展,也為超聲改性蛋白方面提供一些新的理論參考。

