棉花FT基因的特征和表達分析
劉春艷,劉杰 ,陳偉,朱守鴻,李燕,曹新川 ,何良榮 ,張永山*
(1塔里木大學植物科學學院,新疆 阿拉爾 843300)
(2中國農業科學院棉花研究所/棉花生物學國家重點實驗室,河南 安陽 455000)
棉花是我國重要的經濟作物,其產量和品質性狀與開花密切相關。開花是植物生長發育必經的過程,標志著植物由營養生長向生殖生長的轉變,這是一個環境信號和內源信號共同調節的過程。不同的棉種表現出不同的開花時間和溫度敏感反應,在溫度、光等環境因素中,植物對光周期的響應是決定最佳開花時間的重要因素[1]。FT(Flowering Locus T)基因是植物開花調控途徑中的重要整合因子和關鍵基因[2],可將上游的信號整合傳遞給下游開花發育相關基因以調控開花。FT蛋白是在植物葉片中產生的成花信號,通過輸導組織長距離運輸到莖尖頂端從而促進開花[3-4]。FT基因與TFL1(Terminal Flower 1)基因均為磷脂酰乙醇胺結合蛋白(phosphatidyl ethanolamine-binding proteins,PEBP)家族的成員,因兩個氨基酸位點的差異而具有相反的調節功能[5],組成型表達TFL1基因可延遲開花[6],組成型表達FT基因可提前開花[7]。
近幾年已在多種植物中克隆到FT同源基因,并通過轉基因技術證明FT基因的表達可促進植物提早開花[8-10]。郭丹麗等[11]在擬南芥中過表達GhFT1基因,擬南芥出現早花表型。東銳等[12]克隆了棉花FT基因,轉化擬南芥表現為提早開花。樊紅娟等[13]發現FT基因能促進棉花植株開花形成花蕾,GhFT基因的表達量隨著棉花植株從營養生長向生殖生長的過渡越來越高。這些研究成果為進一步探索FT基因的作用機制奠定了基礎,然而其在基因組中的分布、進化特性仍不清楚。PEBP基因家族分為3個亞家族,本試驗利用生物信息學的方法,對FT-like亞家族中的FT基因的理化特性、基因結構、蛋白結構等進行詳細分析。此外,棉花中FT基因的時空表達模式研究多是針對田間材料不同發育階段而言,本試驗以陸地棉TM-1為試驗材料,除對田間GhFT基因在不同組織中的表達進行定量分析,室內還通過不同的光周期處理驗證GhFT的表達與光周期之間的相關性,田間與室內試驗結合以確定棉花FT基因的時空表達模式,旨在為FT基因相關研究提供理論依據,為探索FT基因在棉花發育調控中的作用奠定基礎。
1 材料與方法
1.1 棉花FT同源基因鑒定及特征分析
從 Cottongen數據庫(https://www.cottongen.org/)下載雷蒙德氏棉(Gossypium raimondiiU1bich)、海島棉(Gossypium barbadenseL.)、陸地棉(Gossypium hirsutumL.)、亞洲棉(Gossypium arboreumL.)、草棉(Gossypium herbaceumL.)、長萼棉(Gossypium longicalyxHutchinson&Lee)、瑟伯氏棉(Gossypium thurberiTodaro)、澳洲棉(Gossypium australF.von Mueller)、擬似棉(Gossypium gossypioides(Ulbrich)Standley)、特倫納氏棉(Gossypium turneriFryxell)、達爾文氏棉(Gossypium darwiniiWatt)、夏威夷棉(Gossypium tomentosumNuttall ex Seemann)、黃褐棉(Gossypium mustelinumMiers ex Watt)的基因蛋白序列信息文件。
從 CottonFGD 數據庫(https://cottonfgd.org/)以PF01161為查詢條件,下載Gorai.004G264600(GrFT)基因蛋白序列,將GrFT基因編碼的蛋白序列與13個棉種分別進行雙向比對(blast),預測與GrFT同源的候選基因,選擇E值最小的基因提取其蛋白序列,利用 Pfam(http://pfam.xfam.org/search#tabview=tab1)、CDD(https://www.ncbi.nlm.nih.gov/Structure/bwrpsb/bwrpsb.cgi)和Batch SMART_v1.0基于保守結構域(domain)對候選基因進行鑒定,剔除不含保守結構域、長度異常的基因。使用CELLO v.2.5在線預測網站(http://cello.life.nctu.edu.tw/)對鑒定出的FT基因進行蛋白質亞細胞定位預測,FT基因編碼的蛋白序列刪除ID后提交到ExPASy(https://web.expasy.org/compute_pi/)對蛋白的相對分子量和等電點進行分析。
1.2 FT同源基因系統進化、蛋白基序、基因結構和保守結構域分析
將不同物種的FT基因的蛋白序列導入Geneious?10.2.2進行多序列比對,簡化ID后利用MEGA 7.0軟件計算最佳模型,采用最大似然法(maximum likelihood,ML)構建系統進化樹。利用Simple MEME Wrapper工具(TBtools)對蛋白保守基序進行分析。整理保守結構域信息和蛋白序列長度信息,利用Simple BioSequence Viewer工具(TBtools)進行保守結構域繪制,利用Gene Structure View工具(TB-tools)繪制進化樹、motif、基因結構和domain組合圖。
1.3 FT基因啟動子順式作用元件分析
從CottonFGD數據庫提取陸地棉(AD1)、海島棉(AD2)、亞洲棉(A2)和雷蒙德氏棉(D5)中FT基因編碼序列(coding sequence,CDS)上游2000 bp的序列,從Cottongen數據庫下載其余9個棉種的全基因組基因結構注釋文件和全基因組序列文件。利用TBtools中的Gtf/Gff3 Sequences Extract工具和Fasta Extract or Filter工具分別提取9個棉種的FT基因CDS上游2 kb的序列。整合所有FT基因CDS上游2000 bp的序列,提交到PlantCARE網站(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)進行順式作用元件分析,利用TBtools進行可視化。
1.4 主栽棉種FT基因表達模式分析
以基因ID作為查詢條件,從Cotton Omics Database數據庫(http://cotton.zju.edu.cn/index.htm)下載陸地棉和海島棉中FT基因的表達譜數據,利用Heat-Map工具(TBtools)繪制FT基因表達熱圖。
1.5 陸地棉GhFT基因的表達模式分析
1.5.1 試驗材料與處理
以陸地棉遺傳研究的標準系TM-1為試驗材料,種植于3個不同環境。
環境1:田間(自然光照)種植于河南省安陽市白璧鎮中國農業科學院棉花研究所東場試驗基地,于盛花期掛牌標記當日花,記為開花后0天(day post anthesis,DPA),并取開花當天的不同組織(根、下胚軸、主莖莖尖、果枝莖尖、子葉、幼葉、苞葉、萼片、花瓣、花藥、花絲、柱頭、胚珠),摘取3 DPA、5 DPA、10 DPA的棉鈴,室內剝取纖維,液氮速凍后于-80℃保存備用。
環境2:28℃溫室條件下于營養缽中種植,進行長日照處理(long-day,LD),光照時間16 h(09:00-次日01:00),光照強度為200 μmol/(m2·s-1),在五葉期于1 d內間隔4 h取倒3葉和主根,盛花期取主莖葉(按照生育期的大小把葉齡劃分為8個等級,如圖1所示),液氮速凍后于-80℃保存備用。

圖1 TM-1葉齡劃分
環境3:進行短日照處理(short-Day,SD),光照時間8 h(09:00—17:00),其他條件同環境2,于五葉期1 d內間隔4 h取倒3葉和主根,液氮速凍后于-80℃保存備用。
1.5.2 RNA的提取和cDNA的合成
按照EASYspin Plus植物RNA快速提取試劑盒(艾德萊生物)的操作步驟提取基因組RNA(操作均在低溫條件下進行),并用PrimeScriptTMRT reagent Kit with gDNA Eraser(TaKaRa)試劑盒進行反轉錄得到cDNA。
1.5.3 熒光定量PCR
在GhFT基因(登錄號:HM631972)的編碼序列中設計一對特異引物GhFT_248_F和GhFT_457_R,并用棉花中Actin14同源基因(GI號:AY305733)作為內參基因設計特異引物進行定量分析,引物序列信息見表1。

表1 引物信息
熒光定量PCR體系由5.0 μL 2×SYBR Premix Ex Taq染料,0.2 μL ROX Reference Dye Ⅱ,1.6 μL模板,0.4 μL Primer-F,0.4 μL Primer-R,2.4 μL滅菌水組成,總體系為10 μL。利用Applied Biosystems 7500 Realtime PCR System熒光定量PCR儀進行擴增,檢測每份樣品的GhFT基因和Actin內參基因的CT值,反應程序為95℃ 30 s、95 ℃ 5 s、60 ℃ 34 s,40個循環。每個樣品3個生物學重復,每次試驗設置3個技術重復。
1.5.4 數據處理
使用Microsoft Office Excel 2016整理數據,用SPSS Statistics 17.0進行差異顯著性(P<0.05)檢驗,用Origin 9.1、Prism 8.0.2等軟件進行作圖。
2 結果與分析
2.1 13個棉種FT同源基因及其序列特征
通過序列比對和保守結構域篩選,13個棉種共鑒定出18個FT基因,其中二倍體棉種均有1個FT基因,四倍體棉種A、D亞組各有1個FT基因,按照物種-基因的命名方式對鑒定出的FT基因進行命名(表2),并對其序列特征進行分析。從表2可以發現,FT基因的長度介于795 bp和3580 bp之間,除GkirFT基因和GthuFT基因外,不同棉種中的FT基因序列長度差異不大。CDS長度除GthuFT基因(591 bp)外其余FT基因均為525 bp。來自不同棉種的FT基因的相對分子量沒有明顯差別,平均為19.56 kDa,編碼的蛋白長度均為174個氨基酸。除GheFT基因(等電點為7.8)、GthuFT基因(等電點為9.45)和GkirFT基因(等電點為9.45),其余15個FT基因的等電點為6.73。對來自13個棉種的18個FT基因編碼的蛋白進行亞細胞定位預測,結果表明,16個基因均定位于細胞質和細胞外,只有GkirFT基因在葉綠體有定位。

表2 棉花FT基因的序列特征
2.2 FT基因系統進化、蛋白基序、基因結構和保守結構域分析
采用最大似然法構建13個棉種FT基因的系統進化樹(圖2),整個進化樹主要分為2個亞組,組Ⅰ僅有2個成員,即GthuFT基因和GkirFT基因;組Ⅱ包含來自11個棉種的16個成員。保守基序分析發現,18個FT基因均含有Motif 1(50個保守氨基酸)、Motif 2(50個保守氨基酸)、Motif 3(36個保守氨基酸)和Motif 4(26個保守氨基酸),說明這18個基因擁有相似的功能。基因結構分析發現,不同棉種中的FT基因含有相同數量的外顯子和內含子(4個外顯子,3個內含子),根據外顯子與內含子結構可將所有FT基因分為2組,這與ML進化樹的分組結果一致。保守結構域分析發現,同一組的FT基因具有相同的結構域,組Ⅰ的基因都含有4個PEBP結構域,組Ⅱ的基因均含有4個PLN00169結構域。

圖2 FT基因的進化、基因結構及編碼蛋白結構分析
2.3 FT基因啟動子順式作用元件
為了進一步研究FT基因的調控機制,提取FT基因CDS上游2 kb的核苷酸序列進行啟動子區域順勢作用元件預測,結果如圖3所示。總共預測到15種順勢作用元件,這些順式作用元件決定了FT基因對逆境脅迫(低溫、干旱、缺氧等)、激素(生長素、脫落酸、赤霉素等)、光等的響應機制。18個FT基因中GturFT基因含有的作用元件類型最豐富(11類),GrFT基因和GbFT.A基因含有的元件類型最少,均為5類。此外,15種順勢作用元件中有3種類型是獨特的,參與胚乳表達(endosperm expression)的順式調節元件僅GthuFT基因含有,參與晝夜節律(circadian control)控制的順式調節元件僅GbFT.D基因含有,涉及防御和應激反應(defense and stress responsive)的順式作用元件僅GhFT.D基因含有。所有的FT基因除GthuFT基因外均含有赤霉素響應元件,除GkirFT基因均含有光響應元件,推測FT基因的表達受光周期調控。
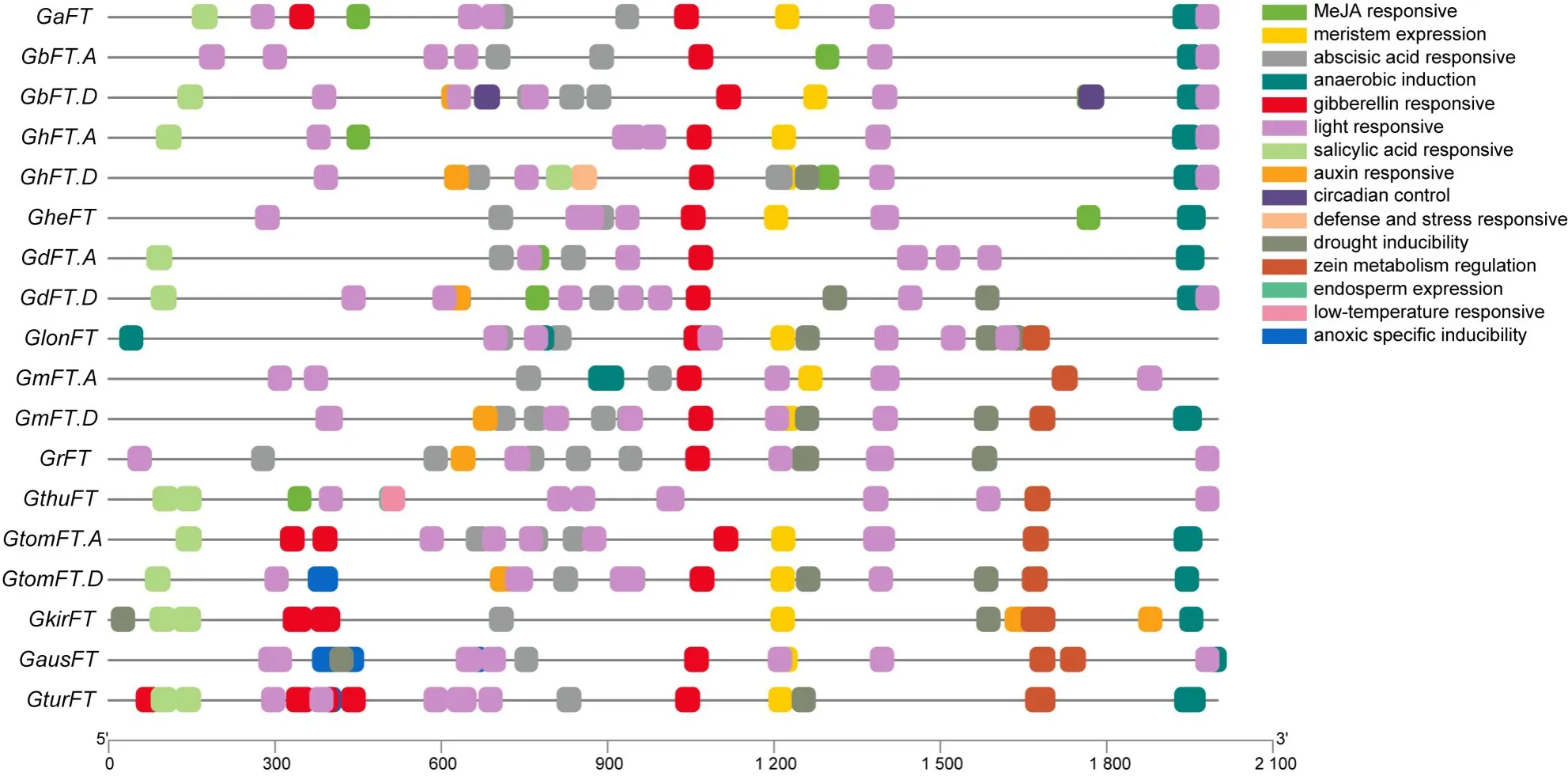
圖3 FT基因啟動子順式作用元件分布
2.4 主栽棉種FT基因表達模式分析
以陸地棉和海島棉中FT基因為代表,從公共數據庫下載相應基因的表達譜數據,對FT基因的表達模式進行分析。從圖4可以看出,GbFT.A基因、GbFT.D基因、GhFT.A基因、GhFT.D基因在Hai7124的10 DPA、20 DPA的纖維、胚珠、花藥、花瓣、雌蕊、根和莖中幾乎不表達,在副萼、葉、萼片中有表達,在花托中優勢表達,A亞組的2個FT基因在25 DPA的纖維中有相對較高表達。對FT基因在TM-1不同組織中表達進行分析發現,4個基因在胚珠、花藥、花瓣、根和莖中幾乎不表達,在葉中有較高表達,A亞組的2個基因在20 DPA的纖維、花托中優勢表達,在副萼、雌蕊中有較高表達,D亞組的2個基因在花托中有優勢表達。

圖4 FT基因表達熱圖
2.5 陸地棉GhFT基因的表達模式分析
2.5.1GhFT基因在不同組織中的mRNA轉錄水平比較
提取田間TM-1不同組織的RNA,反轉錄后進行GhFT基因熒光定量表達分析,結果如圖5所示:GhFT基因在苞葉中的表達量最高;其次是萼片;在子葉,莖尖和柱頭中的表達量相較于其他組織略高;在幼葉、花瓣、花絲、胚珠、5 DPA纖維、10 DPA纖維中只能檢測到微弱的GhFT基因表達;在根、下胚軸、花藥、3 DPA的纖維中幾乎無表達。

圖5 GhFT基因在不同組織的表達量
2.5.2GhFT基因在不同葉齡中的mRNA轉錄水平比較
GhFT基因在變態型葉(苞葉和萼片)中的表達量均高于幼葉,推測GhFT基因可能在較成熟的葉片中具有高表達,與模式植物擬南芥的表達模式相符。因此本試驗對室內長日照條件下取得的1~8葉齡的葉片進行表達定量分析,結果如圖6A所示:隨著葉齡的增加,GhFT基因的表達量也在增加,至葉齡8時到達最大。GhFT基因在成熟葉片中的表達量高于葉片剛發育時期的表達量,這也為實驗取樣提供一個數據依據。在此基礎上,本試驗對成熟葉片不同部位進行了GhFT基因表達量分析(圖6B),方差分析結果顯示同一葉片不同部位中的GhFT基因表達量不存在顯著差異,在取樣時應當盡量選取成熟葉片來檢測GhFT基因的表達量。

圖6 葉片中GhFT基因的表達量
2.5.3GhFT基因在不同光周期處理下mRNA轉錄水平比較
TFL1基因在根中具有較高表達[14],FT基因與其擁有相反的調節功能,猜測FT基因在根中也會有相應表達,且FT基因在成熟葉片中具有高表達,順式作用元件分析顯示FT基因的表達可能受光周期調控,為了探索FT基因與光周期的相關性,對五葉期的葉和根中的GhFT表達進行定量分析以研究GhFT基因在不同光周期處理下mRNA轉錄水平。
室內長日照處理條件下,24 h內每間隔4 h取樣進行熒光定量PCR,定量分析結果驗證了GhFT的表達與光周期之間的相關性。結果如圖7所示:GhFT基因在根中幾乎不表達,在葉片中的最高表達量顯著高于在根中的表達量。葉片中GhFT基因的表達量在光照條件下一直在下降,至暗培養開始(16 h)降至1 d內的最低點,然后開始積累,暗培養結束(24 h或0 h)時GhFT基因的表達量達到最大,說明在LD處理下,葉片中GhFT基因的表達量是在黑暗條件下進行積累的。

圖7 長日照處理下GhFT基因在葉片和根中的表達量
從圖8可以看出:在短日照處理下,GhFT基因在根中的最高表達量顯著高于在葉中的最高積累量;1 d內GhFT基因在根和葉片中的表達量變化呈晝夜節律現象。根中GhFT基因表達量在光照條件下(0~8 h)急劇下降,暗培養4 h后急劇上升至暗培養8 h(16 h)達到1 d內的最高點,然后急劇下降,暗培養12 h后達到1 d內的最低點,繼續暗培養又開始上升,說明在SD處理下根中GhFT基因表達是在暗培養條件下進行積累的。葉片中GhFT的mRNA水平與GUO D L等[15]的結果一致,在光照4 h后達到1 d內最高點,然后開始慢慢下降,直到暗培養12 h(20 h)后降至1 d內最低點,之后表達量逐漸上升,表明SD處理條件下葉片中GhFT基因的表達量是在光照培養開始前已經開始積累。

圖8 短日照處理下GhFT基因在葉片和根中的表達量
3 結論與討論
本研究利用生物信息學的方法從13個棉種中鑒定出了18個FT基因,這些基因具有相似的功能,其理化性質、保守基序沒有明顯差異,進化關系分析結果顯示同一類群的FT基因的基因結構和蛋白結構相似。定量分析結果顯示陸地棉TM-1不同組織中GhFT基因的表達量存在較大差異,GhFT基因在胚珠、根中表達量很低,在萼片中表達量較高,這與基于公共數據分析的FT基因的表達模式一致。東銳等[12]的研究表明FT基因在葉片和胚珠的表達量較高,這與本研究結果存在分歧,可能是光照時長差異造成的。針對FT基因的研究,通常情況下會選擇RNA含量和豐度較高的幼嫩葉片。本研究結果表明葉片越成熟,GhFT基因的表達量越高,同一葉片不同部位中的表達量不存在顯著差異,取樣時選擇成熟的葉片比選取初生的嫩葉進行定量分析結果更可靠,這對研究FT基因適宜取樣時期的選擇具有指導意義。本研究在分析葉片中GhFT基因的表達量隨葉齡變化的情況時未曾考慮衰老葉片,針對實驗完整性有待進一步補充驗證。
擬南芥和菊花FT同源基因的表達與日照長短息息相關,FT基因在不同的日照長度下mRNA轉錄水平不同,只在適宜開花的光照條件下才會積累。長日照屬性的擬南芥AtFT基因僅在長日照下積累,菊花CmFT基因是在短日照下有相對較高的積累,長日照處理下幾乎不表達[16]。本研究結果表明GhFT基因的表達同AtFT基因和CmFT基因一樣受光周期的影響,在LD處理下,GhFT基因在根中幾乎不表達,在葉片中具有相對較高的表達;在SD處理下,GhFT基因在葉片和根中均有表達,在根中的表達積累明顯高于LD處理下的,這可為研究GhFT基因實驗環境的選擇提供參考。棉花葉片和根中的GhFT基因表達量在不同的光照時間下表達量不同,并對光照時間長短存在響應機制[15],這與光周期誘導開花密切相關,具體調控機制有待進一步探索。

