利用 CRISPR/Cas9基因編輯技術構建水稻 ospin9突變體
吳世洋,楊曉祎,張艷雯,侯典云,胥華偉
河南科技大學農學院,河南洛陽 471000
0 引言
【研究意義】水稻(Oryza sativa L.)為世界一半以上人口提供糧食,是世界重要的糧食作物[1]。生長素極性運輸影響植物生長發育的多個方面,PIN基因是控制生長素極性運輸的關鍵基因[2-3]。因此,深入發掘 OsPINs的功能可為水稻重要農藝性狀的遺傳改良奠定基礎,為進一步通過CRISPR/Cas9等分子生物學技術調控生長素的運輸及分布并創制優質水稻種質資源奠定基礎。【前人研究進展】生長素是最早發現并被深入研究的植物激素[4],生長素的不均勻分布影響植物生長發育的多個方面,如胚胎發育、維管組織分化及根的發育等[5-7]。生長素的定向運輸也參與調控植物對環境刺激的響應,如光[8-9]及重力[10-14]等。生長素的不均勻分布由2種不同的運輸系統完成,一種是通過維管系統的快速運輸,一種是較慢的生長素極性運輸(polar auxin transport,PAT)。生長素的極性運輸至少由3類不同的蛋白家族協同完成:生長素輸入載體 AUXIN RESISTANT/LIKE RESISTANT(AUX1/LAX)[15]、生長素輸出載體蛋白家族 PIN-FORMED(PIN)[3]以及多重抗藥性/磷酸糖蛋白家族MDR/PGP(multidrug resistance-like/P-glycoproteins)[16-17],其中,PIN蛋白在調控生長素的極性運輸中起著關鍵作用[3],其在質膜上的極性定位在很大程度上決定了生長素的極性流向和梯度分布[18-19]。水稻中有12個PIN基因,包括4個OsPIN1、1個OsPIN2、3個OsPIN5、1個OsPIN8、1個OsPIN9和2個OsPIN10,其中OsPIN9、OsPIN10a和 OsPIN10b為單子葉植物所特有[20],OsPINs在不同組織和不同發育階段的差異表達共同調控生長素的不均勻分布[20-21]。目前對PIN基因功能的研究主要來自擬南芥[22],根據PIN蛋白中間親水環及定位的不同,可將其分為定位于質膜的長PIN(long PIN)和主要定位于內質網的短PIN(short PIN)[22],其中,長PIN的功能主要是將生長素運出細胞[23],而短PIN的功能主要是與類PIN蛋白(PIN-LIKE)協同調控胞內生長素的動態平衡[7,24-28]。與玉米(Zea mays)、高粱(Sorghum bicolor)及棉花(Gossypium hirsutum)等單子葉植物類似,OsPIN蛋白也主要分為長 OsPIN、短 OsPIN及OsPIN9[29-30]。近年來,部分OsPINs功能逐漸被闡明,如OsPIN1a和OsPIN1b是一對冗余基因,共同參與調控根的發育,影響幼苗及花的發育;而OsPIN1c和OsPIN1d是另一對功能冗余基因,共同參與調控稻穗的發育[31]。OsPIN2參與調控分蘗角度、分蘗數以及不定根數[32],同時還通過調控生長素的分布參與根的向重性反應[33-34],過表達OsPIN2可減輕鋁毒對細胞的傷害[35-36]。OsPIN5b定位于內質網,通過影響生長素的平衡、轉運和分布參與調控植物的構型及產量[37]。OsPIN10b(也被稱為OsPIN3t)參與調控水稻的抗旱性,同時也影響水稻不定根的正常發育[38]。OsPIN9作為單子葉植物特有的PIN基因,其功能直到最近才有報道。OsPIN9定位于質膜,主要在莖基部及分蘗芽中表達,受到銨的誘導表達,過表達OsPIN9可以提高水稻的分蘗數及產量[39]。研究表明,低氮也會誘導OsPIN9的表達,可能是低氮增加生長素的含量,而生長素又進一步激活了生長素信號途徑所導致[40]。這些結果均表明,OsPINs基因家族對水稻的正常發育及重要農藝性狀等都有重要影響,但相比擬南芥中的研究,OsPINs的研究仍有待深入。近年來,隨著基因編輯技術的日益成熟,利用基因編輯技術定點突變基因,研究基因功能,改良目標性狀基因,創制新的種質資源逐漸成為一條有效的途徑,其中成簇規律間隔短回文重復(clustered regulatory interspaced short palindromic repeat,CRISPR)是目前公認的最簡易高效的基因編輯工具[41-42]。【本研究切入點】HOU等[39]研究表明水稻 OsPIN9主要介導生長素的向下運輸,并參與調控水稻的分蘗數。但OsPIN9突變對水稻生長發育的影響,尤其是對幼苗期水稻生長發育的影響以及對其他OsPINs表達的影響尚不明確。【擬解決的關鍵問題】本研究以日本晴(Nipponbare)為材料,利用CRISPR/Cas9基因編輯技術獲得不同的轉基因株系,通過 PCR鑒定及測序獲得 OsPIN9發生突變的純合株系,基因編輯株系的OsPIN9表達量顯著低于野生型植株,突變體中 OsPIN1a和OsPIN5b表達上調,而OsPIN5a的表達下調,突變體的株高及不定根數量均受到顯著抑制。為進一步發掘OsPIN9的基因功能,利用OsPIN9創制新的種質資源奠定基礎。
1 材料與方法
1.1 材料
試驗于 2018—2020年在河南科技大學農學院進行。以水稻粳稻品種日本晴為材料,利用農桿菌介導法將植物表達載體T-DNA片段整合到水稻基因組。
大腸桿菌 DH10B 感受態細胞及農桿菌(Agrobacterium tumefaciens)EHA105感受態細胞由資源植物評價與創新利用實驗室自制。CRISPR/Cas9載體 CRISPR-RICE由中國科學院上海植物逆境生物學研究中心朱健康院士實驗室提供,具體載體信息如圖1所示。
限制性內切酶BsaⅠ購自NEB公司,T4連接酶及高保真Taq酶PrimeSTAR等購自TaKaRa,質粒提取試劑盒、瓊脂糖凝膠回收試劑盒等購自OMEGA。引物由上海生工生物工程有限公司合成。
1.2 基因編輯載體的構建
利用華南農業大學劉耀光院士團隊開發的CRISPRGE進行靶位點的設計[43]。在 CRISPR-GE網站(http://skl.scau.edu.cn/)輸入OsPIN9基因組序列,獲得多個CRISPR/Ca9前間隔序列臨近基序(protospacer adjacent motif,PAM)上游20個堿基的序列,選擇預測的編輯效率較高且位于編碼區的序列作為靶位點,進一步通過水稻全基因組 BLAST比對分析驗證靶位點的特異性。在上下游引物的5′端分別添加接頭序列TGTGT和 AAAC,用于將目的片段連入 CRISPRRICE載體。
通過引物退火合成目的片段,反應體系為10 μmol·L-1上下游引物PIN9-CRISPR-F和PIN9-CRISPR-R各1 μL和8 μL ddH2O。退火條件為95℃ 10 min,然后以0.1℃·s-1降溫至 20℃,產物-20℃保存備用。配制 10 μL的連接體系:經 BsaⅠ酶切的 CRISPR-RICE載體約50 ng、T4連接酶緩沖液1 μL、T4連接酶1 μL、退火產物3 μL,加水補至10 μL。16℃連接過夜后轉化大腸桿菌感受態細胞 DH10B。通過 M13-F和PIN9-CRISPR-R擴增OsU6啟動子篩選陽性克隆(圖1)。通過凍融法將重組載體轉入農桿菌 EHA105用于水稻遺傳轉化。
1.3 基因編輯株系的靶位點分析
通過農桿菌介導法獲得T0抗性植株,進一步通過 PCR利用特異引物(HPT-F和 HPT-R,表 1)擴增HPT片段篩選獲得轉基因陽性植株。參考OsPIN9基因組序列,在靶位點兩側設計引物PIN9-Assay-F和PIN9-Assay-R(表1),通過高保真Taq酶 PrimeSTAR擴增OsPIN9片段,PCR產物送上海生工生物工程有限公司測序,通過 CRISPR-GE分析測序結果的突變類型[44]。T1水稻篩選鑒定方法同上。
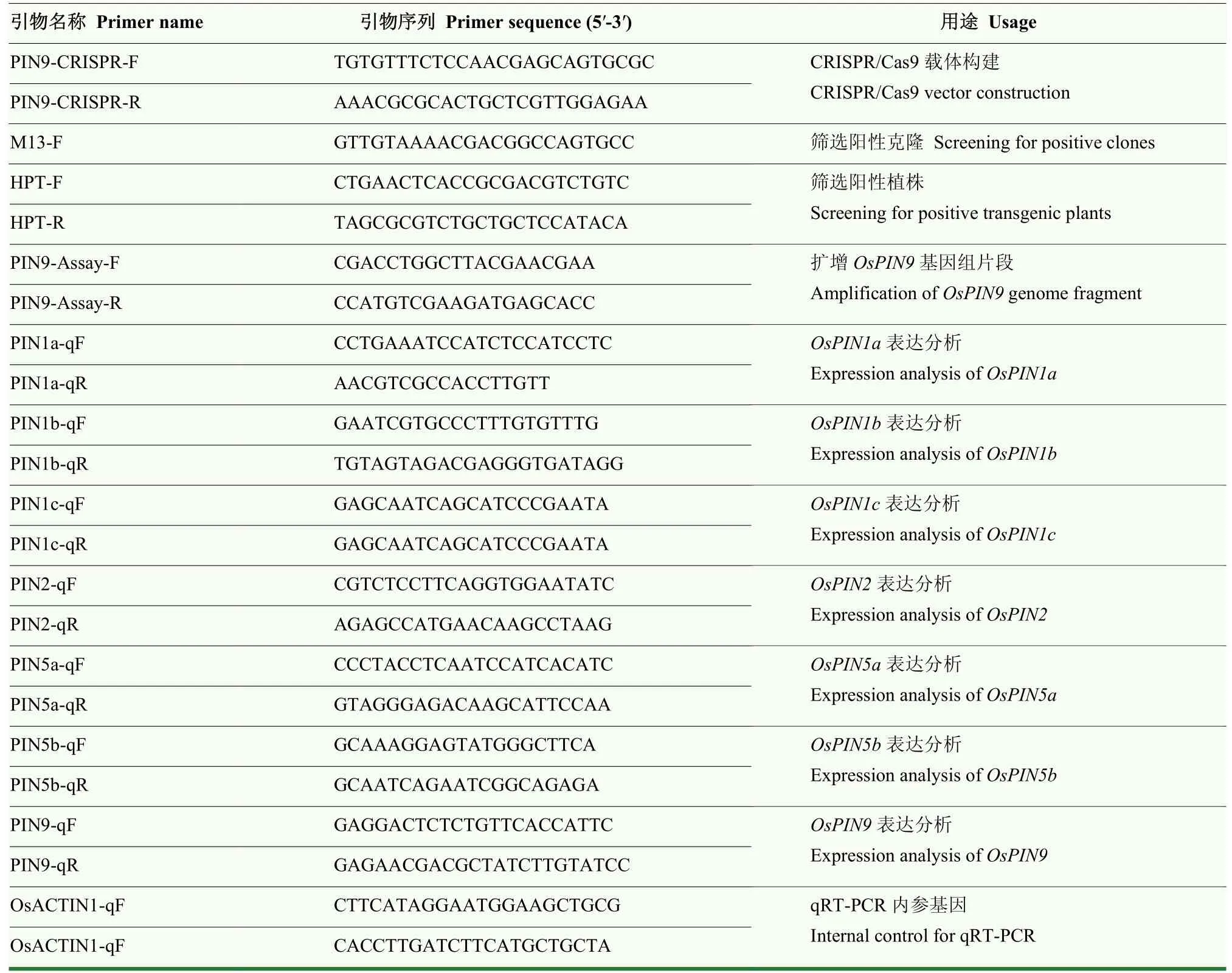
表1 引物及序列Table 1 The primers and sequence in this study
1.4 生物信息學分析及OsPIN基因表達分析
以MEGA7進行蛋白序列比對[45],比對結果進一步通過Jalview進行修飾[46]。通過在線網站(TMHMM Server v. 2.0: http://www.cbs.dtu.dk/services/TMHMM/)分析蛋白的跨膜螺旋結構域[47]。通過SWISS MODEL網站(https://swissmodel.expasy.org/)預測蛋白三級結構[48]。
OsPIN9主要在根及根莖結合部表達,此外,水稻根中還檢測到OsPIN1a、OsPIN1b、OsPIN1c、OsPIN2、OsPIN5a和OsPIN5b的表達[20],以14 d幼苗根為材料對目的基因及根中OsPINs進行qRT-PCR表達分析。用RNAiso Plus(TaKaRa BIO INC)提取總RNA,運用 HiScript III RT SuperMix for qPCR(+gDNA wiper)(南京諾唯贊生物科技股份有限公司)反轉錄得到cDNA。使用AceQ Universal SYBR qPCR Master Mix(南京諾唯贊生物科技股份有限公司)在Lightcycle?96 qPCR儀上進行qRT-PCR分析,以水稻OsACTIN1(Os03g0718100)作為內參,以 2?ΔΔCT法計算基因的相對表達量。試驗進行3次生物學重復,每次3個技術重復。所用引物見表1。
1.5 ospin9突變體表型分析
挑選飽滿一致的水稻種子浸種2 d,然后將稻種放在鋪有兩層濕潤濾紙的培養皿中,放置于30℃培養箱中暗處理催芽,其間注意保持濾紙的濕潤。待稻種催芽露白后,將稻種點播到96孔板中,以木村B營養液培養[49],每3天更換一次營養液,培養至14 d時,統計其株高、根長及不定根數。
NAA處理試驗:種子浸種2 d,然后在含有0.05 μmol·L-1NAA的木村B營養液中繼續培養7 d,統計株高和不定根數。數據以GraphPad Prism 8.0進行單因素方差分析及Tukey法進行多重比較,顯著性水平為P<0.05。
2 結果
2.1 基因編輯表達載體的構建
以日本晴基因組序列為模板序列,以水稻OsPIN9(Os01g0802700)的第1外顯子為靶點,利用CRISPRGE在線分析工具設計20 bp的靶位點序列(圖2-A),通過退火形成Oligo二聚體,將其與CRISPR-RICE連接,通過引物 M13-F和 PIN9-CRISPR-R擴增 OsU6啟動子篩選獲得陽性克隆,目的片段長度為291 bp(圖2-B),進一步提取質粒通過測序確認獲得重組CRISPR/Cas9載體,將其轉化至農桿菌感受態EHA105后進行遺傳轉化。
2.2 轉基因株系的突變類型分析
通過農桿菌介導法獲得18株獨立的轉化植株。通過HPT-F和HPT-R擴增HPT片段確認獲得轉基因植株(圖 3-A)。為鑒定目的基因是否發生突變,提取轉化植株葉片基因組 DNA,以引物對 PIN9-Assay-F和PIN9-Assay-R利用高保真Taq酶PrimeSTAR擴增OsPIN9靶位點相鄰序列并測序。結果表明,18株T0轉基因株系中有3種不同的突變方式,均為不同單堿基插入突變,插入位置均為靶位點的18位堿基處。其中,插入T堿基的共有3株,插入C堿基的共有1株,插入G堿基的共有3株,共獲得基因編輯株系7株。為排除Cas9的潛在干擾,進一步提取T1轉基因植株基因組DNA,篩選無轉基因片段的突變體。結果表明,在插入T和G堿基的突變體中,分別篩選到5株和3株不含HPT的植株,進一步擴增OsPIN9片段并測序,確認突變特性與 T0一致,因此,獲得純合突變植株ospin9-1和ospin9-2(圖3-B)。
2.3 ospin9純合突變體氨基酸序列及蛋白跨膜結構域和三級結構分析
利用CRISPR/Cas9基因編輯系統,對OsPIN9進行靶位點特異性編輯,并篩選鑒定到2個純合突變株系。蛋白序列比對結果表明,ospin9-1突變體由于在OsPIN9編碼區第117位堿基處插入一個堿基對T,引起了移碼突變并使翻譯提前終止,突變基因開放閱讀框為519 bp,共編碼 172個氨基酸,其中,前 39個氨基酸與野生型OsPIN9一致。ospin9-2突變體同樣也是在編碼區117位堿基處插入一個堿基對G,引起移碼突變和翻譯提前終止,其突變基因的開放閱讀框也是519 bp,但其前38個氨基酸與野生型一致。PIN蛋白為典型的跨膜蛋白,其生物學功能依賴于其跨膜螺旋結構域(transmembrane helices,TMH)[50]。跨膜螺旋結構域分析表明野生型OsPIN9蛋白含有10個跨膜螺旋結構域,ospin9突變體中除了第一個跨膜螺旋對應的氨基酸序列與野生型 OsPIN9蛋白一致外,其余跨膜螺旋對應的氨基酸序列都發生了改變甚至完全消失(圖4)。
雖然蛋白質序列比對分析表明突變體中 OsPIN9蛋白第一個跨膜螺旋結構域對應的氨基酸序列與野生型OsPIN9蛋白一致(圖4),但跨膜螺旋結構域分析表明OsPIN9突變蛋白的跨膜螺旋結構域完全消失(圖5-A)。蛋白質三級結構預測表明,突變體OsPIN9蛋白的三級結構更加簡單,與野生型的完全不同(圖5-B)。綜上,一系列分析表明OsPIN9在核酸及蛋白水平都發生了突變,很可能影響了OsPIN9的功能。
2.4 ospin9突變體中OsPIN基因的表達分析
以幼苗根為材料進行目的基因表達分析,結果表明,2種ospin9突變體中OsPIN9的表達量都明顯低于野生型,分別降低了64%和79%(圖6)。同時,ospin9突變體中 OsPIN5a的表達明顯降低,尤其是ospin9-2突變體中,OsPIN5a的表達降低了99%;而OsPIN1a和OsPIN5b的表達在2種ospin9突變體中則不同程度地上調(圖6),其他幾個OsPINs(OsPIN1b、OsPIN1c和OsPIN2)的表達未見顯著變化(結果未顯示)。
2.5 ospin9突變體的表型分析
14 d幼苗的表型分析結果表明,ospin9突變體的株高顯著低于野生型,2個突變株系的株高比野生型分別降低16%和14%,不定根數目也顯著少于野生型,分別比野生型減少10%和11%(圖7),但根長和野生型沒有顯著差異,表明 OsPIN9對于水稻幼苗地上部和地下部的正常生長發育都起著重要作用。
前期研究表明 OsPIN9突變導致水稻地上部生長素含量提高而地下部生長素含量降低[39],這有可能是導致突變體與野生型表型差異的主要原因之一,進一步以NAA處理野生型和ospin9突變體進行表型分析。結果表明,NAA處理抑制了野生型植株地上部的生長(圖8-A和圖8-C)而促進了不定根的發生(圖8-B和圖8-D)。NAA處理后,ospin9突變體株高仍顯著低于野生型植株(圖 8-C),而不定根數雖仍少于野生型植株,但差異已不顯著(圖8-D)。
3 討論
隨著CRISPR/Cas9基因編輯技術的飛速發展,其易于構建,成本低廉,具有較高特異性及編輯效率等優點日益突出[42]。近年來,中國科學家在重要農作物基因編輯領域取得了長足進展,如華南農業大學劉耀光院士團隊開發的多基因編輯系統可用于單子葉和雙子葉植物基因編輯[51],中國科學院上海植物逆境生物學研究中心朱健康院士團隊開發的用于水稻多基因編輯的 CRISPR-Cpf1系統[52]以及中國科學院遺傳與發育生物學研究所高彩霞研究員團隊開發的用于小麥基因編輯的無轉基因成分的基因編輯系統等[53-54]。尤其是CRISPR/CaS9基因編輯系統,在基因功能研究及作物品質改良等方面的應用越來越廣泛,如利用CRISPR/Cas9技術成功編輯水稻香味基因Badh2[41]、水稻溫敏不育基因TMS5[55-56]、水稻ROP基因OsRac5等[57],同時CRISPR/Cas9在定向改良水稻稻瘟病抗性[58]、創制低鎘秈稻[59]、創制長粒香型水稻[60]以及提高水稻耐逆性[61]等方面都取得了成功。
PIN基因屬于多基因家族,且PIN基因之間存在功能冗余[31],對于這種多基因家族的功能研究,以前多采用RNA干涉的方法,如XU等[62]以過表達和RNA干涉的方法研究了OsPIN1b的功能,結果表明,RNA干涉植株不定根的發育受到嚴重抑制,同時其分蘗角度顯著增大,而以 CRISPR-Cas9技術定點突變OsPIN1b所得到的ospin1b突變體卻無明顯表型[31],這可能是由于OsPIN家族成員之間核苷酸水平具有較高的相似性,而 RNA干涉不特異造成的,說明對于研究核苷酸水平相似性較高的家族基因,CRISPR/Cas9技術可能更加適合。OsPIN9是單子葉植物特有的PIN基因,單子葉植物PIN基因功能的研究仍遠落后于雙子葉植物尤其是擬南芥PIN基因功能的研究。最近的研究表明,OsPIN9蛋白定位于細胞質膜,主要在控制水稻不定根發育及分蘗數目方面發揮作用[39]。但OsPIN9既不屬于長PIN,也不屬于短PIN[29-30],說明其蛋白結構與這兩類 PIN有較大的不同,除了介導生長素的極性運輸外,很可能具有其他的未知功能[50]。本研究中通過 CRISPR/Cas9基因編輯技術定點突變OsPIN9,獲得ospin9純合突變體,蛋白質序列分析表明突變體中OsPIN9蛋白長度小于野生型OsPIN9,其跨膜螺旋結構域消失,三級結構也更為簡單,同時OsPIN9表達量也顯著低于野生型植株,說明OsPIN9在核酸水平和蛋白水平均發生了突變。PIN基因之間存在功能冗余,故很多PIN基因突變體沒有明顯的表型[31],OsPIN9的突變導致OsPIN1a和OsPIN5b的表達量上調,說明OsPIN1a和OsPIN5b很可能與OsPIN9之間存在冗余關系,共同調控根的發育;而 OsPIN9的突變導致 OsPIN5a表達受到抑制,說明 OsPIN5a和 OsPIN9之間很可能是以協同表達的模式調控植物的生長發育。前期研究表明 OsPIN9主要在根及根莖結合部表達,GUS染色進一步表明OsPIN9主要在不定根原基以及根莖結合部的中柱細胞中表達,暗示OsPIN9很可能在不定根的發育中發揮作用[20]。本研究表明,OsPIN9的突變不僅影響了水稻不定根的發育,也影響了幼苗地上部的發育。OsPIN9的突變影響了生長素由地上部向地下部的運輸,導致根部生長素含量下降[39],NAA處理能促進野生型植株不定根的發生,同時可以部分恢復ospin9突變體中不定根數的減少,表明根部生長素的含量會影響不定根的發生,ospin9突變體不定根數的減少很可能是由于生長素含量的降低引起的;同時 OsPIN9的突變很可能也會影響生長素的不均勻分布,這也有可能影響不定根的發育。而地上部生長受阻很可能是由于地上部生長素的積累以及不定根減少這兩方面的原因共同引起的。除了影響不定根的發育外,OsPIN9很可能也參與其他植物激素調控的根的發育,如 ABA可以促進水稻根毛生長,同時ABA又可以顯著誘導OsPIN9的表達,暗示OsPIN9可能在ABA介導的根毛發育中起著重要作用[63]。此外,OsPIN9很可能還參與調控植物的非生物逆境脅迫,如高溫脅迫可以誘導稻穗中 OsPIN9的表達,說明OsPIN9可能參與調控水稻的高溫抗性[64]。砷和一氧化氮供體硝普化鈉(sodium nitroprusside,SNP)的共同處理可以顯著誘導 OsPIN9的表達[65],說明OsPIN9可能在介導NO緩解植物砷脅迫中發揮作用。
綜上,OsPIN9參與調控水稻不定根及地上部的發育,但其內在的調控機理及 OsPIN9是否參與調控其他生長發育進程等仍有待進一步研究。ospin9純合突變體的獲得為進一步研究OsPIN9在響應環境信號、逆境脅迫、參與激素網絡調控等方面的作用奠定了基礎,也為進一步利用雜交技術獲得 OsPINs的雙突等突變體,克服 OsPINs的功能冗余,更全面地研究OsPINs功能提供了材料。
4 結論
利用CRISPR/Cas9基因編輯技術,對水稻生長素輸出載體基因 OsPIN9進行定點突變,獲得無轉基因成分的純合株系,突變蛋白的跨膜螺旋結構域完全消失,利用CRISPR/Cas9技術可以特異性定點突變多基因家族基因。OsPIN9突變影響其他OsPINs的表達,且OsPIN9在水稻幼苗的生長發育中起著重要作用。

