夏枯草對膠質瘤U87細胞凋亡與增殖的影響?
杜 康, 曹 勇, 劉 彪, 謝 磊, 鄭慧軍
(1.河南中醫藥大學, 鄭州 430052;2.河南中醫藥大學第二附屬醫院神經外科,鄭州 430052)
膠質瘤是顱內發病率最高的惡性腫瘤,主要治療方式為手術、放化療[1],但患者5年生存率仍然較低,且副作用較大。已有報道,夏枯草對乳腺癌、甲狀腺癌、食管癌等多種惡性腫瘤具有良好的治療作用[2,3],但對膠質瘤的治療作用尚無研究。本實驗擬考察夏枯草溶液對膠質瘤U87細胞增殖與凋亡的影響。本研究已通過河南中醫藥大學實驗動物倫理委員會審查。
1 材料與方法
1.1 藥物
夏枯草配方顆粒,購自四川新綠藥業有限公司(5 g/盒)
1.2 腫瘤細胞及實驗動物
膠質瘤U87細胞(以下簡稱瘤細胞)購自上海中國科學院細胞庫。雄性小鼠裸鼠,4周齡,購自南京醫科大學動物中心。實驗前所有裸鼠(BALB/cA-nu)在無病毒(SPF)環境中飼養,室溫為26 ℃~28 ℃(78~820F),相對溫度保持在40%~60%,每日約維持10 h光照,14 h無光的明暗周期,提供無菌食物和水(所有操作均在無菌條件下進行)。動物實驗開始之前,將裸鼠(BALB/cA-nu)按體質量隨機分為模型組、夏枯草低、中和高劑量組,在新的環境中飼養1周。
1.3 試劑
MEM培養基(博士德生物科技有限公司);Phosphate Buffered Saline(Biological Industries);胎牛血清(Biological Industries);青鏈霉素雙抗混合液(Beijing Solarbio);CCK-8試劑盒(上海同仁化學科技有限公司);凋亡試劑盒(凱基生物);BCA蛋白測定盒(武漢博士德生物技術有限公司);Bax、Bcl-2、Cleaved-Caspase-3、Cleaved-Caspase-9、Ki-67單克隆抗體均購自武漢三鷹生物技術有限公司;PCR逆轉錄試劑盒(大連寶生生物工程有限公司);mRNA提取試劑盒(上海生工生物有限公司);Bcl-2、Bax、Caspase-3及Caspase-9的引物均委托上海生工生物有限公司合成。
1.4 實驗儀器
CO2恒溫培養箱(HERAcell160i-美國Thermo Scientific HERAcell160i CO2培養箱);流式細胞儀(美國BD FACSJazz);超微量核酸蛋白測定儀(中國One Drop 公司 Nano Drop One/One C);酶標儀(賽默飛世爾(上海)儀器有限公司 318C);基因擴增儀(美國BIO-RAD公司 T100);蛋白凝膠成像系統(BIO RAD Industries ChemiDoc XRS)。
1.5 實驗方法
1.5.1 夏枯草溶液的制備 將10 g夏枯草配方顆粒溶于20 ml MEM培養基中超聲波震蕩15 min,4 ℃ 1200 r/min離心10 min,保留上清液,以0.22 μm孔徑的無菌濾器過濾,-20 ℃層凍存,夏枯草濃度約為40 mg/ml(生藥/ml)。
1.5.2 膠質瘤U87細胞培養 將膠質瘤U87細胞放入恒溫培養箱(37 ℃、5%CO2)中培養12 h,以胰酶消化并離心,按1×106個細胞密度接種于25 cm2培養瓶中,加入MEM培養液(含10%胎牛血清,1%青鏈霉素雙抗混合液)4 ml,放入恒溫培養箱中培養(37 ℃、5%CO2),待膠質瘤U87細胞長滿瓶底進行傳代(約每48~72 h傳1次),取對數生長期的膠質瘤U87細胞進行實驗。
1.5.3 膠質瘤U87細胞分組 將膠質瘤U87細胞接種在96孔板中,將其分為6組,每組設6個復孔。對照組正常培養液培養;夏枯草低、中和高劑量組將夏枯草溶液采用培養液進行稀釋,使得每孔的終濃度分別為0.5 mg/ml、1 mg/ml、2 mg/ml。
1.5.4 平板克隆實驗檢測夏枯草藥物對細胞增殖的影響 將膠質瘤U87細胞按照每孔800個細胞接種于6孔板,加入夏枯草低、中和高劑量,5%CO2,37 ℃的培養箱中培養14 d,結晶紫溶液染色后于顯微鏡下行各組細胞集落計數。
1.5.5 CCK-8檢測夏枯草藥物毒性對細胞增殖的影響 將膠質瘤U87細胞按照每孔1×104個細胞接種于96孔板,5%CO2,37 ℃的培養箱中培養24 h,向96孔板中加入夏枯草低、中和高劑量溶液,每個濃度設6個復孔。24 h后每孔中加入10 μl CCK-8溶液,10 min后分別用酶標儀檢測各組在450 nm處的吸光度值。
1.5.6 顯微鏡下對膠質瘤U87細胞生長狀態觀察 各組細胞培養加藥干預24 h后,倒盡培養基,采用PBS洗2遍,常溫干燥,采用75%乙醇固定,5%結晶紫溶液染色2 h,顯微鏡下觀察,計數各組細胞聚集成團的個數,≥50個細胞為1個細胞集落。
1.5.7 流式細胞儀檢測U87細胞凋亡率 各組細胞培養加藥干預24 h后,用不含EDTA的0.25%胰酶消化,按照每管1×105~5×105個細胞,收集至2 ml離心管中,2000r/min離心5 min,加入1.5 ml PBS液洗滌細胞,2000r/min離心5 min,重復上述洗滌操作2遍。依次加入500 μl的Binding Buffer懸浮細胞、5 μl Annexin V-FITC、5 μL Propidium lodide混勻。室溫下避光反應5~15 min,反應完成后在1 h內完成流式細胞儀對各組膠質瘤U87細胞凋亡率的檢測。
1.5.8 RT-PCR檢測膠質瘤U87細胞凋亡基因的表達 細胞加藥干預24 h后,提取細胞總RNA,測定細胞總RNA濃度及純度。對RNA進行逆轉錄:以1 μg RNA合成的cDNA,以GAPDH作為內參基因,分別擴增Bcl-2、Bax、Caspase-3、Caspase-9基因。當基因擴增反應結束時,從65 ℃緩慢加熱至95 ℃,將PCR溶解產物的溶解曲線建立。采用2-△△CT相對定量法,計算各組基因的表達情況,同時對各組數據進行進行統計分析。
1.5.9 Western Blot檢測凋亡相關蛋白 各組細胞培養加藥干預24 h后,提取細胞總蛋白,蛋白定量、配置蛋白膠,蛋白上樣電泳,蛋白轉膜后進行封閉,抗體孵育。孵育完成后,將蛋白膜放入ECL發光液中搖動3 min,利用Image Lab系統進行曝片,以GAPDH作為內參,檢測各組Bcl-2、Bax、Cleaved-Caspase-3、Cleaved-Caspase-9凋亡相關蛋白表達。
1.5.10 小鼠皮下成瘤模型建立、給藥及指標檢測 將4周大的雄性小鼠裸鼠(BALB/cA-nu)按體質量隨機分為模型組、夏枯草低、中和高劑量組4組,分別為1.8 g/kg組、3.6 g/kg組、5.4 g/kg組每組各4只。將U87細胞(每側1×106細胞/100μl)皮下注射到小鼠側腹。接種后每隔1 d按組別給小鼠灌胃給藥,給藥容積為0.1 ml/10 g,對照組灌胃給予生理鹽水。每6 d測量腫瘤大小,持續30 d(給藥15 d)。使用公式(width2×length)/2計算腫瘤體積。30 d后對小鼠實行安樂死取皮下瘤,行Ki-67免疫組化染色,Ki-67染色陽性細胞百分率即為增殖指數。
1.6 統計學方法
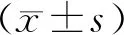
2 結果
2.1 夏枯草對瘤細胞增殖的影響
圖1示,與對照組比較,夏枯草組的瘤細胞集落數量減少、活性降低(P<0.05),且呈劑量依賴性降低,說明夏枯草可抑制瘤細胞增殖。

注:A.平板克隆實驗;B.細胞集落數量;C.CCK-8檢測;NC.對照組;1.夏枯草低劑量組;2.夏枯草中劑量組;3.夏枯草高劑量組;與對照組比較:*P<0.05;與夏枯草低劑量組比較:%P<0.05;與夏枯草中劑量組比較:&P<0.05
2.2 夏枯草對瘤細胞生長狀態的影響
圖2示,對照組瘤細胞成團約2~3個,夏枯草低劑量組成團約0~1個,夏枯草中及高劑量組均未見成團,隨著夏枯草劑量增加,細胞數量有減少趨勢,表明夏枯草可抑制瘤細胞增殖。
注:NC.對照組;1.夏枯草低劑量組;2.夏枯草中劑量組;3.夏枯草高劑量組
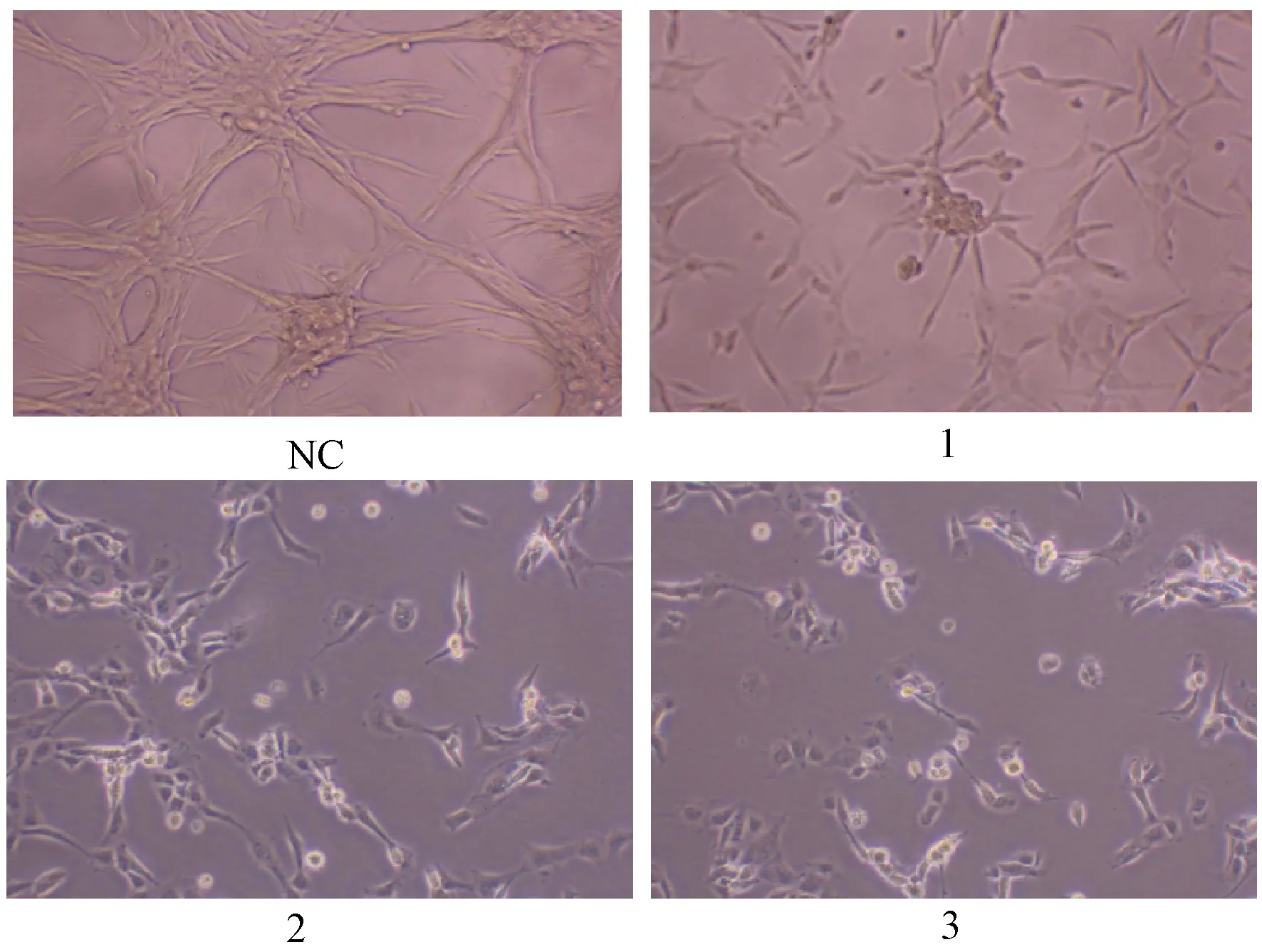
2.3 流式細胞術檢測夏枯草誘導瘤細胞凋亡
圖3示,與對照組比較,夏枯草組的凋亡細胞數增多(P<0.05),且劑量呈依賴性增高趨勢。
注:與對照組比較:*P<0.05;與夏枯草低劑量組比較:%P<0.05;與夏枯草中劑量組比較:&P<0.05;NC.對照組;1.夏枯草低劑量組;2.夏枯草中劑量組;3.夏枯草高劑量組
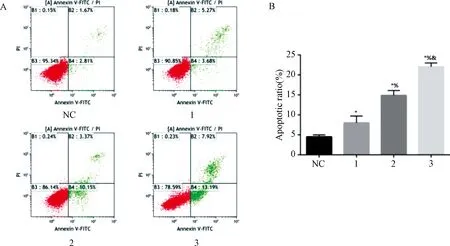
2.4 夏枯草對Bax、Bcl-2、Caspase-3(Cleaved-Caspase-3)、Caspase-9(Cleaved-Caspase-9)及Bcl-2表達的影響
圖4示,與對照組比較,夏枯草組的Bax mRNA及蛋白、Caspase-3、Caspase-9 mRNA、Cleaved-Caspase-3、Cleaved-Caspase-9蛋白表達均增加,Bcl-2 mRNA及蛋白表達均降低(P<0.05),且呈劑量依賴性趨勢。夏枯草溶液可調節凋亡相關因子,如Bax、Cleaved-Caspase-3、Cleaved-Caspase-9及Bcl-2表達促進瘤細胞凋亡。
注:與對照組比較:*P<0.05;與夏枯草低劑量組比較:%P<0.05;與夏枯草中劑量組比較:&P<0.05;NC.對照組;1.夏枯草低劑量組;2.夏枯草中劑量組;3.夏枯草高劑量組
2.5 夏枯草對在小鼠皮下成瘤的抑制作用
圖5示,與模型組比較,夏枯草組皮下瘤體積均降低,皮下瘤Ki-67表達及增殖指數均降低(P<0.05),且呈劑量依賴性降低趨勢。

注:與對照組比較:*P<0.05;與夏枯草低劑量組比較:%P<0.05;與夏枯草中劑量組比較:&P<0.05;MODEL.模型組;1.夏枯草低劑量組;2.夏枯草中劑量組;3.夏枯草高劑量組
3 討論
夏枯草通過促進癌細胞凋亡,抑制癌細胞的增殖與遷移,達到對多種惡性腫瘤的抗癌效果[4]。本研究分別以瘤細胞及該細胞接種的裸鼠為研究對象,結果顯示夏枯草可抑制膠質瘤細胞及瘤組織的增殖,均呈劑量依賴性關系,也印證了文獻的觀點。
夏枯草的抗癌機制較復雜[5,6],一是夏枯草提取物可以通過P53通路促進畸胎瘤細胞的凋亡,抑制其增殖;二是夏枯草可提高結腸癌細胞對氟尿嘧啶的敏感性,提高結腸癌細胞的凋亡率;三是夏枯草的乙醇提取液可以促進結腸癌細胞的凋亡,抑制膠質瘤細胞的增殖。本實驗將瘤細胞與夏枯草低、中和高劑量共培養24 h,夏枯草組的瘤細胞集落數量逐漸減少,細胞活性降低,凋亡細胞數增多,凋亡相關基因Bax、Caspase-3、Caspase-9 mRNA表達增加,抗凋亡基因Bcl-2 mRNA表達降低,凋亡相關基因Bax、Cleaved-Caspase-3、Cleaved-Caspase-9蛋白表達均增加,Bcl-2 蛋白表達降低,均呈夏枯草劑量依賴性趨勢。小鼠皮下瘤體積試驗示,與模型組比較,夏枯草組皮下瘤體積均降低,皮下瘤Ki-67表達及增殖指數均降低,提示夏枯草可用于治療膠質瘤,與其所含的有效成分相關[7-9]。如夏枯草含有大量β-谷甾醇、豆甾醇、菠甾醇及槲皮素且均有明確的抗癌效果,其口服生物利用度≥36%;夏枯草所含的齊墩果酸可調節Caspase-3途徑或抑制MAPK/ERK 信號通路,抑制顱內膠質瘤增殖、遷移和侵襲。
文獻報道,將夏枯草注射液用于治療臨床惡性腫瘤患者,提示夏枯草口服難以通過血腦屏障[10]。劉泰[11]等將夏枯草納入傳統方劑五苓散中,夏枯草具有保護血腦屏障及消除腦血管源性水腫等效果,提示夏枯草有效成分可穿越血腦屏障。盡管本研究顯示,夏枯草灌胃給藥可降低小鼠皮下成瘤的體積,抑制促瘤蛋白Ki-67表達及增殖指數,尚無明確數據證實膠質瘤血腦屏障對夏枯草發揮抗癌效果。
夏枯草通過調控Bax mRNA及蛋白、Bcl-2 mRNA及蛋白、Caspase-3 mRNA、Caspase-9 mRNA、Cleaved-Caspase-3、Cleaved-Caspase-9表達抑制膠質瘤U87細胞增殖,促進凋亡,且呈夏枯草劑量依賴性趨勢。

