基于網絡藥理學可視化及實驗驗證益腎補血中藥治療前列腺癌的作用機制研究?
劉 偉, 劉平安, 楊 磊, 郭 璇△, 李 媛, 唐旖雯, 劉德果
(1.湖南中醫藥大學,長沙 410208;2.湖南中醫藥大學第一附屬醫院,長沙 410000)
據世界衛生組織(worldhealth organization,WHO)公布的流行病學最新數據顯示,前列腺癌(prostate cancer,PCa)發病率高居男性惡性腫瘤的第二位,病死率位居第三位,而多數患者發病年齡在55~80周歲之間[1]。在我國,2007年男性PCa的發病率為8.31/10萬,至2017年其發病率上升至17.63/10萬,10年間每年增長幅度為21.22%[2],提示中國該病的發病率正持續快速增長,而中老年人群(55~80周歲)的年均增長幅度高達26.38%[3],但目前尚無確切有效的治療手段[4]。諸多研究表明,中醫藥在改善PCa患者具體癥狀、調控其精神心理狀態等方面具有明顯的療效[5]。胡楊等[6]研究表明,中藥可能是通過多靶點、多通路調控細胞周期,促進細胞凋亡治療惡性腫瘤,采用網絡藥理學方法可將中藥治療疾病的數據進行可視化分析。
中醫古籍并無本病的記載,但根據其臨床表現及病機屬于中醫學“癥瘕”“癃閉”“尿血”等范疇[6]。中醫學認為PCa病在男性之精竅,與腎、脾、肝等臟密切相關。安婉麗[7]等借助關聯規則分析、復雜系統熵聚類分析等數據挖掘方法,對治療PCa的方劑進行挖掘,其中益腎補血類藥物出現頻次占總藥物頻次的76%,其中尤以淫羊藿、三七、當歸等藥物為最。淫羊藿可益精氣、補命門之火,為溫陽補腎之要藥;三七可活血祛瘀、益氣通絡;當歸可補血活血,三藥合用溫陽活血、扶正祛邪,治療PCa符合《難經·五十五難》:“積者,陰氣也”[9],以及《素問·調經論》:“血氣者,喜溫而惡寒,寒則泣而不能流,溫則消而去之”對惡性腫瘤的論述。前期臨床研究表明,以益腎補血中藥為主要藥物的方劑,可有效抑制PCa進展及轉移,但其具體作用機制尚未明確[10]。為明確益腎補血中藥治療PCa的生物學機制,本文基于網絡藥理學研究方法,對益腎補血中藥治療PCa的的生物學物質基礎及藥效機制進行預測,并借助細胞實驗進行驗證,以期對益腎補血中藥治療PCa的科學內涵進行探討,同時為闡明益腎補血中藥治療PCa的具體機制提供新思路及新方法。
1 材料與方法
1.1 網絡藥理學預測部分
1.1.1 篩選益腎補血中藥有效活性成分與藥物靶點基因 本研究借助中藥系統藥理學分析平臺(TCMSP)(http://tcmspw.com/)及中醫藥綜合數據庫(TCMID)(http://www.megabionet.org/tcmid/)等檢索3味經典益腎補血中藥(淫羊藿、三七、當歸)的藥物有效活性成分與藥物靶點基因。TCMID數據庫作為備用數據庫,若藥物未收錄在TCMSP數據庫時采用此數據庫進行篩選[11]。篩選標準為OB>30%,DL>0.18,HL>4 h。之后選擇TCMSP數據庫的“Related Targets”模塊,得到上述藥物的所有藥物靶點基因。
1.1.2 獲取PCa疾病靶點基因 以“Prostate cancer”為關鍵詞,在GeneCards數據庫(https://www.genecards.org)以及在線人類孟德爾遺傳數據庫(OMIM)(https://omim.org/)中進行檢索。在完成關鍵詞檢索后將上述2個數據庫獲得的PCa相關基因進行合并,剔除重復項后建立“PCa疾病靶點基因數據庫”備用。將上述藥物的靶點基因與PCa疾病靶點基因進行映射,獲得益腎補血中藥治療PCa的靶點基因。
1.1.3 “藥物-疾病-靶點”網絡構建與分析 借助Cytoscape 3.6.1軟件將益腎補血中藥治療PCa的靶點基因和步驟1.1.2篩選獲得的藥物活性成分進行映射,構建“成分-靶點”網絡;借助STRING平臺(https://string-db.org)及CentiScape插件對蛋白質-蛋白質間的關系進行分析,構建蛋白-蛋白相互作用(PPI)網絡,展示其中的關鍵靶基因。
1.1.4 基因功能注釋(gene ontology,GO) 和京都基因與基因組百科全書(kyoto encyclopedia of genes and genomes,KEGG)富集分析 借助Enrichr數據庫,經校正后P值(Adjusted P-value)<0.01、關聯度(Degree)>15的作用進行GO富集分析及KEGG富集分析,進而預測益腎補血中藥治療PCa的可能藥效機制。
1.2 細胞實驗驗證部分
1.2.1 細胞系與細胞培養 人PCa LNCaP細胞購自中國科學院細胞庫(目錄號:TCHu173)。LNCaP細胞于37 ℃、5% CO2培養箱環境中用含10%胎牛血清的McCoy's5A培養基進行培養。
1.2.2 藥物制備與給藥 本研究所使用的益腎補血中藥(淫羊藿、三七、當歸)全部購于湖南中醫藥大學第一附屬醫院中藥房,均為道地藥材,按1∶1∶1的比例分別取15 g,將所有中藥加入10倍量的水煎煮2次,每次1.5 h。過濾,濾液旋轉蒸發濃縮,按照生藥劑量使終末濃度為1.5 g/ml(1倍等效人體劑量),調整pH7.2,過0.22 μm濾膜除菌,-20 ℃冰箱保存。實驗前加入McCoy's5A培養基中,稀釋至所需要濃度。研究組將人PCa LNCaP細胞共設置4組,分別為模型組、中藥高劑量組、中藥中劑量組、中藥低劑量組,其中模型組為PCa LNCaP細胞給予等濃度的McCoy's5A培養基,中藥高、中、低劑量組分別為PCa LNCaP細胞給予3.0 g/ml/d(2倍等效人體劑量)、1.5 g/ml/d(1倍等效人體劑量)、0.75 g/ml/d(0.5倍等效人體劑量)的益腎補血中藥培養基。各組細胞均于干預72 h后進行檢測。
1.2.3 細胞增殖測定 利用Kit-8 細胞計數試劑(cell counting kit-8,CCK8)[12]測定益腎補血中藥對LNCaP細胞增殖及活力的影響。具體步驟為:將LNCaP細胞懸浮于含10%胎牛血清的培養基中,接種于96孔板(2000細胞每孔)中,進行培養24 h(37 ℃,5% CO2)后,加入10 μl不同濃度的益腎補血中藥培養基,同時添加10 μl CCK8溶液。孵育4 h后利用Spectra Max吸光度讀取器檢測在450 nm處的吸光度。
1.2.4 細胞周期測定(PI法[13]) 各組細胞在干預72 h后采集LNCaP細胞,以800 r/min離心5 min,采集沉淀物棄上清液,洗滌后加入預冷75%乙醇進行固定,之后添加400 μl溴化乙錠(PI,50 μg/mL),100 μl RNase A(100 μg/mL),4 ℃避光孵育30 min。以標準程序用流式細胞儀檢測,結果用細胞周期擬和軟件ModFit分析。
1.2.5 細胞凋亡測定(Annexin V&PI雙染色法[14]) 各組細胞在干預72 h后采集LNCaP細胞,洗滌后用100 ul的標記溶液重懸細胞,室溫下避光孵育10~15 min。再次離心后取沉淀細胞加入熒光(SA-FLOUS)溶液4 ℃下孵育20 min,避光并不時振動。以標準程序用流式細胞儀檢測,結果用細胞周期擬和軟件ModFit分析。
1.2.6 Western blotting 從各組的人PCa LNCaP細胞中提取蛋白裂解物,利用放射免疫沉淀分析(radio immunoprecipitation assay,RIPA)蛋白裂解液進行裂解、高速(12000 r/min)離心15 min,用移液器抽取上清液,以蛋白質定量(bicinchoninic acid,BCA)法對蛋白濃度進行測定。完成上樣步驟后進行電泳(濃縮膠電壓設置80V,跑至分離膠時更換為120V,條帶進行至尾部時停止)。5%胎牛血清白蛋白37 ℃封閉1.5 h,洗膜后滴加蛋白依賴性激酶-4(cyclin-dependent kinases-4,CDK4)、CDK6、BCL2-Associated X的蛋白質(Bax)、B淋巴細胞瘤-2基因(Bcl-2)以及間接靶點蛋白依賴性激酶-2(cyclin-dependent kinases-2,CDK2)、細胞周期蛋白D1(cycline D1)及細胞周期蛋白E1(cycline E1),一抗4 ℃孵育過夜,二抗37 ℃孵育1.5 h最后顯影,顯影結果用Image Lab軟件進行灰度值分析。
1.3 統計學方法
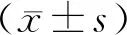
2 結果
2.1 益腎補血中藥治療PCa靶點的預測結果
2.1.1 藥物篩選結果 表1示,獲取益腎補血中藥共374個化合物成分,其中淫羊藿130個,三七119個,當歸125個。以OB>30%,DL>0.18,HL>4 h為條件進行篩選,去重后共獲得24個益腎補血中藥主要活性成分。選取“Related Targets”模塊,獲得1620個淫羊藿、716個三七、865個當歸的活性成分對應的靶點基因,結合相關文獻報道篩選后獲得益腎補血中藥藥物靶點共198個。
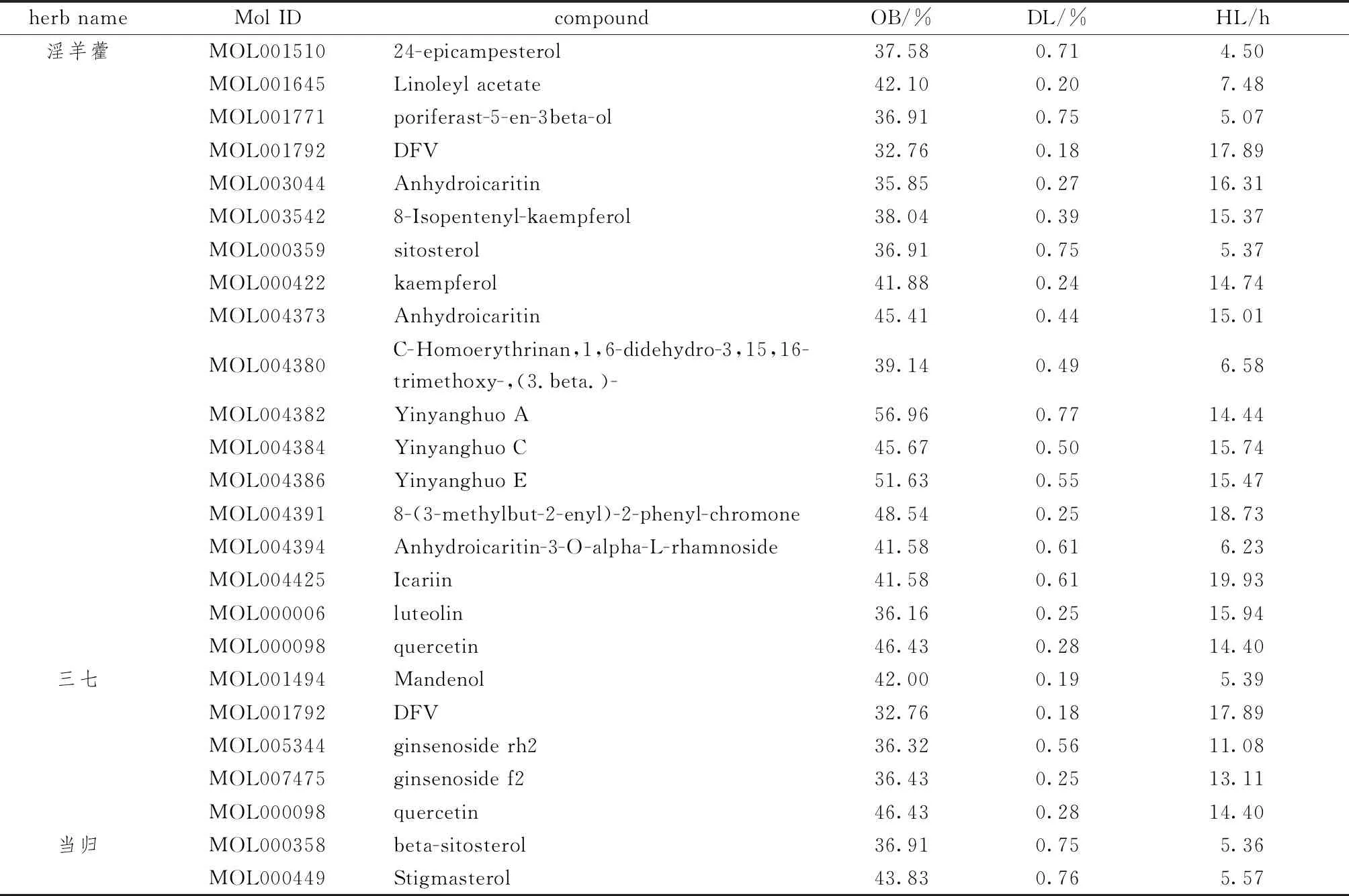
表1 益腎補血中藥的主要有效活性成分
2.2 PCa 疾病靶點基因獲取
圖1示,在GeneCards及OMIM數據庫檢索關鍵詞“Prostate cancer”,結合相關文獻報道共篩選出2829個PCa疾病靶點基因。將益腎補血中藥的藥物靶點基因與 PCa 疾病靶點基因進行映射,共獲得148個益腎補血中藥治療PCa的靶點基因。
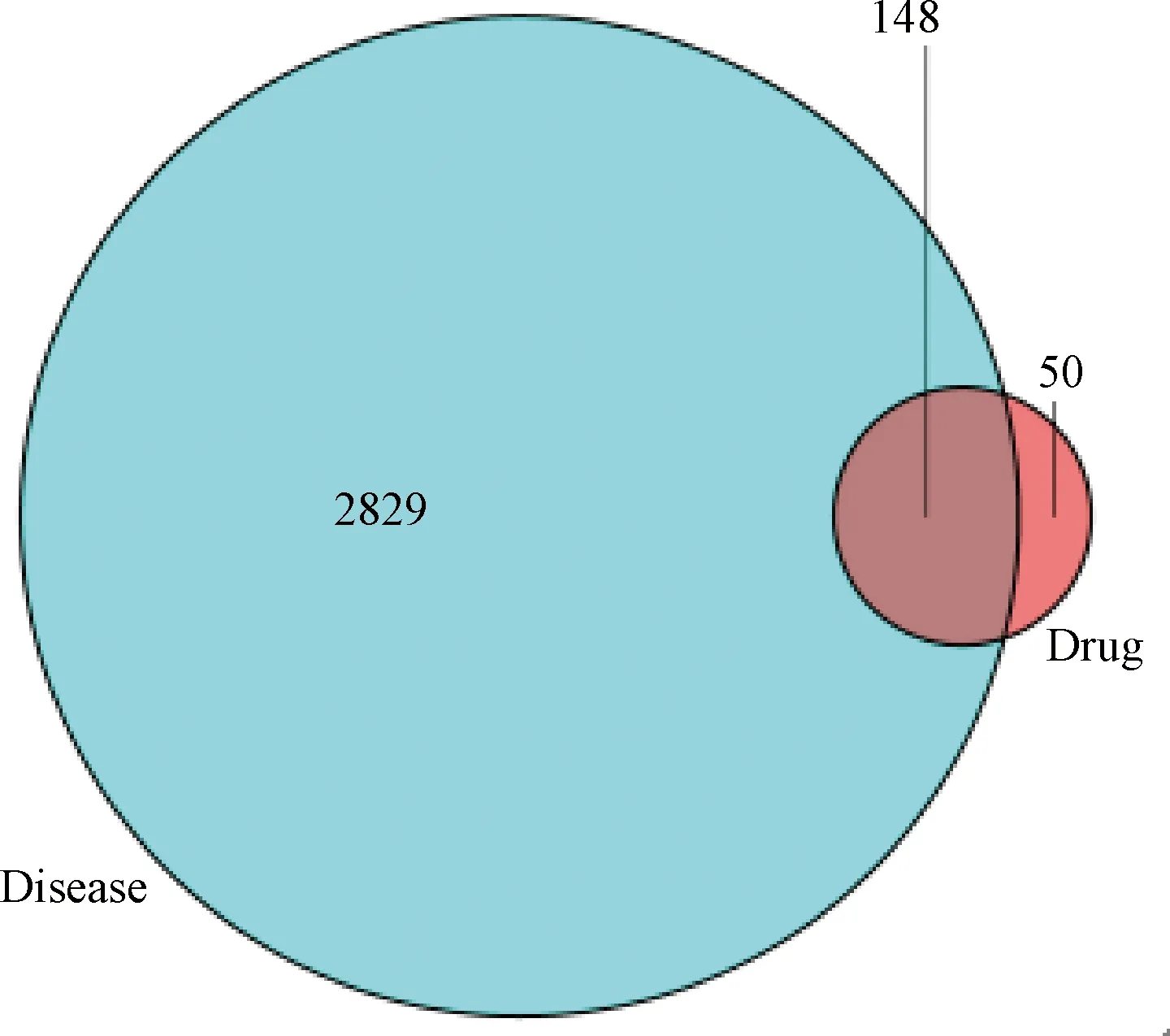
注:益腎補血中藥活性成分對應的靶點基因與 PCa 相關基因有148個共同靶基因
2.3 “藥物-疾病-靶點”網絡與PPI網絡構建
圖2示,將益腎補血中藥與對應活性成分(Ingredient_Drug)、活性成分與關鍵靶基因(Ingredient_Target)、關鍵靶基因與疾病靶點對應關系(Disease_Target)及屬性導入到Cytoscape,構建“藥物-疾病-靶點”網絡。使用CentiScape插件計算藥物活性成分DC,節點的DC越大提示該節點在網絡中權重越大。其中Quercetin(槲皮素)為71,luteolin(木犀草素)為47,keampferol(山奈酚)為31,Anhydroicaritin(脫水淫羊藿素)為27,8-Isopentenyl-kaempferol為12,位于前五位,提示益腎補血中藥具有較顯著的抗氧化應激、調控細胞周期、促進細胞凋亡以及調節免疫功能作用,與相關文獻報道一致[17,18]。
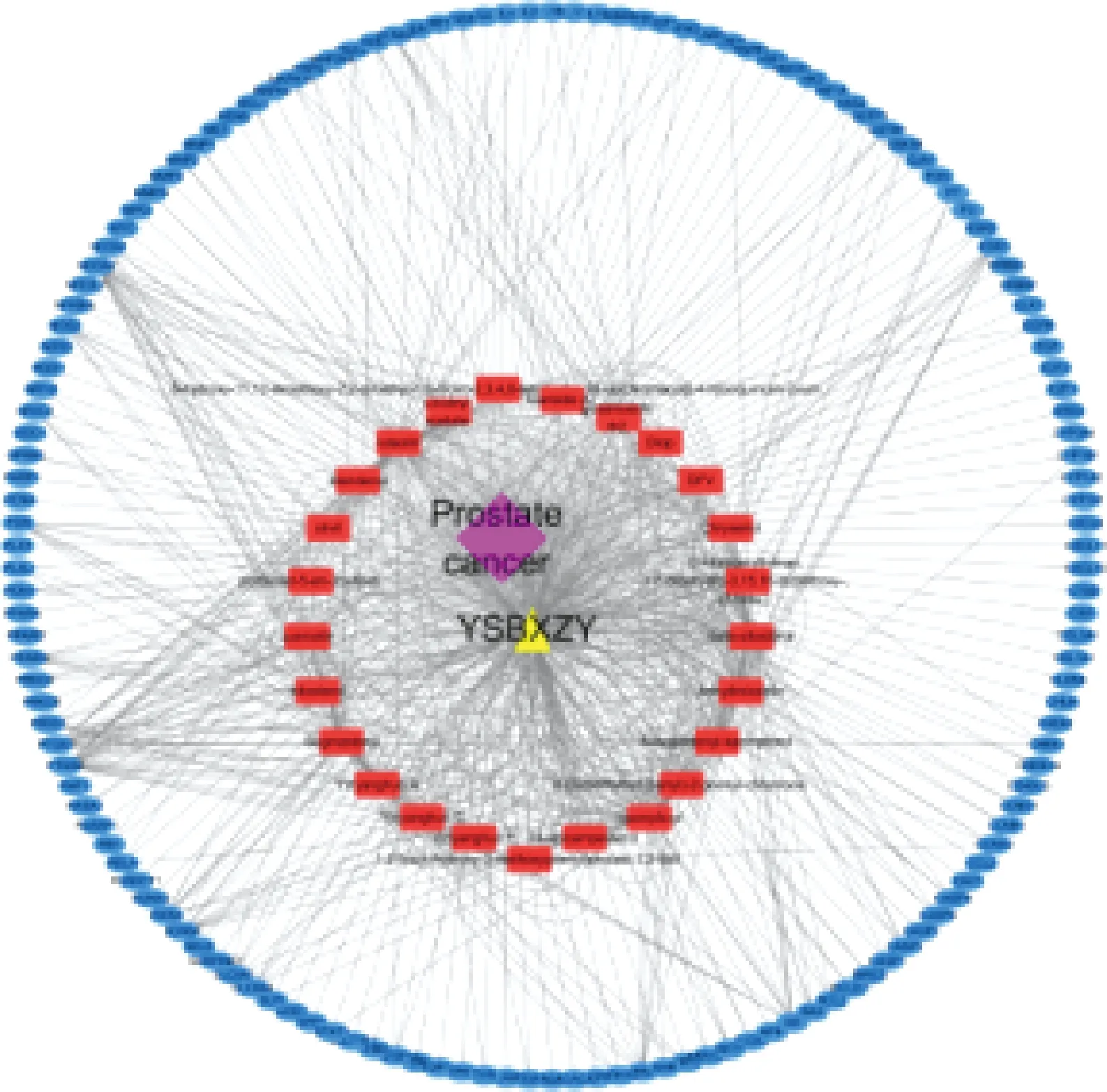
注:粉紅色菱形為疾病,黃色三角形為益腎補血中藥,紅色長方形為益腎補血中藥活性成分,藍色橢圓形為關鍵靶基因,灰色連線代表各節點間相互關系
圖3示,基于PPI關系,研究構建了益腎補血中藥潛在靶點的PPI網絡,得到Degree≥50的蛋白有40個,包括AKT1、IL6、VEGFA、CASP3、JUN、EGFR、MAPK1、MYC、MAPK8、CDK2、Bax、ESR1、CCND1、MMP9、CXCL8、IL1B、FOS、CDK4、CCL2、MMP2、IL10、MAPK14、RELA、AR、BCL2(Bcl-2)、CASP8、CyclinD1、ICAM1、IL4、SERPINE1、STAT1、HMOX1、IL2、SPP1、CDKN1A、HIF1A、NOS3、KDR、MDM2、VCAM1。
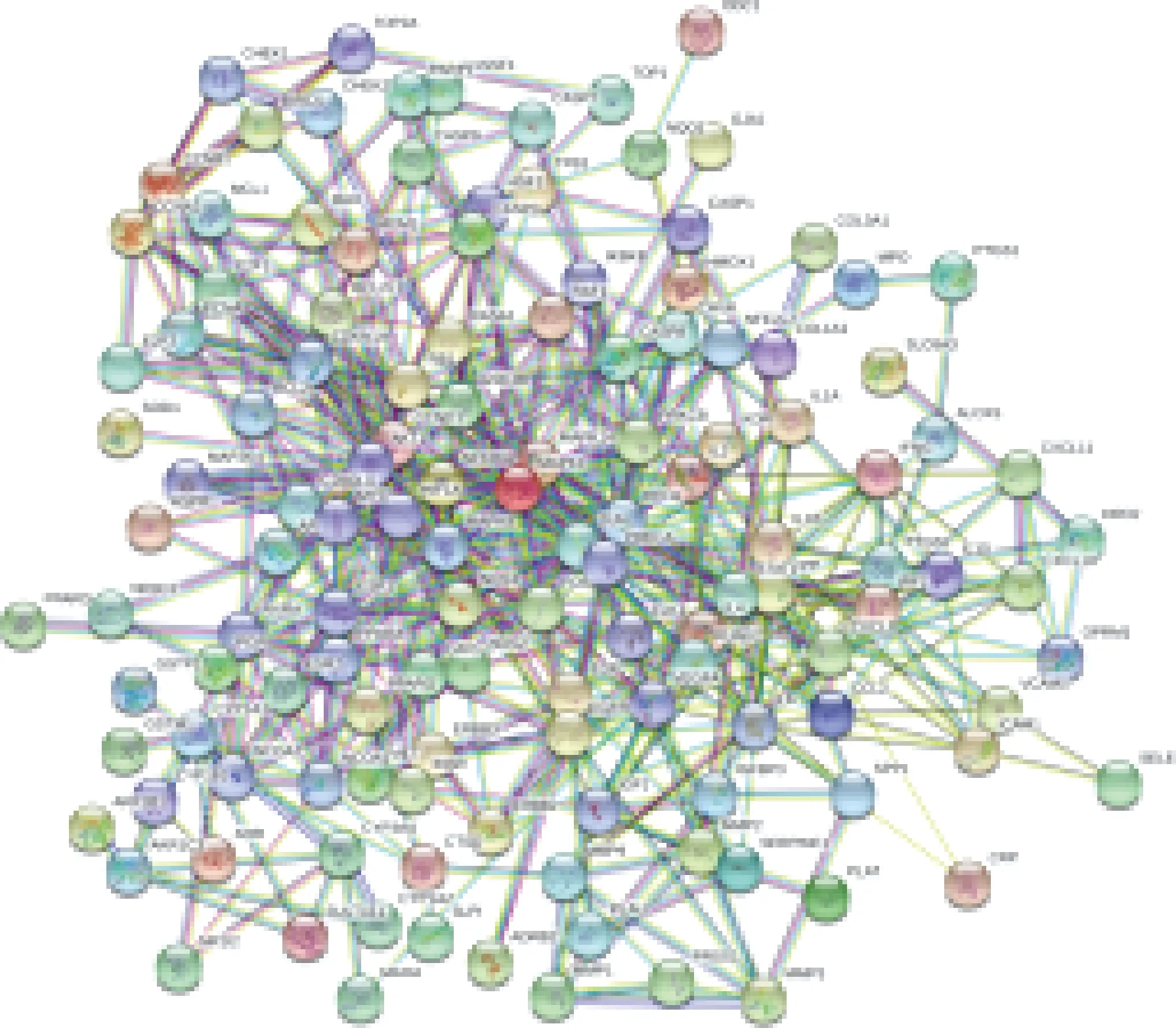
圖3 PPI網絡圖
2.4 GO生物過程與KEGG通路富集分析
圖4示,為更進一步研究益腎補血中藥治療 PCa 的作用機制,筆者對前述步驟篩取的核心靶點進行GO功能富集分析。通過GO功能富集分析筆者共富集到包括“regulation of apoptotic process”“cyclin-dependent protein serine/threonine kinase regulator activity”“regulation of cell proliferation”在內的涉及細胞周期、凋亡、增殖等生物學過程的114個GO條目,經校正排序后對位于前20的生物過程進行條形圖展示。
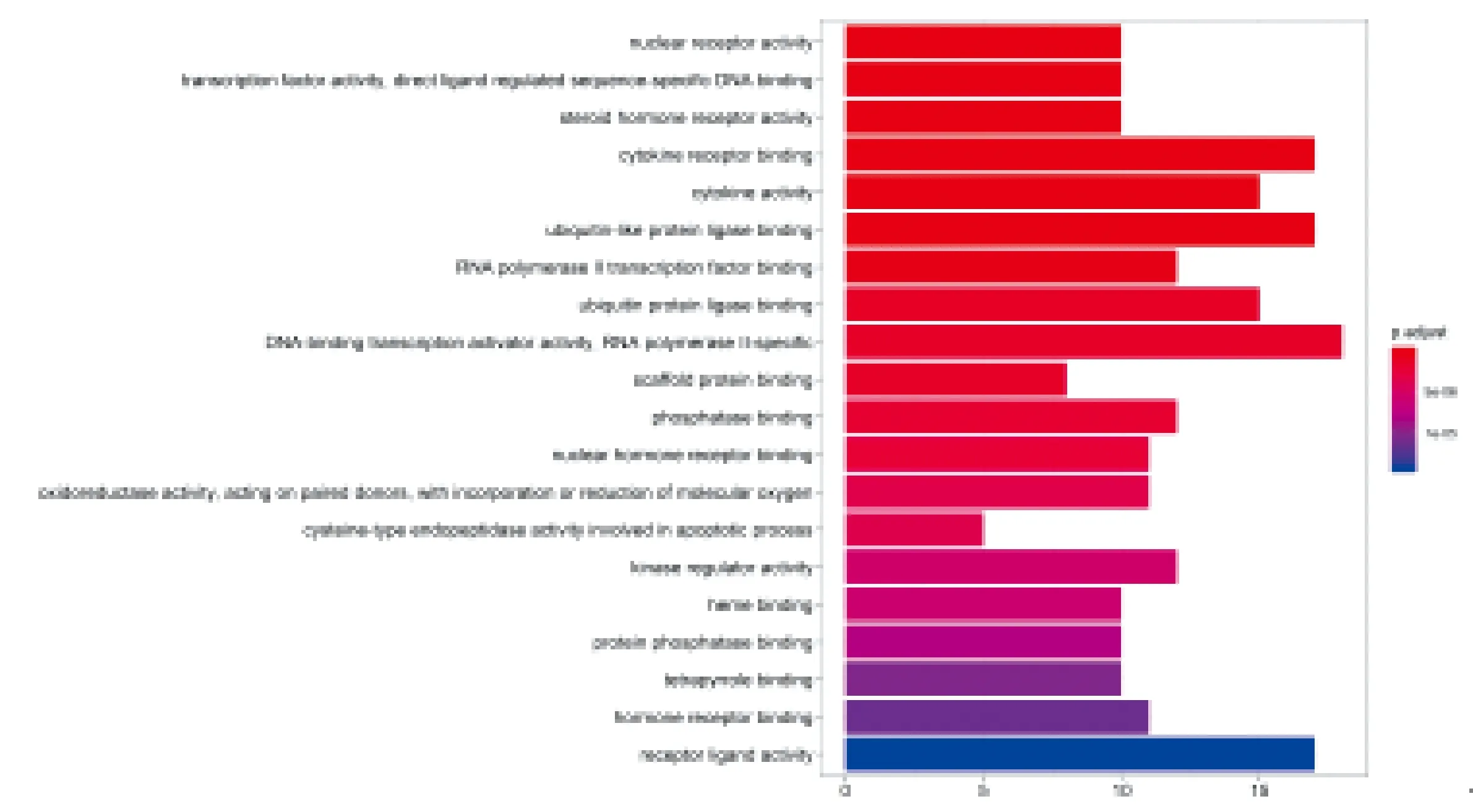
圖4 關鍵靶點基因GO功能富集分析
圖5示,基于KEGG富集結果,剔除重復數據及與 PCa 無關的信號通路,最終確定34條信號通路,經校正排序后對位于前20的生物過程進行條形圖展示。
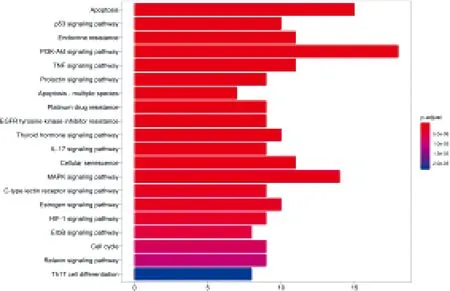
圖5 關鍵靶點基因 KEGG通路富集分析
2.5 益腎補血中藥干預人PCa LNCaP細胞增殖、凋亡及周期情況
為進一步評估益腎補血中藥對人PCa LNCaP細胞增殖、凋亡及周期的具體作用,筆者設置不同劑量的益腎補血中藥干預人PCa LNCaP細胞。藥物干預72 h后結果表明,益腎補血中藥能有效抑制人PCa LNCaP細胞的增殖并促進PCa LNCaP細胞凋亡(圖6 A,B)。益腎補血中藥誘導的人PCa LNCaP細胞凋亡率(壞死細胞+凋亡細胞/細胞總數)在不同劑量的培養下呈現累積趨勢,在益腎活血中藥分別處于低、中、高劑量時,分別為模型組LNCaP細胞凋亡(9.88%)的1.50倍(14.82%)、1.62倍(16.05%)以及2.18倍(21.56%)(P<0.01)(具體見圖6C、D)。同時隨著藥物濃度上升,LNCaP細胞周期阻滯及細胞凋亡高峰隨之上升,經干預后各組LNCaP細胞的周期分布存在顯著差異(P<0.05),在益腎活血中藥分別處于低、中、高劑量時,較模型組LNCaP細胞在G0/G1段分別增加11.63%、17.99%和26.32%,S段減少9.36%、12.80%、16.59%,G2/M段減少2.27%、5.19%、9.73%(具體見圖6E、F)。
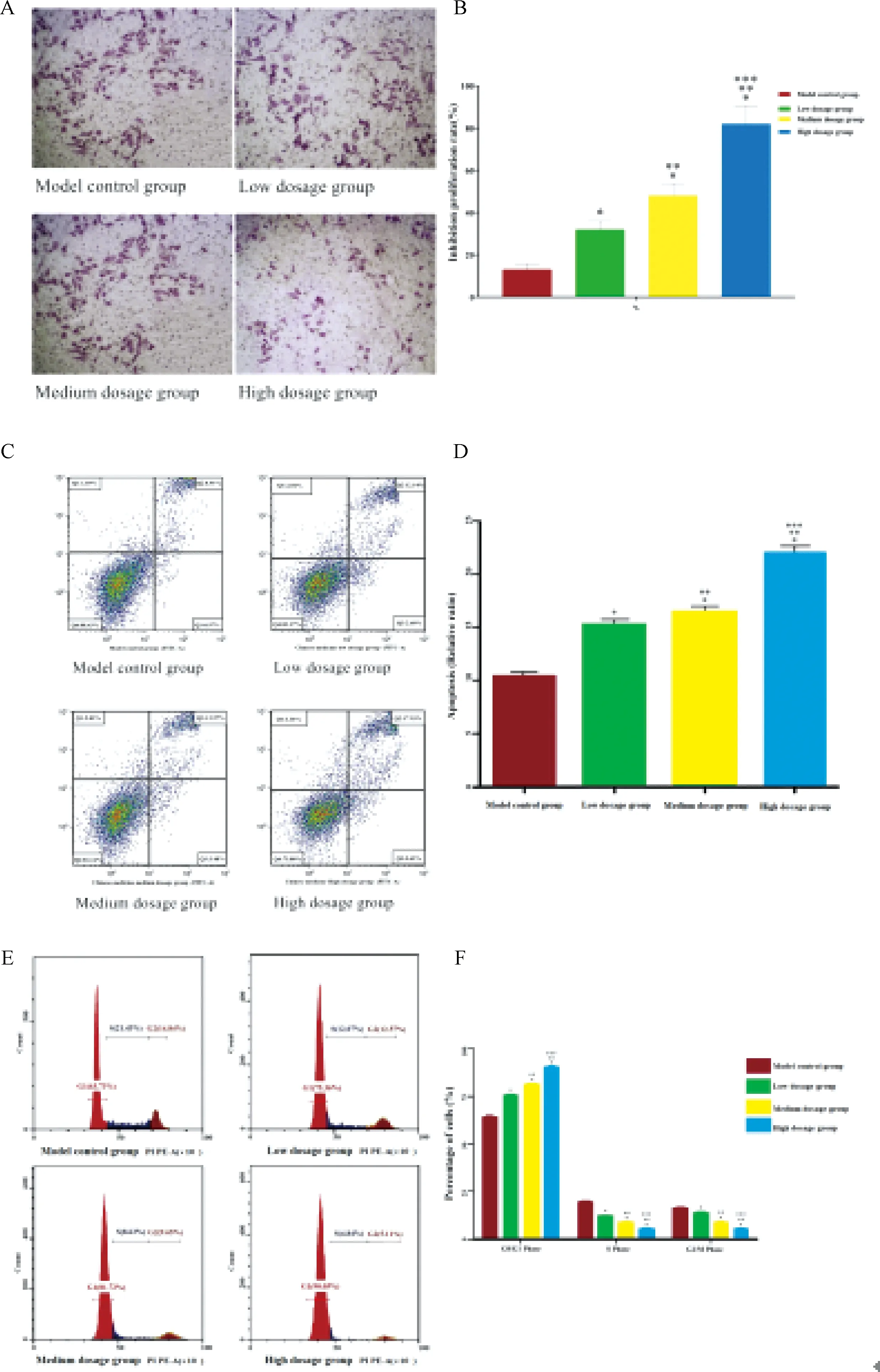
注:A.各組PCa LNCaP細胞增殖情況;B.與模型組比較:*P<0.05;與中藥低劑量組比較:**P<0.05;與中藥中劑量組比較:***P<0.05;C.各組PCa LNCaP細胞凋亡情況;D.與模型組比較:*P<0.05;與中藥低劑量組比較:**P<0.05;與中藥中劑量組比較:***P<0.05;E.各組PCa LNCaP細胞周期測定;F.與模型組比較:*P<0.05;與中藥低劑量組比較:**P<0.05;與中藥中劑量組比較:***P<0.05
2.5 益腎補血中藥對人PCa LNCaP細胞增殖、凋亡及周期相關蛋白表達的抑制作用呈劑量依賴性
圖7示,為驗證上述網絡藥理學結果,通過Western blot法對調控人PCa LNCaP細胞周期及凋亡相關蛋白進行驗證,包括細胞周期及凋亡直接靶點Bax、Bcl-2、CDK2、CDK4、CDK6、Cyclin D1及Cycline E1,筆者設置不同劑量的益腎補血中藥干預人 PCa LNCaP細胞72 h后,觀察調控人 PCa LNCaP細胞周期及凋亡相關蛋白表達水平的動態變化。結果提示,CDK2、CDK4、CDK6、Bax、Bcl-2、Cycline E1等蛋白隨益腎補血中藥劑量而出現不同程度的降低,但cycline D1蛋白呈相反趨勢改變,提示益腎補血中藥對人 PCa LNCaP細胞周期及凋亡相關蛋白表達的抑制作用呈劑量依賴性。
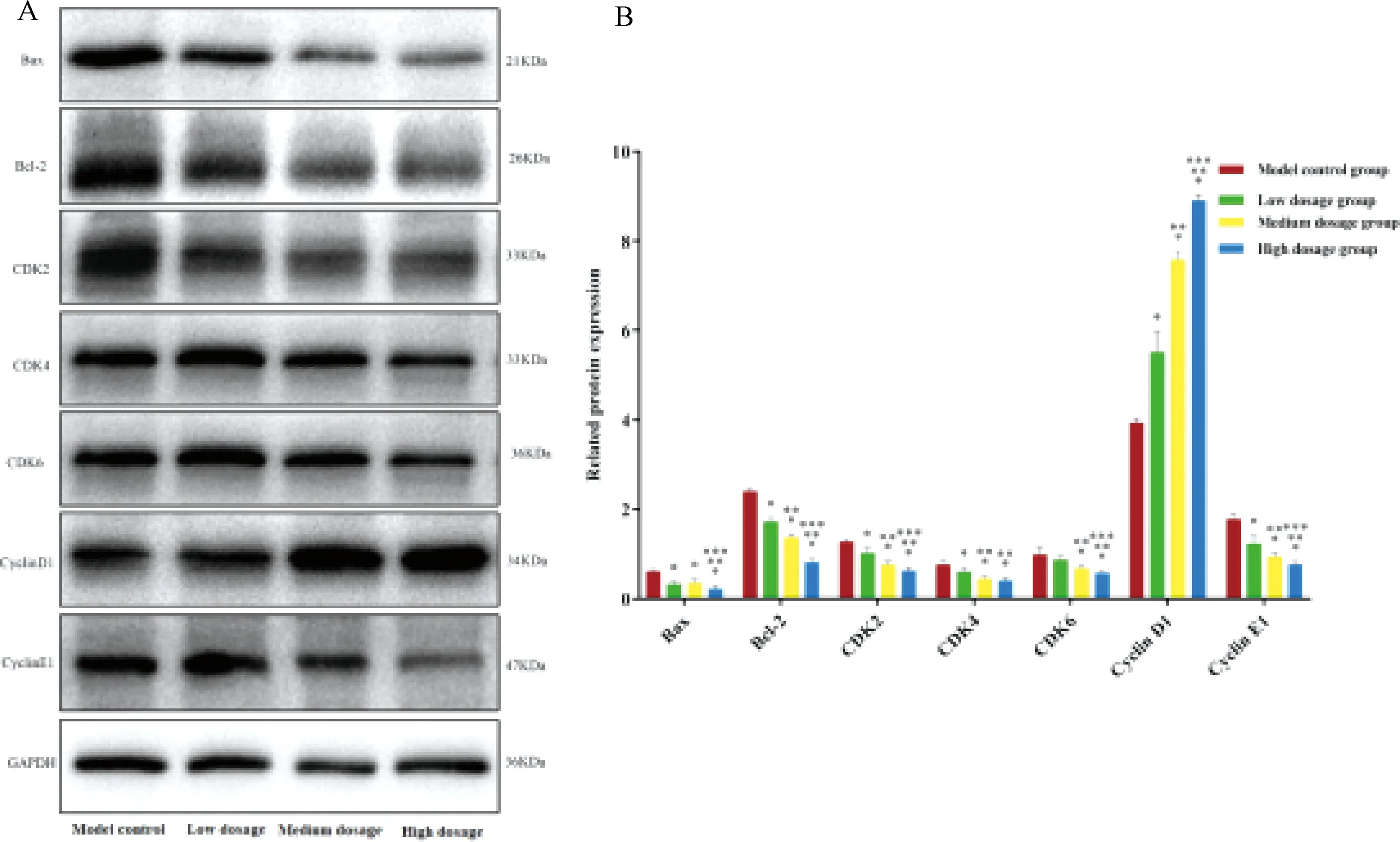
注:A.Western blot結果;B.與模型組比較:*P<0.05;與中藥低劑量組比較:**P<0.05;與中藥中劑量組比較:***P<0.05
3 討論
現階段隨著對PCa的研究不斷取得進展,其龐雜的發病及治療機制逐漸被揭示,PCa的發生機制主要包括腫瘤雄激素受體機制、干細胞形成機制、細胞周期調控以及炎性刺激相關機制等[15]。但在 PCa 的治療上,針對本病的靶點藥物仍處于探索階段,較長時間的去勢治療易致本病轉化為激素非依賴性PCa,同時易出現各類臨床不良反應且易復發[16]。中醫藥在改善PCa患者具體癥狀、調控其精神心理狀態等方面具有明顯的療效,運用中藥治療PCa在某些方面具有一定優勢[17,18]。然而,中藥存在多有效成分、多靶點的特征,各藥物活性成分間相互交集及作用形成了龐雜的相互作用網絡,所以給研究者探究其治療有效成分及相關機制造成了較大困難。
在本研究中,選取臨床治療PCa較常用3味藥物淫羊藿、三七、當歸。何華瓊等[19]研究表明,淫羊藿能夠有效抑制PCa細胞增殖,其機制可能為淫羊藿可抑制雄激素受體信號通路中的雄激素受體(AR)磷酸化,同時促進蛋白酪氨酸磷酸酶基因(PTEN)表達,將PCa細胞的增殖阻滯于S期。倪曉辰等[20]研究證實,三七總皂苷可顯著抑制PCa細胞增殖及遷移,同時可下調基質金屬蛋白酶2(MMP2)、血管細胞黏附分子-1(VCAM-1)等因子表達。胡楊等[6]研究結果顯示,當歸提取物可有效提升機體免疫力,抑制PCa細胞增殖,促進PCa細胞凋亡,抑制其遷移等多方面起到抗腫瘤治療效果。借助網絡藥理學分析,構建益腎補血中藥治療PCa的“藥物-疾病-靶點”網絡,結果顯示益腎補血中藥存在多有效成分、多靶點、多通路以及整體調控效應,能夠介由調控細胞凋亡信號通路、P53信號通路、PI3K/Akt信號通路、腫瘤壞死(TNF)信號通路等發揮對PCa的治療效應,而上述信號通路對調控細胞周期、凋亡有著重要作用,與GO富集分析結果一致。
正常的細胞均有一定的生命周期,而細胞凋亡是正常細胞出現程序性死亡的過程,其對生物的正常新陳代謝起到至關重要的作用,如果細胞周期及凋亡程序發生異常,將造成機體細胞新陳代謝紊亂,最終可能導致發生癌變[21]。基于KEGG通路富集分析結果表明,益腎補血中藥能夠介由多條信號通路調控細胞周期及其凋亡。其中細胞凋亡信號通路可激活腫瘤壞死因子α(TNFα)因子,經端激酶(JUK)磷酸化后與游離的組織蛋白酶(Cathepsin)、Bcl-2或Bcl-xl特異性結合,從而抑制細胞凋亡;腫瘤壞死(TNF)信號通路又稱為腫瘤壞死信號通路,與PCa的發生發展有緊密關聯,其可經由級聯反應激活半胱天冬酶-8(Caspase-8),Caspase-8又被稱為細胞生命周期的“開關”,在細胞周期及凋亡中扮演著關鍵角色[22];磷脂酰肌醇3激酶/蛋白激酶B(PI3K/AKT)通路AKT,可磷酸化細胞程序性死亡蛋白(Bad),進而抑制Bad結合Bcl-2最終抑制細胞凋亡。此外,其亦可經由磷酸化P21及P27調節細胞周期Cyclin及CDK家族蛋白[23];P53是PI3K/AKT信號通路的下游蛋白,其可調控Bax、Bcl-2等蛋白的表達并誘導細胞凋亡,最終阻斷腫瘤的發生[24]。由上述可知,益腎補血中藥可通過多條通路對細胞周期及凋亡進行調控,最終發揮對PCa的治療效應。同時本研究結果表明,益腎補血中藥可促進PCa LNCaP細胞在DNA合成前期(G1期)-DNA合成期(S期)細胞周期停滯,最終阻斷或減慢細胞LNCaP增殖,顯示出其在LNCaP細胞周期進程中的抗增殖作用,但其具體機制仍需進一步證實。
為進一步明確益腎補血中藥治療PCa的關鍵靶點,筆者對獲得的有效成分-疾病靶點進行PPI分析,得到Degree≥50的關鍵蛋白有40個,其中調控細胞周期及凋亡的蛋白,包括CDK2、CDK4、CDK6、Bax、Bcl-2、cycline D1及cycline E1等。CDK家族蛋白即細胞周期蛋白依賴性激酶蛋白的簡稱,Cyclin家族蛋白為細胞周期調控蛋白,其準確調節著細胞周期,維持細胞更新換代的正常運行[21]。CDK可特異性結合cyclin產生異二聚體,形成cyclin-CDK聚合體,借助CDK的活化作用,發揮對不同細胞周期的推進及轉化功能,而其中cycline D與cycline E家族蛋白作用恰恰相反[21,22]。如CyclinE-CDK2為生物細胞自G1期進入S期不可替代的激酶聚合體,其經由對下游眾多底物的磷酸化機制使細胞啟動DNA合成程序,最終推進細胞進入S期。本研究亦證實,益腎補血中藥可隨劑量增加下降人PCa LNCaP細胞中CDK2、CDK4、CDK6及Cycline E1的蛋白表達,cycline D1蛋白呈相反趨勢改變,與其調控細胞周期特性一致。Bcl-2蛋白對調控生物細胞凋亡至關重要,其通過改變細胞線粒體包膜的通過率進而調控細胞凋亡,一旦Bcl-2蛋白過度表達,激活細胞程序性死亡程序,同時拮抗抑癌基因最終阻斷細胞凋亡[25]。Chandrasekar等[26]研究結果顯示,PCa患者的腫瘤組織及癌旁組織中的Bcl-2蛋白及相關mRNA表達異常,同時伴隨疾病分期進展其含量上升,Bcl-2調控的細胞凋亡機制在PCa發生發展中扮演著重要角色。Bax為Bcl-2蛋白家族里促進細胞凋亡的關鍵蛋白,能夠使細胞內線粒體包膜通透率改變,并促進產生相關凋亡因子,造成腫瘤細胞凋亡[27]。現階段,已有學者在研究通過激活Bax途徑進而治療腫瘤,其可能成為治療腫瘤重要的新靶點[28]。筆者在使用益腎補血中藥干預人PCa LNCaP細胞過程中,Bcl-2、Bax蛋白的表達隨中藥劑量增加而下降,表明益腎補血中藥能夠促進LNCaP細胞凋亡,從而治療PCa。結合網絡藥理學結果,益腎活血中藥的有效成分,能夠特異性作用在調控細胞增殖、凋亡及周期相關蛋白上。如益腎補血中藥的有效成分Quercetin(槲皮素),在“藥物-疾病-靶點”網絡的預測結果中,顯示Quercetin能夠和CDK2、CDK4、CDK6、Bax、Bcl-2、cycline D1及cycline E1等靶點存在關聯。同時喬慧敏等[29]研究結果顯示,Quercetin可明顯下調Bcl-2、CDK6、cycline D等蛋白抑制腫瘤細胞增殖,調控腫瘤細胞周期,促進腫瘤細胞凋亡。luteolin(木犀草素)主要以糖苷的形式存在于多種中藥中,網絡藥理學結果表明,其與cycline E、Bax等存在關聯。易均路等[30]研究證實,luteolin可顯著阻滯細胞周期抑制腫瘤細胞生長,并促進腫瘤細胞凋亡。由此可見,益腎補血中藥中的有效成分能夠作用于調控細胞周期及凋亡的上游相關信號通路,某些有效成分甚至能夠直接作用于細胞周期及凋亡相關靶點,最終發揮抑制 PCa 細胞增殖、促進細胞凋亡的作用。
本研究基于網絡藥理學及細胞實驗對益腎補血中藥治療PCa進行初步研究,益腎補血中藥可有效抑制PCa進展及轉移。但受中藥多有效成分、多靶點的特點限制,其更進一步的藥效機制仍需更進一步的研究探討。網絡藥理學是基于系統生物學理論,通過虛擬計算、分子組學分析等研究方法,對“藥物-疾病-靶點”進行網絡構建及機制整合,將中藥信息和知識進行可視化,具備系統性及整體性的顯著特征,與中醫學的整體觀念以及辨證論治基本原則存在諸多類似之處[10]。本研究通過網絡藥理學對益腎補血中藥治療PCa的作用機制進行預測,并借助細胞實驗進行驗證,明確益腎補血中藥治療PCa具有多有效成分、多通路、多靶點協同作用機制的特點,其能夠經由調控多條信號通路,調控腫瘤細胞周期及凋亡,這對逆轉PCa病理、防治PCa具有較重要的意義。

