白菜基因組導入芥菜的遠緣雜交及后代分離偏向性
李祥升,常立春,陳海旭,武 劍,梁建麗,林潤茂,郭新磊,高 杰,王曉武
(1.新疆農業大學林學與園藝學院, 烏魯木齊 830052;2 中國農業科學院蔬菜花卉研究所, 北京 100081)
0 引 言
【研究意義】芥菜(2n=36,BrassicajunceaL.)是十字花科(Cruciferae)蕓薹屬(Brassica)植物,包括根用芥菜、莖用芥菜、葉用芥菜和薹用芥菜等[1]。其中,葉用芥菜(Brassicajunceavar.foliosaBailey)中的包心芥菜(Brassicajunceavar.capitataHort)易于栽培、生長周期短,隨著酸菜工廠化加工技術不斷發展,種植面積逐漸擴大[2-3]。包心芥菜的包心比較松散,結球性差。目前,我國使用的芥菜類品種主要是地方常規品種,品種雜亂[4-5],HRM技術結合InDel標記分型具有操作簡單、靈敏度高、通量大、基因分型準確等優勢。開發一套可區分白菜與芥菜的HRM-InDel標記有利于在芥菜雜交育種中實現高通量檢測基因型,加速雜交育種進程。【前人研究進展】芥菜由蕓薹屬的2個二倍體基本種白菜(A基因組)和黑芥(B基因組)通過天然雜交和基因組自然加倍形成,屬于異源四倍體(AABB)。目前,芥菜研究主要集中在細胞學、分子生物學和高產栽培與加工等。徐書法等[6]將芥菜與大白菜進行了遠緣雜交。Srivastava等[7]通過遠緣雜交,采用蕪菁和黑芥雜交后人工加倍合成了芥菜型油菜。魏素萍[8]利用蔬菜用芥菜與白菜型油菜雜交,以芥菜為輪回親本獲得了回交一代群體。水稻、玉米、白菜、番茄等作物研究中均已應用InDel標記,并取得了一定的成果[9-12]。Liu等[13]開發了覆蓋白菜全基因組的639個InDel標記,并篩選出387個具有多態性性的標記,對大白菜分子標記輔助育種研究積累了標記材料。張志剛等[14-15]基于白菜全基因組測序數據開發并篩選出了593個具有多態性的InDel標記,并篩選出了一批剩余雜合體單株,還獲得了20對可基于HRM技術分型的標記。陳榮等[16]基于白菜全基因組測序開發了252個可用于HRM分型的InDel標記,篩選出了148對在結球白菜與不結球白菜中有多態性的標記,優化了HRM分型的技術體系。【本研究切入點】采取傳統育種方式選育芥菜新品種較多,將分子標記輔助選擇技術應用于芥菜育種中尚不多。目前,基于HRM技術和InDel標記的分子標記輔助技術,在芥菜遠緣雜交育種中的應用鮮有報道。研究遠緣雜交將結球白菜的A基因組導入包心芥菜。【擬解決的關鍵問題】運用遠緣雜交將結球白菜中控制結球的基因導入芥菜中,采用InDel標記和HRM分型平臺,利用分子標記輔助選擇的手段,篩選回交過程中保留較多白菜基因的材料,改善包心芥菜的結球性,豐富包心芥菜的種質資源,拓寬分子標記輔助芥菜育種的方法,為芥菜類作物的優異基因資源挖掘、農藝性狀改良積累芥菜材料和InDel標記提供參考。
1 材料與方法
1.1 材 料
2018年秋季,將6份芥菜親本和2份白菜親本材料種植于中國農業科學院蔬菜花卉研究所南區日光溫室,2019年春,以芥菜為母本與白菜雜交獲得F1,以包心芥菜作為輪回親本與獲得的F1進行回交,2019年夏秋獲得BC1幼苗。2018年秋至2019年春以包心芥菜為輪回親本,對已有F1材料進行回交收種,2019年春獲得BC1幼苗。表1
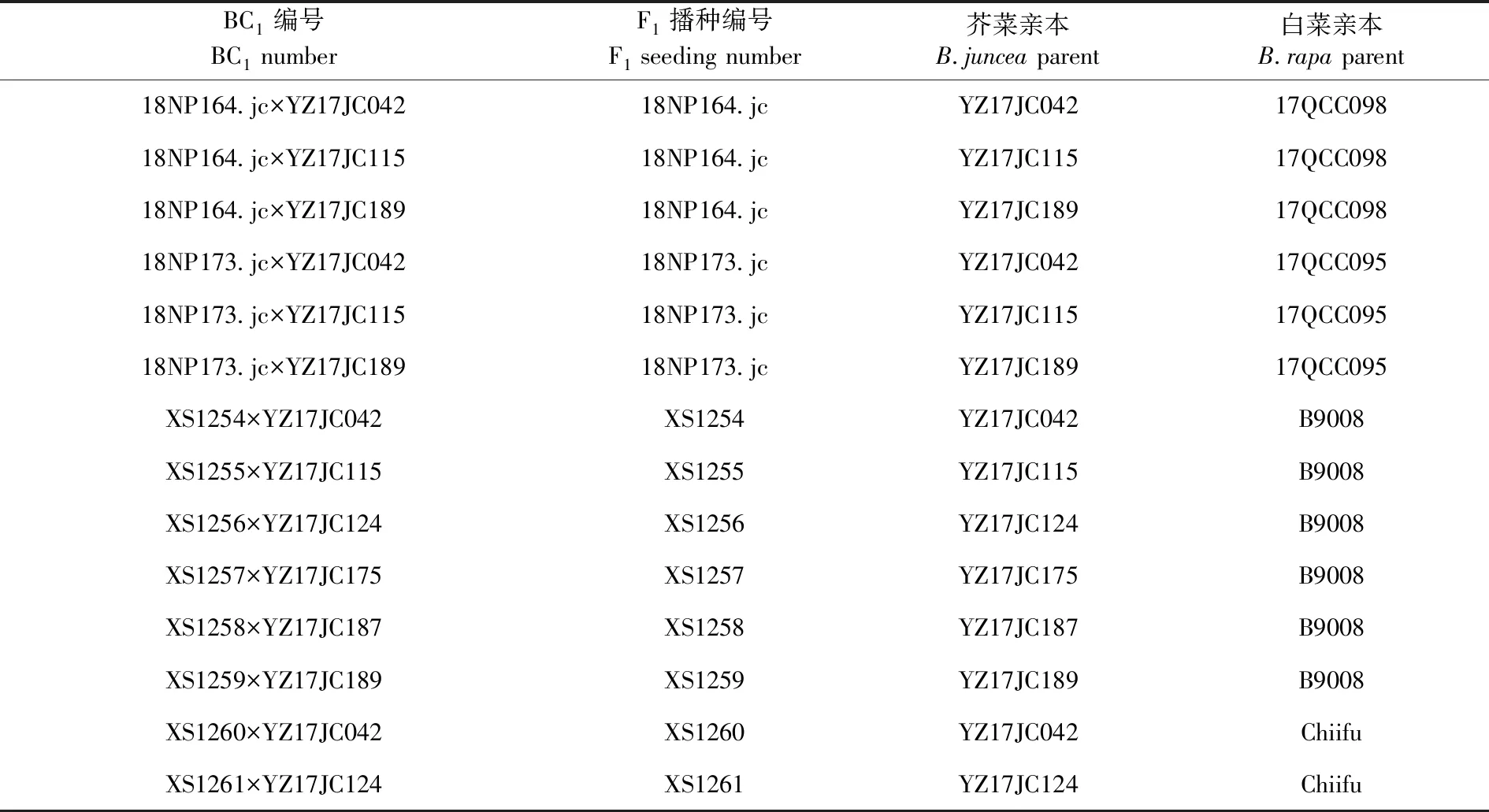
表1 親本信息及雜交群體編號Table 1 Parental information and hybrid group number
中國農業科學院蔬菜花卉研究所提供根據白菜設計的InDel標記。
1.2 方 法
1.2.1 雜交與回交
雜交:2018年秋將親本播入穴盤,發芽后4℃春化,時間為30 d。春化完成后將穴盤移入溫室,幼苗長出4~5片真葉時移入花盆,開花后以包心芥菜為母本(開花前1~3 d的花蕾),以結球白菜為父本進行雜交獲得F1,時間選擇在09:00~16:00。
回交:以F1為母本與輪回親本芥菜回交,花序不去頂,時間09:00~16:00。
結籽率和回交率:共獲得9個種間雜種組合。其中,芥菜與結球白菜B9008雜交的組合均獲得F1后代,而芥菜與結球白菜Chiifu雜交的組合中,只有3個組合獲得F1后代,其余3個組合未能獲得雜種一代,統計結籽率。F1種子或幼胚通過幼胚培養技術迅速培養成苗,并以芥菜為輪回親本進行回交,統計回交結籽率。
1.2.2 幼胚培養
在魏素萍[8]基礎上加以改進。取授粉后20~25 d的膨大的未成熟的角果,用清水沖洗干凈,用75%的酒精處理種莢1 min,用無菌水洗滌2次,再轉入2%的NaClO溶液中消毒3~5 min,然用無菌水洗滌2次。用解剖針和鑷子將胚剝離出來,放入蔗糖含量2.6%的B5或MS培養基上。置于25℃,光照12 h的組培間中培養成苗。
1.2.3 F1真實性判定
由于真雜合子代為三倍體,高度不育,觀察開花后結實判定F1是否為真雜合子代。
對F1回交時,選用6份芥親本中的3份作為回交親本。
1.2.4 DNA提取
采用磁珠法提取親本及雜交子代葉片基因組DNA。提取的DNA經NanoDrop 1000(Thermo,USA)檢測其純度和濃度,并通過1%的瓊脂糖凝膠電泳檢測基因組DNA質量。將DNA的一部分稀釋到20 ng/μL為工作液,剩余的DNA保存在-20°C備用。
1.2.5 PCR擴增和HRM基因分型
PCR擴增和HRM基因分型體系采用實驗室已開發的技術體系[16]。PCR反應在384孔PCR板上進行。PCR反應和HRM基因分型在Quant Studio 12K Flex Real-Time儀器上進行,同時用普通PCR儀進行PCR反應,之后在Quant Studio 12K儀器上進行HRM基因分型,以提高標記篩選通量。HRM基因分型完成后,導出實驗結果圖片和EXCEL數據表。
2 結果與分析
2.1 種間雜種F1及其回交結籽率
研究表明,不同組合的結籽率存在差異。結球白菜B9008作父本時,雜交組合的結籽率為12.50%~78.38%,均值為35.97%,回交結籽率為3.48%~19.28%,均值為8.10%。其中結籽率最高的是YZ17JC189,YZ17JC042次之,與YZ17JC124的結籽率最低。當結球白菜Chiifu作父本時,雜交組合的結籽率為16.28%~48.39%,均值為34.69%,回交結籽率為0~3.52%,均值為2.28%。雜交過程結籽率較B9008作親本時有所降低,但依舊是與包心芥菜YZ17JC189和YZ17JC042的親和性較高。組合YZ17JC189×Chiifu未獲得BC1群體,回交過程中的結籽率普遍低于雜交過程的結籽率。其中,雜交組合YZ17JC124×B9008在回交時結籽率最高,高出結籽率最低的組合YZ17JC042×B9008近6倍,比遠緣雜交時的結籽率高出將近7個百分點,該組合回交時結籽率較高。而雜交組合YZ17JC124×Chiifu回交時結籽率較低。圖1
2.2 F1群體回交收種
研究表明,18NP164.jc回交結籽率為1.04%~24.18%,均值為15.77%,18NP173.jc回交結籽率為1.06%~3.23%,均值為2.40%。材料18NP164.jc×YZ17JC042和18NP164.jc×YZ17JC115在未用幼胚培養技術輔助回交的情況下結籽率較高,與材料18NP173.jc相關的回交組合在無幼胚培養輔助的情況下,結籽率普遍低于幼胚培養的材料。排除結籽率較高和最低的組合之后,回交中使用幼胚培養的組合結籽率均值為4.64%,而未使用幼胚培養技術的回交組合結籽率均值為2.40%。圖1,圖2
2.3 可區分白菜與芥菜的InDel標記篩選結果
研究表明,共選出203個在結球白菜與包心芥菜間具有多態性的InDel標記。其中有49個標記可準確區分供試的8份包心芥菜和7份結球白菜,154個無法將全部供試白菜與芥菜區分開,可以有針對性的使用。可分型標記占總標記的50.62%,可區分所有供試材料的標記占比為12.22%。
2.4 用于BC1群體篩查的引物
研究表明,篩選出的49個可用標記中選出20個分型效果較好的標記,覆蓋到每條染色,利用這些標記追蹤BC1群體的白菜基因。表2
2.5 標記在回交群體中的InDel分型
研究表明,所有單株均攜帶白菜基因,單株中白菜標記占比為30%~100%,平均占比為73.80%。絕大部分單株攜帶的白菜特異標記在50%以上,在回交過程中白菜基因更容易保留。特別是以B9008為白菜親本的組合XS1255×JC124,不僅單株最多,而且所有單株的標記含量都在50%以上。圖3
BC1群體中雜合比例為64.06%~77.49%,均值為71.53%,顯著高于理論值50%(P<0.01),回交時F1中的白菜A基因組和芥菜A基因組并不是按照理論意義上的1∶1傳遞的,而是保留了較多的白菜基因。圖4
根據白菜親本差異將192棵單株分為8個組,各群體的白菜標記占比均高于50%。最高的是組合LXS1259,白菜標記占比達到了81.67%;白菜親本為Chiifu的群體中白菜基因占比最低,為51.82%。圖5
分組為LXS1254和“其它”的2組有部分標記在群體中的占比低于50%,其余分組中的每個標記在群體中的占比均高于50%。Chiifu為白菜親本的群體中有9對標記的雜合比例低于50%,最低值為27.27%,最高值為72.73%。以50%為檢驗值,對8個分組中各個標記的占比進行T檢驗,除組名為Chiifu的分組外,所有分組的P值均小于0.05,而分組為Chiifu的群體中P=0.56>0.05。在白菜親本非Chiifu的群體中,白菜標記占比顯著高于50%,偏向于白菜基因的傳遞,不符合回交后代1∶1的分離比;白菜親本為Chiifu的群體中白菜標記占比與理論值50%無明顯差異,符合回交后代1:1的分離比。圖6
3 討 論
遠緣雜交普遍存在生殖隔離和后代不育問題,難以通過單純的有性雜交獲得雜種后代。遠緣雜交后代育性較低或敗育是育種工作中的常見現象,研究回交過程的結籽率普遍低于遠緣雜交過程的結實率證實了這一點。而這特點剛好可用于鑒定雜交種,尤其在三倍體F1的雜種鑒定中具有極強的實用性。F1的基因型為AAB,B基因組在減數分裂中多以單價體形式存在,難以進行正常的減數分裂[17]。異源三倍體減數分裂過程中來自親本的染色體難以正常配對,這也是導致敗育的重要原因[18]。但這并不意味著三倍體都無法產生配子,有些物種可以產生非整倍體配子,甚至存在整倍體配子產生,并且能夠產生后代[19]。有多個研究通過培養子房或幼胚,均獲得了理想材料[20-24]。研究利用幼胚培養技術,在胚珠敗育之前或剛發生敗育時人工干預,在回交過程中起到了很大作用,篩選出了理想的芥菜與白菜雜交的組合YZ17JC042×B9008、YZ17JC189×B9008、YZ17JC042×Chiifu和YZ17JC189×Chiifu。
幼胚培養技術可提高結籽率。柳霖坡[25]利用幼胚培養技術將四倍體甘藍與二倍體甘藍雜交結籽率從3.79%提高到了53.33%。研究發現未使用幼胚培養技術的組合,其回交結籽率普遍較低。回交中使用幼胚培養的組合結籽率均值為4.64%,而未使用幼胚培養技術的回交組合結籽率均值為2.40%。但在遠緣雜交過程中有的組合因為生殖隔離嚴重,沒有獲得雜種后代,并且獲得雜交后代的組合親和性也各不相同。
偏分離是生物界廣泛存在的現象,指的是分離群體基因分型比不遵循孟德爾分離規律[26]。隨著分子標記技術的發展,多種作物的遺傳圖譜相繼構建出來。在玉米、水稻、小麥、棉花、南瓜和白菜等作物中均發現了大量的偏分離位點[27-32]。但前人的研究多是利用品種間或亞種雜交分離后代繪制遺傳圖譜,且僅部分標記位點存在偏分離現象。研究發現,所有白菜標記位點在回交群體中均偏向于保留白菜基因。研究結果顯示,各標記在全部BC1單株的雜合比例為64.06%~77.49%,均高于理論上的50%,以50%為檢測值,顯著性檢驗結果顯示P<0.01,差異顯著,明顯偏向于傳遞白菜基因。除白菜親本為Chiifu的群體外,各群體均明顯偏向于傳遞白菜基因,來自于白菜A基因組的基因在雜交群體中傳遞的概率超過了芥菜A基因組。偏分離與雜種群體的親本有一定關系,Chiifu群體雖無顯著偏分離現象,但分離群體雜合比例為51.82%,如群體單株數量足夠多亦有出現顯著偏分離的。這種遠緣雜交偏向保留白菜基因的分離現象對研究是有利的,偏分離被認為是作物進化的一種重要動力[33]。研究中偏分離現象的產生或與配子或合子的選擇有關[34],在配子或合子形成的過程中,包含白菜基因較多的配子或合子被保留了下來,而包含白菜基因少的配子或合子選擇性凋亡,這和Xu等[35]認為雄配子體選擇性保留的結果一致。但與前人研究不同的是,研究中的所有標記均存在偏分離現象,這一對遠緣雜交工作有利的現象值得關注。
4 結 論
4.1材料YZ17JC189只在與白菜親本B9008組合時,后代與芥菜回交結籽率較高,與其它白菜組合時回交結籽率均較低,回交結籽率與白菜親本有關。在利用白菜A基因組進行芥菜資源創制過程中,最好選擇多個同類型不同材料作為親本,以便從中選擇出結籽率較高的回交組合。
4.2遠緣雜交結合幼胚培養獲得了9個種間雜種組合和14個BC1群體。篩選出了芥菜與白菜遠緣雜交結籽率高的4個組合YZ17JC042×B9008、YZ17JC189×B9008、YZ17JC042×Chiifu和YZ17JC189×Chiifu;并篩選出了3個回交結籽率高的理想組合18NP164.jc×042、18NP164.jc×115和XS1256×YZ17JC124(YZ17JC124×B9008)。證實了三倍體高度不育性在蕓薹屬間雜種鑒定中的實用性,三倍體雜種育性較低,回交一代BC1比雜種一代F1更難獲得。以結球白菜B9008作父本的組合為例,雜交過程的結籽率均值為35.97%,而回交過程結籽率8.10%。發現了幼胚培養技術輔助回交可有效提高結籽率。回交過程中利用幼胚培養的組合結籽率均值為4.72%,而未使用幼胚培養技術的回交組合結籽率均值為2.9%。
4.3在回交群體中存在明顯偏分離現象,偏向于傳遞白菜基因。利用20個InDel標記追蹤192株BC1單株的白菜基因,各標記在全部BC1單株的雜合比例為64.06%~77.49%,均高于理論上的50%,以50%為檢測值,P<0.01,差異顯著,明顯偏向于傳遞白菜基因。有一半單株的標記占比在78.3%以上,有54棵單株標記占比超過90%。

