葡萄Vv SUC27基因的克隆及病原響應表達分析
吳佳鴻 黃金寶 劉梅等

摘要 由葡萄座腔菌科Botryosphaeriaceae真菌引起的葡萄潰瘍病(Botryosphaeriadieback)是葡萄上的主要枝干病害之一,嚴重影響葡萄產業的健康發展。其中,致病力最強的為可可毛色二孢Lasiodiplodia theobromae。糖轉運蛋白在調節植物對病原菌的免疫過程中起著至關重要的作用,關于葡萄中糖轉運蛋白參與植物免疫機制的研究尚未見報道。本試驗從‘無核白葡萄葉片中克隆得到蔗糖轉運蛋白VvSUC27基因,其開放閱讀框全長1515bp,預測蛋白質分子量為54kD,理論等電點(pI)為9.58。生物信息學預測該蛋白含有12個跨膜結構。實時熒光定量PCR(qRTPCR)分析表明:氨基環丙烷羧酸和脫落酸處理后VvSUC27的表達水平持續上調;水楊酸和茉莉酸甲酯處理后,VvSUC27的表達呈現上調表現但無規律的變化特征;激發子chitin和flg22處理后,VvSUC27基因信號響應快速且明顯;感病品種‘夏黑接種可可毛色二孢后,VvSUC27被迅速誘導,3h時表達量達到最高,而后逐漸減弱。本研究將為今后闡明可可毛色二孢與葡萄互作的分子機制提供參考依據。
關鍵詞 葡萄潰瘍病; 可可毛色二孢; 蔗糖轉運蛋白基因; 基因克隆; 表達分析
中圖分類號: S663.1 文獻標識碼: A DOI: 10.16688/j.zwbh.202016
葡萄犞犻狋犻狊狏犻狀犻犳犲狉犪集鮮食與加工于一身,是全球廣泛栽培的重要經濟果樹之一。葡萄枝干病害(grapevinetrunkdiseases,GTDs)是由多種病原真菌引起的危害葡萄枝干的病害統稱。由葡萄座腔菌科Botryosphaeriaceae真菌引起的葡萄潰瘍病(Botryosphaeriadieback)是葡萄主產區最常見的枝干病害之一,病原菌主要通過傷口或自然孔口侵入,導致樹干變色壞死、果實枯萎腐爛,嚴重的整株植株枯死。近年來該病引起我國浙江、江蘇、廣西、湖南、河北等地葡萄減產30%~50%。在我國葡萄產區,本研究團隊對引起葡萄潰瘍病的真菌進行了形態觀察及分子鑒定,發現了包括葡萄座腔菌Botryo-sphaeria dothidea、Diplodia seriata、可可毛色二孢Lasiodiplodia theobromae、小新殼梭孢Neofusicoccum parvum、Lasiodiplodia、pseudo-theobromae和Neofusicoccum mangiferae在內的6種葡萄座腔菌科真菌。其中,L.theobromae和B.dothidea是主要優勢種群,L.theobromae是致病力最強的一種。葡萄潰瘍病已成為我國葡萄健康發展的重大障礙,但目前對該病害的致病機理還不明晰,生產上也還沒有建立起對應的高效防控措施。糖類不僅是植物生長發育的必要因素,也是病原菌從宿主細胞吸收的主要碳源和能源物質。糖轉運蛋白不僅介導植物細胞內、細胞間糖的攝取與釋放,也介導植物病原體中糖的分配,其在植物質膜上的分配是植物生長發育和應對生物及非生物脅迫時最重要的過程之一。植物中糖轉運蛋白主要分成單糖轉運蛋白(MSTs)和蔗糖轉運蛋白(sucrose transporters/sucrose carriers,SUTs/SUCs)兩類,這兩類糖轉運蛋白都屬于MFS蛋白超家族(Majorfacilitatorsuperfamily)。蔗糖轉運蛋白(SUTs/SUCs)包含SUT1、SUT2、SUT3、SUT4和SUT55個亞族。已知的SUTs其氨基酸序列高度保守,為疏水性蛋白,包含由12個α螺旋組成的保守跨膜結構域,中間面向胞質的親水胞質環將蛋白分為兩部分,每部分含6個跨膜結構域,伸展的N 端序列也定位于胞質。SUTs基因家族成員在植物的不同生長階段和不同部位表達,行使多種生物學功能,參與多種信號轉導途徑。植物能夠調節糖轉運蛋白,將糖從感染部位重新分配出去,改變病原菌獲得營養物質的途徑,消除病原體的能量來源,來限制它們的擴散。玉米黑粉菌蔗糖轉運蛋白(UmSRT1)對蔗糖高度親和,寄主植物的ZmSUT1與其競爭蔗糖,病原菌通過直接吸收蔗糖來避免利用葡萄糖,進而誘導防御機制。犝犿犛犚犜1 的缺失或ZmSUT1的上調表達都會造成病原菌毒力大大降低。馬鈴薯中過表達蔗糖轉運蛋白SoSUT1導致叢枝菌根(arbuscularmycorrhizae,AM)真菌的定殖率增大。
迄今為止,預測葡萄基因組中有3個蔗糖轉運蛋白基因:VvSUC11,VvSUC12,VvSUC27,這3個基因均可在果實中表達,并且具有轉運蔗糖的功能。但對于葡萄中蔗糖轉運蛋白參與免疫機制的調控目前還未見報道。前期的試驗中以可可毛色二孢菌株CSS01s、高感葡萄‘夏黑為研究對象,對可可毛色二孢侵染的‘夏黑葡萄進行轉錄組分析,隨后通過差異表達基因的比對注釋,系統分析了侵染初期感病葡萄對可可毛色二孢防御反應相關基因的表達,發現蔗糖轉運蛋白基因VvSUC27在感病樣品中存在差異表達。本研究從葡萄的cDNA中克隆獲得葡萄蔗糖轉運蛋白VvSUC27基因,利用生物信息學和實時熒光定量PCR方法對其進行結構和表達分析,研究結果為進一步闡明VvSUC27基因的生物功能奠定了基礎,同時也為解析其參與免疫反應的調控機制提供參考。
1材料與方法
1.1 試驗材料
試驗于2019年9月在北京市農林科學院植物保護環境保護研究所進行。葡萄‘夏黑枝條由北京市農林科學院林果所提供。葡萄品種‘無核白組培苗由中國農業科學院興城果樹研究所董雅鳳研究員提供。
可可毛色二孢菌株CSS01s由本實驗室分離并保存。LA Taq DNA 聚合酶、pMD18T 載體、SYBRPremixExTaqTM購自寶生物工程有限公司。反轉錄酶SuperScript Ⅲ購自Invitrogen公司。E.coli Trana5α感受態細胞購自北京全式金生物技術有限公司。其他常規化學藥品均為分析純。農桿菌EHA105菌株和SuperGFP植物表達載體由本實驗室保存。flg22(鞭毛蛋白N端含保守的22個氨基酸的多肽:QRLSTGSRINSAKDDAAGLQIA,純度>95%)由艾博抗(上海)貿易有限公司合成。幾丁質chitin(C9752)購自Sigma公司。植物激素,水楊酸(SA)、脫落酸(ABA)、茉莉酸甲酯(MeJA)、氨基環丙
烷羧酸(ACC)購自SigmaAldrich公司。
1.2 試驗方法
1.2.1 接種處理
葡萄‘夏黑休眠枝條種植于北京市農林科學院溫室,將生根枝條以20cm×20cm 的間距移栽至25cm×25cm 的花盆中培養3 個月。接種按照Yan等方法稍作修改:將可可毛色二孢菌株CSS01s在PDA 培養基上于28℃培養2d;半木質化新生嫩枝用70%乙醇進行表面消毒后,在莖中間用打孔器制造2mm 深的傷口,取直徑為4mm 的菌餅接種到傷口上并使用封口膜稍作固定,對照組接種無菌PDA 培養基塊;接種后的葡萄苗置于26~28℃、光周期L∥D=12h∥12h、相對濕度為85%~95%的植物接種室中;接種0、1、3、6、12h和24h時以傷口為中心截取4cm 范圍內全部韌皮組織,采集的樣品在液氮中速凍,-80℃冰箱保存備用。
1.2.2 激素及激發子處理
參照Jiao等的方法,將生長情況一致的‘無核白組培苗移栽至26~28℃人工氣候室,光周期L∥D=16h∥8h下培養3個月后,對材料進行激素及激發子處理:將100μmol/L水楊酸、100μmol/L脫落酸、100μmol/L茉莉酸甲酯、100μmol/L氨基環丙烷羧酸、1μmol/Lflg22和10μg/mL幾丁質分別噴施在葡萄葉片上,噴施量為(1.5±0.1)mL/株,同時以等體積滅菌ddH2O處理為對照;暗培養并分別在處理0、1、3、6、12h和24h時采集葉片,每種處理設置3組重復。采集的葡萄葉片用液氮速凍后,保存于-80℃冰箱備用。
1.2.3 RNA 提取及cDNA 合成
取上述激素處理、激發子處理和接種處理后的植物組織,采用多糖多酚/復雜植物RNA 快速提取試劑盒(北京艾德萊生物科技有限公司)提取樣品總RNA,瓊脂糖凝膠電泳檢測RNA 的質量及完整性。NanoDrop2000(Thermo)對RNA 進行定量后,利用SuperScriptⅢ反轉錄試劑盒(Invitrogen)反轉錄合成cDNA,-20℃保存備用。
1.2.4 VvSUC27基因ORF的克隆及生物信息學分析
根據VvSUC27 序列(GenBank 登錄號:AF021810.2)設計特異性引物:上游引物SUC27F:5′ATGGAGTTAGCCAAGCCTTCTTCAG3′,下游引物SUC27R:5′AGACGACGGCTGAGTCCTCTCATCC3′。以葡萄‘無核白cDNA 為模板,進行PCR擴增,反應體系(50μL):10×PCRbuffer5μL;2.5mmol/LdNTPs2μL;10μmol/L上游和下游引物各1μL;LA Taq0.4μL;cDNA 模板2μL;補水至50μL。反應程序:94℃預變性5min;94℃變性30s,60℃退火30s,72℃延伸90s,32個循環;72℃延伸10min。PCR產物經1.5%瓊脂糖凝膠電泳檢測后,用膠回收試劑盒(Qiagen)回收目的片段,連接到pMD18T載體上,定名為SUC27T,轉化大腸桿菌Trans5α感受態細胞,單克隆鑒定為陽性后送北京擎科新業生物技術有限公司測序。采用DNAMAN6.0、ProtParam等軟件對其蛋白序列進行生物信息學分析;利用MEGA7構建系統進化樹。
1.2.5 基因表達分析
根據VvSUC27 基因序列設計實時熒光定量PCR特異引物,上游引物qS27F:5′ATCACCTACAGCATTCCAT3′,下游引物qS27R:5′CTACCGACACCATCATCT3′。以1.2.3制備的cDNA作為模板,每個樣品設3 次重復,用VvEF1γ(AF176496)作為內參基因。參照TaKaRa說明書,采用SYBRGreenI染料法進行熒光定量PCR,反應在ABI7500 RealtimePCR 檢測系統上進行。PCR 反應體系:SYBR Premix ExTaqTM10μL;10μmol/L上游和下游引物各0.5μL;ROXReferenceDyeⅡ0.4μL;cDNA 模板0.5μL;補ddH2O至20μL。反應程序為:95℃預變性30s;95℃變性5s,60℃ 退火34s,40 個循環;熔解曲線為95℃15s,60℃60s,95℃30s,60℃15s。VvSUC27基因的相對表達水平用2-△△α犆狋法計算。
2 結果與分析
2.1 葡萄VvSUC27基因的克隆
以葡萄品種‘無核白cDNA為模板,SUC27F/R為引物擴增得到1條1500bp左右的片段,測序并通過DNAMAN軟件將得到的序列與‘黑比諾參考序列(PN40024)進行比對發現,其開放閱讀框(ORF)序列長度一致,為1515bp;第164位核苷酸與參考序列存在差異,‘黑比諾中該位置為T,對應氨基酸為亮氨酸(Leu);‘無核白中為A,對應氨基酸為組氨酸(His)(圖1)。
2.2 VvSUC27蛋白的生物信息學分析
2.2.1 VvSUC27蛋白的理化性質分析
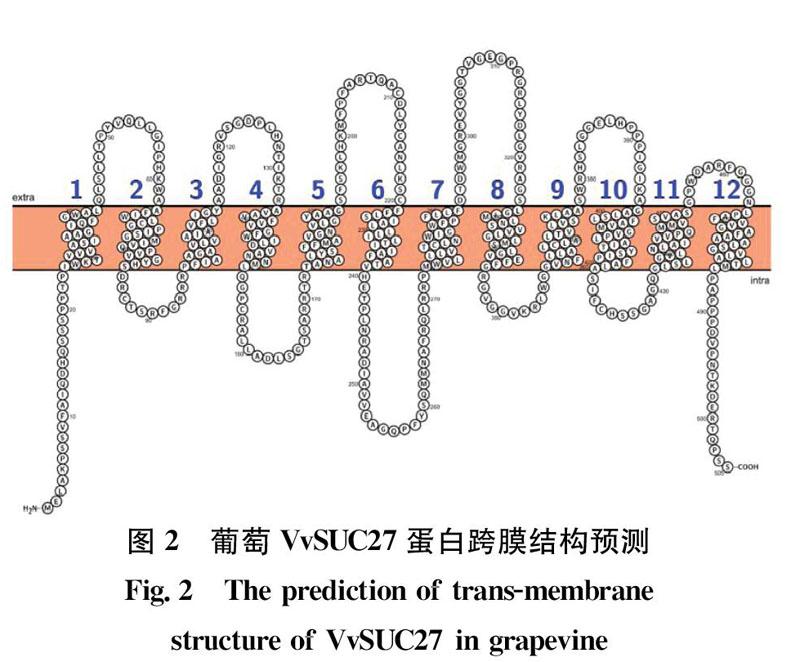
VvSUC27基因編碼505個氨基酸,包含22個酸性氨基酸(Asp+Glu),36個堿性氨基酸(Arg+Lys),編碼蛋白相對分子量為54kD,理論等電點(pI)為9.58。VvSUC27蛋白包含44.36%的α 螺旋(al pha helix)、14.65% 的延伸鏈區(extendedstrand)、4.16%的β轉角(beta turn)和36.83%的無規則卷曲(randomcoil)。應用在線工具(http:∥wlab.ethz.ch/protter/start/)預測VvSUC27蛋白含有12個跨膜區(圖2)。
2.2.2 VvSUC27蛋白三 級結構預測
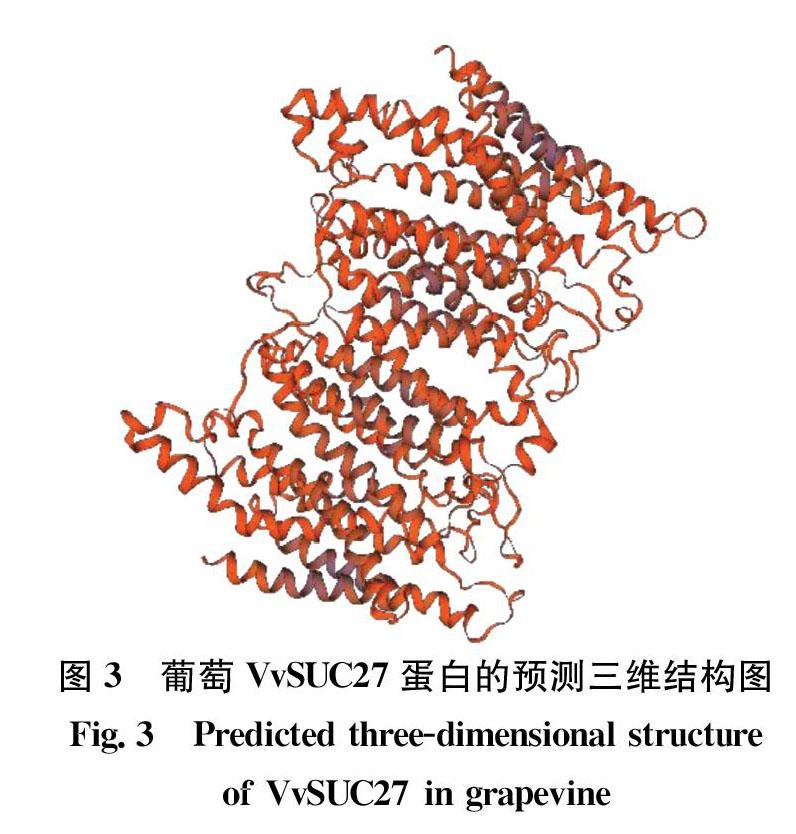
用SWISSMODEL對VvSUC27編碼氨基酸的三級結構進行預測,結果如圖3所示。葡萄VvSUC27蛋白的三級結構域呈現復雜彎曲的交叉螺旋狀結構,有12個明顯的α螺旋。
2.2.3 VvSUC27蛋白的系統進化樹
通過同源性比對分析表明,葡萄VvSUC27蛋白與煙草NtSUC1a(CAA57727)蛋白和擬南芥AtSUC5(AEE35248)同源性最高分別為63.92% 和61.43%,說明其親緣關系最近(圖4)
2.3 VvSUC27基因的表達分析
激素處理后,VvSUC27基因表達量發生變化(圖5):水楊酸(SA)處理后,VvSUC27基因表達量呈先上升后下降的趨勢,處理12h后表達量最高,約為對照的2 倍;茉莉酸甲酯(MeJA)處理后,VvSUC27基因表達量呈先上升后下降的趨勢,處理6h后表達量最高,約為對照的2倍;乙烯前體氨基環丙烷羧酸(ACC)處理后,犞狏犛犝犆27基因在1h時表達量最低,低于對照的1/2;處理12h后基因表達量上調。脫落酸(ABA)處理后,VvSUC犆27基因表達量有所下降,6h后恢復為與對照相當水平,而后不斷上升,處理24h后達到峰值。
如圖6所示,在chitin誘導下,VvSUC27基因信號響應十分快速且明顯,表達量在3h時達到峰值,約是對照的6倍,而后表達量逐漸降低;在flg22處理下,VvSUC27基因表達量升高,其中12h時表達量最高,約為對照的4倍,處理24h后表達量則基本恢復至與對照水平相當。
接種可可毛色二孢后,VvSUC27表達量先升高,3h時達到峰值,約為對照的2.5倍;隨后表達量開始下降,接種12h時最低,約為對照的2倍(圖7)
3 討論
蔗糖轉運蛋白(SUTs/SUCs)是植物中特有的一類跨膜蛋白,在植物中廣泛存在,負責蔗糖經韌皮部從源到庫的運輸以及庫組織的蔗糖供給,還參與蔗糖在庫組織的貯存。蔗糖轉運蛋白是一個十分龐大的家族,他們的共同特點是具有12個跨膜區的蛋白質,在12個跨膜區域中,氨基酸是極為保守的,其中的疏水氨基酸幾乎完全不變,而N 端與C端為高變異區。最保守的跨膜區為第1、2和11跨膜區,但不同植物或相同植物的不同基因存在功能上的差異。Davies等于1999年從葡萄果實中克隆得到了3個推測可能是葡萄蔗糖轉運蛋白的基因。張雅麗等研究發現:VvSUC27在葡萄的根、幼葉以及果實等庫器官中大量表達,而在葉片中表達量很少,與Davies結果一致,初步認為該基因很可能編碼特異性存在于庫組織中的蔗糖轉運蛋白;于菲等2011年對VvSUC27啟動子進行了初步的功能預測分析。本研究克隆了葡萄VvSUC27 基因,利用生物信息學方法對該蛋白的理化性質、三級結構進行了預測分析。結果表明其cDNA 全長為1515bp,編碼505個氨基酸,VvSUC27蛋白具有12個跨膜結構,與煙草蔗糖轉運蛋白NtSUC1a的親緣關系最近,為63.92%,VvSUC27基因與許多已經驗證功能的糖轉運蛋白基因都有很高的同源性,具有糖轉運蛋白的活性。
目前糖轉運蛋白在生理以及非生物脅迫方面的作用已經有了較深入的研究。植物中經光合作用產生的糖分需要其運輸調控以保證自身各部分的營養供應,非生物脅迫條件下糖轉運蛋白也會參與以適應逆境。在玉米、小麥、馬鈴薯等植物中發現了參與植物與病原菌互作過程相關的糖轉運蛋白基因。本研究通過對葡萄受可可毛色二孢侵染后不同時間VvSUC27基因表達量的檢測,證實病菌侵染誘導寄主植株VvSUC27 基因的表達量增加,推測VvSUC27基因參與了寄主對可可毛色二孢的調控。水楊酸、脫落酸、茉莉酸以及乙烯是植物免疫相關的激素,在不同病原菌侵染過程中,其在寄主體內通過信號分子積累的改變來調節植物的免疫反應。本研究結果表明,SA 和MeJA 處理6h即可誘導VvSUC27上調表達;而ABA 和ACC 處理24h后,VvSUC27基因才出現誘導表達。在病原菌與寄主的互作過程中,寄主植物細胞表面的模式受體(patternrecognitionreceptors,PRR)通過識別病原菌保守的病原相關分子模式(pathogenassociatedmolecularpatterns,PAMPs)激發PAMPs誘導的免疫(PAMPtriggeredimmunity,PTI),其中細菌的鞭毛蛋白(flagellin)、真菌的幾丁質(chitin)、肽聚糖(peptidoglycan,PGN)等都是常見的病原菌保守組分。VvSUC27受flg22和chitin的誘導表達,推測其參與寄主植物的PTI反應。
本文克隆了VvSUC27基因并分析了其在接種可可毛色二孢后以及不同激素和激發子處理下的表達情況。下一步將開展基因編輯、蛋白互作等工作,對葡萄中蔗糖轉運蛋白的功能及作用機理進行深入研究。通過探索VvSUC27基因在可可毛色二孢與葡萄互作中的作用機制,為葡萄中其他蔗糖轉運蛋白調控機制研究提供一個新的切入點,為葡萄的遺傳改良提供理論參考。

