白藜蘆醇抑制HIF-1α對腎癌細胞線粒體功能及抗乏氧增殖的調控*
楊清滔,谷 江△,趙治國,張永春
(1.貴州醫科大學附屬醫院泌尿外科,貴陽 550004;2.貴州醫科大學附屬白云醫院泌尿外科,貴陽 550014;3.武警貴州總隊醫院外二科,貴陽 550002)
惡性腫瘤細胞侵襲性、異型性的生理特性可導致細胞內相對乏氧環境產生[1]。缺氧可刺激癌細胞內缺氧誘導因子-1α(HIF-1α)表達升高,且上調HIF-1α 表達可促進癌細胞在缺氧環境下增殖[2-4]。研究表明,減弱HIF-1α 的功能可明顯抑制腎癌細胞增殖[5]。白藜蘆醇(resveratrol,Res)是廣泛存在于葡萄、花生和多種傳統中藥中的一種多酚類化合物,對HIF-1α 有明顯的抑制作用[6],具有降血脂、抗炎、抗氧化及抑制腫瘤細胞增殖、轉移和促進凋亡等生物學功能[7-9]。但Res對腎癌細胞抗乏氧增殖的作用及其機制目前尚未完全闡明。本研究用不同濃度Res 干預腎癌細胞,觀察常氧和缺氧環境下腎癌細胞的增殖情況、線粒體功能相關指標變化以及HIF-1α 的表達,探討Res 在腎癌細胞抗乏氧增殖過程中的機制。
1 材料與方法
1.1 細胞和主要試劑 人腎癌GRC-1 細胞株購于上海弗雷堡生物公司。二氯化鈷購于成都科龍化工試劑廠;Res 購于Sigma 公司;總RAN 提取試劑盒、逆轉錄試劑盒、PCR MasterMix 均購于Fermentas 公司;酶聯免疫吸附試驗(ELISA)試劑盒購于R&D 公司;Fura-2/AM 鈣離子探針購于碧云天生物技術研究所。
1.2 細胞分組及處理 將腎癌GRC-1 細胞分為正常組和缺氧組,缺氧組用150 μmol/L 二氯化鈷干預GRC-1細胞48 h[10],構建缺氧GRC-1細胞模型,正常組在正常氧環境下培養。兩組培養基中各加入不同濃度(0 μmol/L、20 μmol/L、40 μmol/L 和60 μmol/L)Res進行干預。
1.3 RT-qPCR 法檢測HIF-1α 基因表達 提取細胞總RNA,逆轉錄成cDNA,在PCR 儀器(Eppendorf Mastercycler gradient,22331 型,德國)上進行PCR擴增反應。PCR反應條件:預變性94 ℃3 min;變性94 ℃30 s,退火30 s,退火溫度均為53 ℃,延伸72 ℃1 min,共35個循環;終止反應72 ℃5 min。引物序列:β-actin 正向:5’-CCCTGGACTTCGAGCAAGAGAT-3’,反向:5’-GTTTTCTGCGCAAGTTAGG-3’,片段長度531 bp;HIF-1α 正向:5’-TCCAGCAGACTCAAATACAAGAAC-3’,反向:5’-GTATGTGGGTAGGAGATGGAG ATG-3’,片段長度130 bp。以β-actin作為內參,所得條帶經Image J軟件進行灰度分析,以目的基因條帶灰度值與內參條帶灰度值的比值代表目的基因的相對表達量。
1.4 HIF-1α 蛋白表達檢測 采用苯甲基磺酰氟與細胞裂解液裂解各組細胞,12 000 r/min離心5 min,取上清,采用ELISA 法檢測細胞HIF-1α 蛋白表達。檢測過程嚴格按照試劑盒說明書進行操作。
1.5 MTT法檢測細胞的增殖活性 細胞接種于96孔板,培養24 h 后每孔加入80 μL 無血清培養基和20 μL MTT溶液,37 ℃孵育4 h后棄去孔內液體,加入150 μL 二甲基亞砜,低速震蕩10 min 后,用酶標儀檢測490 nm波長處的吸光度(OD)值。
1.6 熒光探針檢測細胞內鈣離子含量 分組處理各組細胞,1 000 r/min 離心5 min,棄上清,用DHanks 液重懸細胞,再加入Fura-2/AM,37 ℃避光孵育45 min,再用D-Hanks 液洗滌細胞2 次,3 mL DHanks液重懸細胞。熒光分光光度計激發波長分別為340 nm、380 nm,發射波長510 nm 雙波長測定負載探針細胞的熒光強度。
1.7 線粒體的提取及形態學鑒定 使用細胞裂解液裂解細胞,4 000 r/min 離心10 min,取上清;10 000 r/min 離心15 min,棄上清,收集沉淀為線粒體。將剛提取的線粒體均勻涂于載玻片上,加0.02%詹納斯綠B 染液,覆蓋玻片浸染10 min,用高倍鏡(400×)觀察線粒體形態。
1.8 線粒體通透性轉換孔(mPTP)開放程度檢測 提取兩組線粒體懸液,加入測定介質P(甘露醇230 mmol/L、蔗糖70 mmol/L、Hepes 3 mmol/L,pH值7.4)至3 mL,搖勻,另取3 mL 測定介質P 作為空白對照。mPTP開放可使線粒體內膜對甘露醇及蔗糖高通透性導致線粒體發生膨脹,此時線粒體OD值降低,故可通過檢測OD的變化來間接反映mPTP的開放程度。檢測過程嚴格按照試劑盒(上海亨代勞生物有限公司)說明書進行操作。用752N 型紫外分光光度計(青島聚創環保集團有限公司)測定540 nm 波長處的OD值。OD值越高,mPTP開放程度越低。
1.9 線粒體膜電位(Δψm)檢測 采用羅丹明123法檢測Δψm:在離體組織線粒體中,Δψm 攝取羅丹明123 導致熒光淬滅,并隨著Δψm 去極化,羅丹明123 熒光強度逐漸增強,故可通過檢測羅丹明123熒光強度變化來間接反映Δψm。檢測過程嚴格按照試劑盒(上海遠慕生物公司)說明書進行操作。用Cary Eclipse 熒光分光光度計檢測激發光480 nm、發射光525 nm 波長下Rh 123 的熒光強度。熒光強度越高,Δψm越低。
1.10 統計學方法 采用SPSS 19.0 統計軟件分析數據,計量資料以均數±標準差()表示,組間比較采用單因素方差分析,以P<0.05 為差異有統計學意義。
2 結果
2.1 Res干預后兩組GRC-1細胞增殖活性比較 Res 能顯著抑制兩組GRC-1 細胞增殖(均P<0.05),兩組細胞活力均隨Res濃度的增加而逐漸降低(P<0.05),但缺氧組細胞活力下降趨勢明顯緩于正常組,且缺氧組在不同濃度Res 干預下的細胞活力均顯著高于相同濃度正常組(均P<0.05),見圖1。
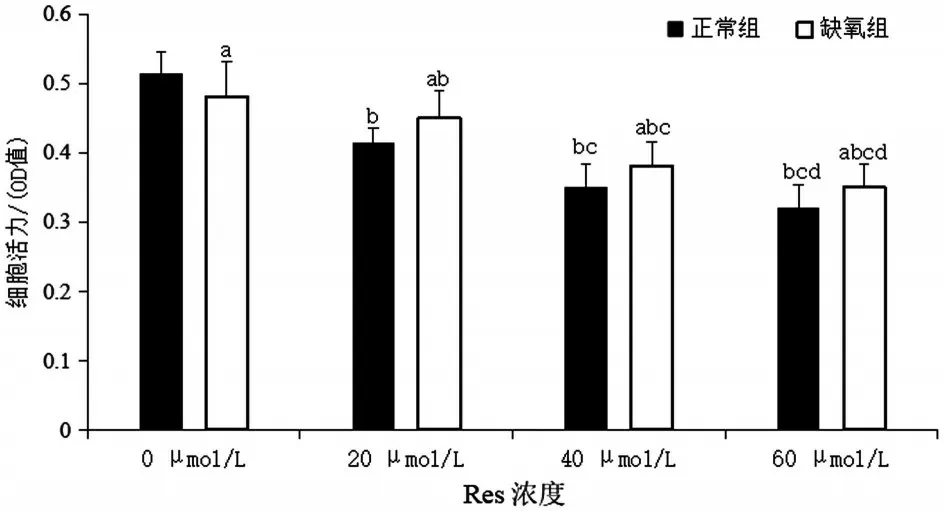
圖1 Res對GRC-1細胞增殖活性的影響
2.2 Res 干預后兩組GRC-1 細胞HIF-1α 基因及蛋白表達比較 兩組HIF-1α 基因及蛋白表達量均隨Res濃度的增加而逐漸降低(均P<0.05),缺氧組不同濃度Res 干預后HIF-1α 基因及蛋白表達量均顯著高于相同濃度正常組(均P<0.05),見表1。
表1 Res 干預后兩組GRC-1 細胞HIF-1α 基因及蛋白表達量比較
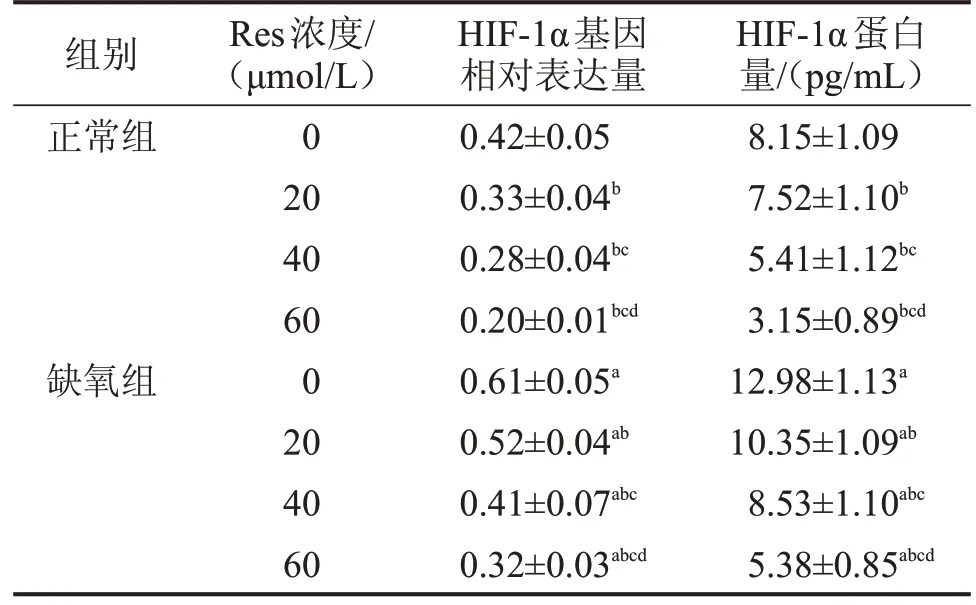
表1 Res 干預后兩組GRC-1 細胞HIF-1α 基因及蛋白表達量比較
與正常組同一濃度比較,aP<0.05;與本組0 μmol/L 比較,bP<0.05;與本組20 μmol/L比較,cP<0.05;與本組40 μmol/L比較,dP<0.05。
2.3 線粒體形態學鑒定 詹納斯綠B 染色結果顯示,提取的線粒體呈現圓形、橢圓形和桿狀的藍綠色顆粒,見圖2。
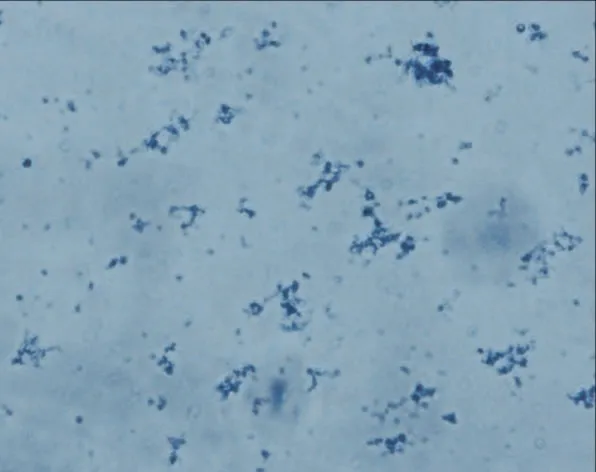
圖2 線粒體的詹納斯綠B染色(400×)
2.4 Res干預后兩組GRC-1細胞內鈣離子含量、熒光強度及OD值比較 兩組細胞內鈣離子含量均隨Res 濃度的增加而逐漸升高(均P<0.05),缺氧組20 μmol/L、40 μmol/L的Res干預后細胞內鈣離子含量顯著高于相同濃度正常組(均P<0.05);熒光強度越高,Δψm越低。兩組Δψm均隨Res濃度的增加而逐漸降低(均P<0.05),缺氧組不同濃度Res干預后Δψm 均顯著低于相同濃度正常組(均P<0.05);OD 值越高,mPTP 開放程度越低。兩組mPTP 開放程度均隨Res濃度的增加而逐漸升高(均P<0.05),缺氧組不同濃度Res干預后mPTP開放程度均顯著高于相同濃度正常組(均P<0.05),見表2。
表2 Res干預后兩組GRC-1細胞內鈣離子含量、熒光強度及OD值比較
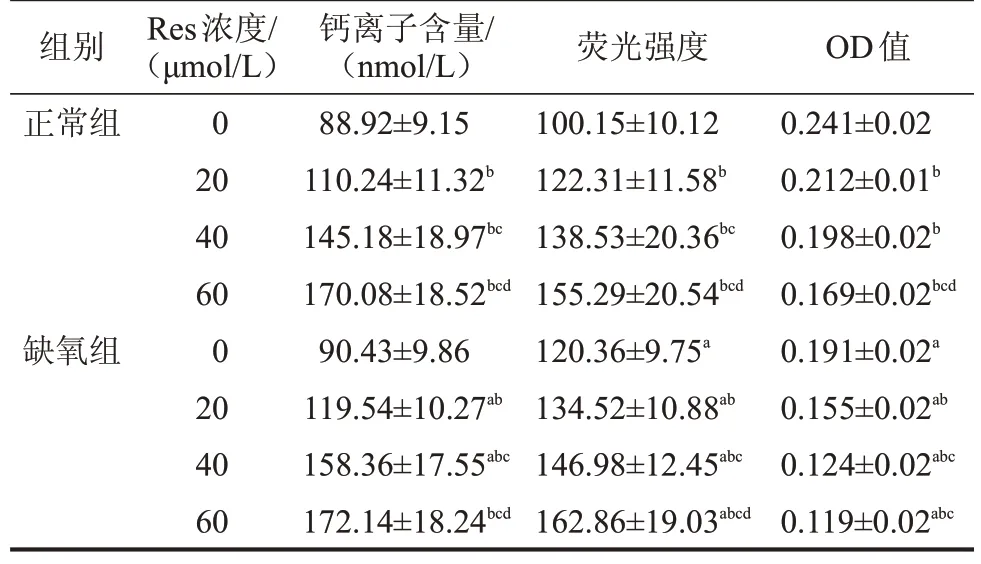
表2 Res干預后兩組GRC-1細胞內鈣離子含量、熒光強度及OD值比較
與正常組同一濃度比較,aP<0.05;與本組0 μmol/L 比較,bP<0.05;與本組20 μmol/L 比較,cP<0.05;與本組40 μmol/L比較,dP<0.05。
3 討論
與正常細胞比較,惡性腫瘤需要更多氧及能量維持其異常增殖及惡性傾向,其細胞間乏氧微環境不可避免,乏氧可誘導細胞內HIF-1α 穩定表達,繼而激活下游多種靶基因參與對乏氧的局部和整體調節[2];同時,乏氧導致的細胞內鈣超載會增加不溶性磷酸鈣含量[11],下調呼吸鏈電子傳遞速度,促氧化磷酸化解偶聯,影響線粒體功能[12]。線粒體作為氧化磷酸化“能量工廠”,是細胞維持正常生理功能的結構基礎;正常情況下,線粒體以電化學勢能方式將其能量儲存于線粒體內膜,偶聯與ATP生成的質子轉運引起線粒體膜兩側離子的不均勻分布,從而形成Δψm,而Δψm 又取決于線粒體內外的離子梯度,其中細胞內Ca2+起著關鍵性作用。Ca2+作為胞內介導信號傳導的重要信使,與線粒體離子平衡、陰離子蛋白交換、電荷轉移等密切相關[13],并參與調控作為線粒體關鍵樞紐的mPTP,亦影響Δψm,且與腫瘤發生發展關系密切[14]。Lemasters 等[15]研究表明,腫瘤由于細胞自身代謝高、相對乏氧環境等因素使其持續存在氧化應激,導致鈣超載,進而誘發mPTP開放,但持續開放的mPTP又將導致Δψm降低或喪失。故本實驗采用二氯化鈷構建缺氧GRC-1 細胞模型,并使用Res干預正常組和缺氧組細胞,通過觀察線粒體功能相關指標mPTP、Δψm、鈣離子變化水平,初步探討Res 參與腎癌細胞抗乏氧增殖的可能發生機制。
本實驗首先構建了缺氧GRC-1細胞模型,檢測正常組和缺氧組細胞內HIF-1α基因及蛋白表達,結果發現缺氧組顯著高于正常組,說明缺氧可誘導GRC-1 細胞表達HIF-1α 增加,這與既往研究[4]結果相符。當給予不同濃度Res 干預正常組和缺氧組GRC-1細胞,發現細胞內HIF-1α基因及蛋白表達逐漸降低,且相同濃度下缺氧組明顯高于正常組,這與缺氧誘導HIF-1α表達增加,而Res對HIF-1α抑制作用結果相吻合。本研究進一步提取細胞線粒體,檢測mPTP、Δψm、鈣離子,發現隨著Res干預濃度的增加,正常組和缺氧組GRC-1細胞內鈣離子含量逐漸升高,mPTP 逐漸開放,Δψm 逐漸降低,且變化程度缺氧組明顯高于正常組;然而MTT 結果提示,正常組和缺氧組GRC-1細胞增殖活性在Res干預后均表現出明顯下降作用,但缺氧組下降趨勢明顯緩于正常組,且缺氧組細胞在不同濃度Res 干預下的增殖活性均顯著高于相同濃度正常組。
本研究中,正常組細胞隨著Res 干預濃度的增加,HIF-1α 表達水平逐漸下降,細胞內鈣離子含量逐漸升高,Res 對GRC-1 細胞的抑制作用可能是通過增加細胞內鈣離子含量,誘導mPTP 開放,降低Δψm,使線粒體解偶聯功能受損,抑制產能而實現;但HIF-1α 是使細胞抗乏氧的有利基因,Res 升高鈣離子的同時也抑制了HIF-1α,而缺氧又促進HIF-1α表達,該作用逐漸拮抗了Res 抑制HIF-1α 表達效能,故缺氧組Res 對細胞的抑制作用弱于正常組。由此推測:Res可能通過上調細胞內鈣離子含量,使mPP開放,ΔΨm降低,使線粒體解偶聯功能受損,從而抑制細胞增殖,但該抑制作用隨著Res 對HIF-1α的進行性抑制而逐漸減弱,該作用可能參與了腎癌細胞的抗乏氧增殖機制。
本研究觀察到Res 能抑制HIF-1α 表達,并升高細胞內鈣離子水平,從mPTP開放、Δψm降低層面探討了線粒體結構及功能變化,但本實驗尚不能明確Res對鈣離子水平調節后是通過何種途徑作用于線粒體,本組將引入相關抑制劑或激動劑處理后深入研究其可能的發生機制。

