TRIM15表達水平與胃癌患者病理特征及近期預后的相關性
崔兆勛,魏 強,安家禎,任亞嬋,袁通曉,王 琛,劉 瑜
(陜西省森工醫院 1.腫瘤科;2.普外科,西安 710300;3.陜西省腫瘤醫院,西安 710061)
胃癌(gastric cancer,GC)是消化道腫瘤中最常見的一類,雖然近年來相關研究較多,進一步完善了GC 患者治療方案,但仍有部分患者由于病情進展較快等原因導致預后較差及生存時間較短的情況[1-2]。伴隨著分子生物學及基因組研究的逐步深入,基因與蛋白在惡性腫瘤疾病發生發展中的影響被逐步揭示,而三結構域蛋白家族(tripartite motif,TRIM)在機體免疫中扮演著重要的角色,既往國內、外多項研究顯示其與人體發生的多個惡性腫瘤有著顯著的關系[3-4]。TRIM15 是此家族中的一員,其表達與非小細胞肺癌、宮頸癌等多個惡性腫瘤疾病相關,主要是由于其作為調節細胞增殖的E3泛素連接酶,參與到腫瘤細胞的增殖分化過程,從而影響腫瘤疾病的發生發展過程[5]。本研究通過比較TRIM15 在GC 患者中表達水平與病理特征及預后之間的關系,旨在為GC 的診斷及治療提供新的參考方向。
1 對象與方法
1.1 研究對象 選擇2017 年1 月至2018 年6 月于陜西省森工醫院就診并確診GC的患者91例。病例納入標準:(1)符合NCCN2016 年頒布的胃癌臨床實踐指南中對于GC的診斷且符合手術治療標準[6];(2)患者年齡在18 歲以上;(3)首次診斷GC;(4)依從性良好,自愿接受隨訪。排除標準:(1)既往接受過抗腫瘤治療;(2)并發有其他組織惡性腫瘤;(3)嚴重的基礎疾病;(4)半月內感染或嚴重外傷史;(5)免疫系統疾病史;(6)長期免疫調節類藥物服用且無法停藥。本研究經醫院倫理委員會審核批準,且患者及家屬簽訂知情同意書。
1.2 方法
1.2.1 免疫組化檢測(1)組織脫水處理:對術中取下的瘤體組織進行切片,而后進行脫蠟并使用蒸餾水反復沖洗直至切片潔凈。(2)封閉內源性過氧化物酶:室溫下玻片置于3%過氧化氫液中10 min,并使用山羊血清封閉室溫下30 min 對切片進行抗原修復。(3)孵育一抗:PBS沖洗玻片3次,拭去多余水分后滴加50 μL 的1∶300 抗TRIMl5 抗體。滴加一抗后,玻片置于濕盒中在37 ℃溫箱中孵育50 min;用正常血清替換一抗作為陰性對照。(4)孵育二抗:用PBS 進行洗滌后,將載玻片與1∶1 000 稀釋的生物素標記二抗孵育30 min。(5)顯色:使用鏈霉抗生物素蛋白.辣根過氧化物酶孵育30 min,將二氨基聯苯胺用作發色團發色。(6)復染:PBS沖洗后,玻片置于蘇木精中約30 s進行細胞核復染。
1.2.2 隨訪 所有患者出院后按照文獻的相關標準進行隨訪[6],主要依托于電話及患者來院方式進行隨訪,時間為2年。
1.3 觀察指標及評判標準
1.3.1 免疫組化判斷標準 采用半定量法,TRIM15表達水平=染色陽性細胞數比例等級×染色強度等級。表達水平<6為低表達,≥6為高表達。(1)染色陽性細胞數比例判斷方法:于100倍鏡下選擇10個視野,觀察每個視野計數的100 個細胞中的陽性細胞數占比;(2)染色陽性細胞數比例等級判定標準:共分為4 級,其中0 級:陽性細胞<10%;1 級:陽性細胞10%~25%;2 級:陽性細胞26%~50%;3 級:51%~75%;4 級:76%~100%。(3)染色強度判斷標準0 級:無著色;1 級:淺棕色;2 級:棕色;3 級:深棕色。
1.3.2 臨床病理參數 包括年齡、性別、瘤體直徑、分化程度、浸潤深度、轉移情況、TMN分期及組織學分型。
1.3.3 預后評價 收集患者隨訪期間無病生存時間、存活時間、無病生存率及總存活率。
1.4 統計學方法
采用SPSS 25.0 軟件進行數據分析,計量資料以均數±標準差()表示,組間比較采用獨立樣本t檢驗;計數資料以百分率(%)表示,組間比較采用χ2檢驗;Kaplan-Meier 法分析TRIM15 不同表達量患者預后之間的生存曲線,Log Rank法比較兩組患者的無病生存和累積生存風險間的差異;根據無病生存情況對所有患者進行分組后采用COX 回歸分析無病生存狀態的影響因素,以P<0.05 為差異有統計學意義。
2 結果
2.1 患者分組及病理學特征比較
根據術后病灶免疫組化結果,將患者分為TRIM15 高表達組(n=54)和低表達組(n=37)。高表達組患者T1/T2浸潤深度、TMN分期為Ⅰ/Ⅱ占比顯著高于低表達組(P<0.05);其余病理學特征指標比較,差異無統計學意義(P>0.05),見表1。瘤體組織免疫組化結果,見圖1。
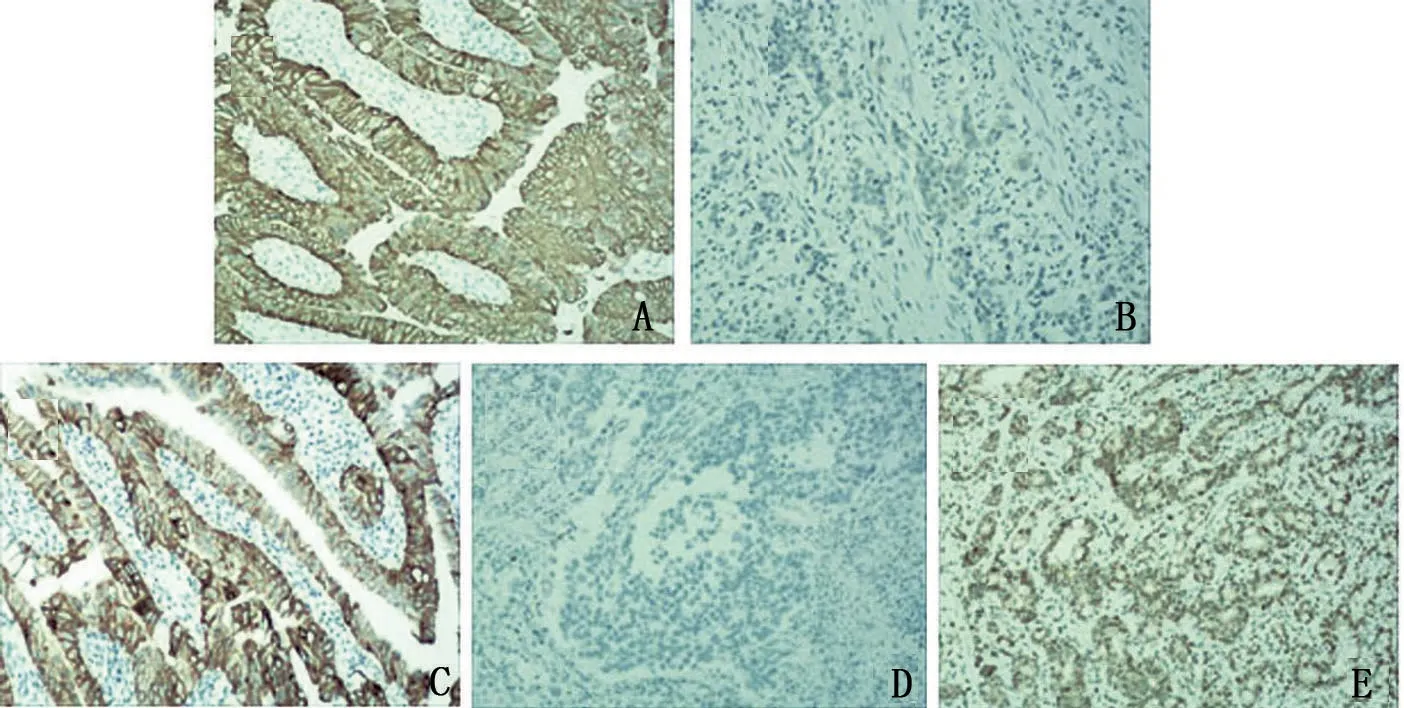
圖1 瘤體組織免疫組化結果(100×)

表1 患者病理學特征比較
2.2 兩組患者無病生存情況評價
91例患者中共計85例完成隨訪,隨訪完成率為93.41%。高表達組隨訪期間累積無病生存率為94.44%,低表達組累積無病生存率為70.27%,高表達組無病生存顯著高于低表達組(χ2=10.187;P<0.05)。Kaplan-Meier生存曲線圖,見圖2。

圖2 兩組患者隨訪期間無病生存率比較
2.3 兩組患者累積生存率情況評價
高表達組隨訪期間累積生存率為98.14%,低表達組累積生存率為83.78%。高表達組總存活率顯著高于低表達組(log-rankχ2=6.219;P<0.05),見圖3。

圖3 兩組患者隨訪期間生存率情況比較
2.4 GC患者無病生存的單因素分析
將所有完成隨訪患者按照無病生存情況分為預后良好組(n=71)和預后較差組(n=14),Cox單因素分析顯示,瘤體直徑和TRIM15 表達水平是影響患者預后的因素(P<0.05),見表2。
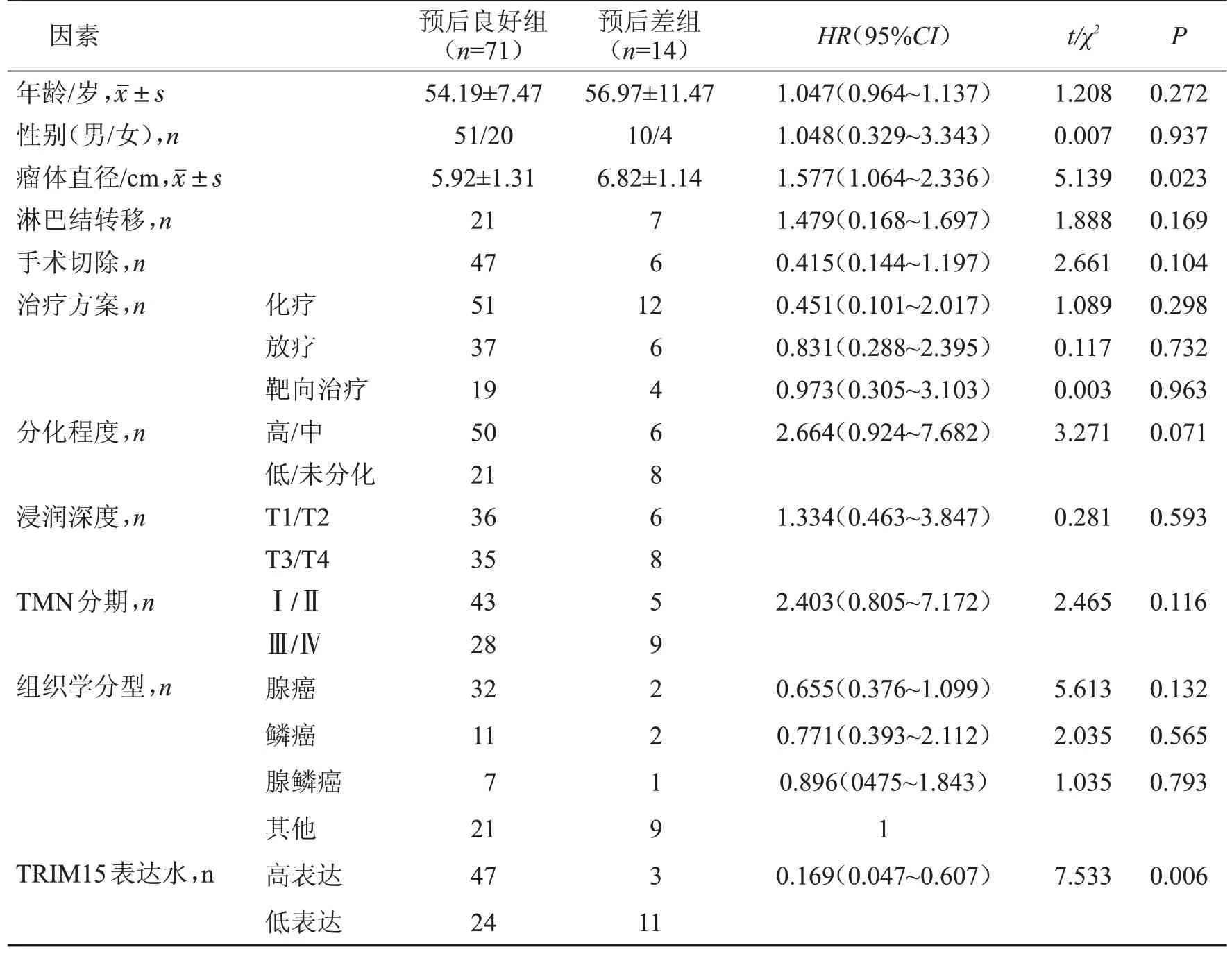
表2 GC患者預后的影響因素分析
2.5 影響無病生存狀態的Cox分析結果
以無病生存狀態為因變量,以單因素分析P<0.1的指標為自變量,結合患者時間軸進行Cox回歸分析,結果顯示,TRIM15是影響患者預后的獨立保護因素(HR=0.169,95%CI=0.047~0.607,P<0.05),見表3。

表3 GC患者預后的影響因素分析
3 討論
TRIM家族蛋白被定義為RING型E3泛素連接酶家族的一個亞家族,已經被研究發現的成員有60余種,可以調節生物體中廣泛的細胞生理過程[7-8]。絕大多數TRIM 家族蛋白均具有3 個特殊結構,首先為RING結構,此結構使得其具有E3泛素連接酶活性,可以與E2 共同作用介導靶蛋白泛素化修飾;其次為TRIM 家族特有的B-box 結構,目前對于此結構的研究尚不明確,但有研究結果顯示其可能也是具有E3泛素連接酶活性的結構;最后為卷曲螺旋結構,此為介導TRIM蛋白本身聚集或與其他TRIM蛋白共同作用形成大分子產物,同時還具有特異性亞細胞定位的功能[9-11]。泛素化的蛋白水解途徑在許多功能蛋白的降解中起著至關重要的作用,這些與DNA修復、轉錄調控和細胞信號有關,國內、外多項研究均顯示,泛素化修飾在GC 的發生及發展過程中起到了至關重要的作用[12-13]。目前,臨床上參與泛素化修飾的多個蛋白,如TWA1、Tensin等均已被證實顯著影響GC 患者的預后及病理特征,而TRIM15參與調節非小細胞肺癌及結腸癌的作用也得到了證實,但針對GC與TRIM15之間的關系研究卻相對較少[14-16]。
本研究結果提示,TRIM15表達量與GC浸潤深度及TMN 分期有相關性(P<0.05)。根據GC 的發生過程,癌細胞遷移是影響瘤體浸潤及擴散的重要因素,而TRIM15包含一個卷曲螺旋結構域,該結構域介導同二聚體、異二聚體以及高階多聚體相互作用,形成同源多聚成高分子量復合物,在細胞之間起到支架蛋白的作用,并將特異的信號蛋白募集到細胞ECM 粘附位點,從而調節癌細胞的侵襲及轉移[17-18]。從以上機制不難看出,TRIM15高表達可以束縛癌細胞像外擴散,從而降低其浸潤及擴散的可能性。而GC分化程度及組織學分型可能受其他途徑調控,此二者也與GC細胞轉移及擴散有關,但可能與TRIM15 介導的細胞黏附作用沒有顯著關系[19]。腫瘤直徑在受到癌細胞擴散影響的同時,也受到細胞分化程度的影響,雖然高表達TRIM15 可以有效抑制細胞轉移,但對于癌細胞分化的影響目前尚無證據表明二者之間具有相關性[20]。
通過對比不同TRIM15表達水平患者預后的結果也顯示,高表達組無病生存率及生存率均顯著高于低表達組(P<0.05),可能是由于高表達的TRIM15 可以防癌細胞擴散。有研究結果顯示,TRIM15參與到了束縛癌細胞擴散的黏附斑的形成過程,此過程中肌動蛋白動力學起到了關鍵的作用,同時,該研究還指出VASP、FBLIM1、CTTN以及CORO1B是調節肌動蛋白動力學的關鍵蛋白[21]。在Martinez-Quiles等[22]的研究中指出,CTTN的磷酸化狀態對于形成黏附斑的肌動蛋白動力學改變至關重要,當CTTN 被激活后可以與N-WASP 蛋白結合以進行肌動蛋白聚合,而酪氨酸磷酸化抑制NWASP介導的肌動蛋白聚合。最新一項研究中提示TRIM15高表達的細胞中,CTTN蛋白的絲氨酸磷酸化基礎水平較高,故說明TRIM15 可能是通過影響CTTN 磷酸化狀態達到抑制癌細胞遷移的作用,從而達到改善預后的效果[23]。
在本研究中,TRIM15 表達量是影響患者預后的獨立因素(P<0.05),再次說明了此蛋白在GC 的發展過程中的重要性,但是在Uchil等[24]的研究中指出,雖然TRIM15 雖然是影響細胞黏附作用的重要因素,但其確切機制還有待進一步研究予以確定。同時,既往多個研究中均指出,治療方案、分化程度、浸潤深度及組織學分型等病理特征對于患者預后是顯著的[25-26],但是在本次研究的患者中上述因素分析后并非影響預后的因素,可能是由于本次研究樣本量較小、隨訪時間相對較短所致。既往研究中指出,GC 規范化治療后患者中位生存期可以達到48 個月[27],但本次研究由于時間及經費限制,隨訪時間僅為24個月,顯著低于既往研究的中位生存時間,這也是本次研究的問題,故在今后研究中需要進一步延長隨訪時間。
綜上,TRIM15 表達量與GC 患者浸潤深度及TNM分期等病理特征以及預后具有顯著的相關性,但仍需要進一步研究明確影響機制。

