涎腺分泌性癌12例臨床病理學分析
孫文佳,徐鵬飛,張天銘,王滿香,漆楚波,岳君秋,郭 芳
涎腺分泌性癌(salivary secretory carcinoma, SSC)是新近發現的頭頸部腫瘤,2010年由Skálová等[1]首次提出。該腫瘤好發于涎腺,以腮腺為主,亦可發生于甲狀腺[2]、皮膚[3]、肺[4]等,具有與乳腺分泌性癌類似的組織學形態及分子遺傳學特征。SSC與腺泡細胞癌或腺癌(非特指)不同,在遺傳學上具有特異性的t(12; 15)(p13; q25),產生ETV6-NTRK3融合。迄今為止文獻報道較少,臨床工作中常對其認識不足。pan-TRK是新發現的生物學標志物,該靶點的靶向藥物在國外已應用于臨床。本文著重探討pan-TRK抗體在診斷SSC中的價值,并結合相關文獻進行分析,為臨床與病理醫師提供參考。
1 材料與方法
1.1 臨床資料收集2016年1月~2020年12月華中科技大學同濟醫學院附屬湖北腫瘤醫院診治的12例SSC,其中5例為外院會診病例(部分原單位病理診斷為腺泡細胞癌)。收集患者臨床資料包括年齡、性別、腫塊部位、首發癥狀及影像學檢查結果,通過電話隨訪患者疾病進展情況,截至日期為2021年1月11日。
1.2 方法標本均經10%中性福爾馬林固定,切片,常規HE染色。免疫組化采用EnVision兩步法染色。一抗S-100、DOG1、CK7購自北京中杉金橋公司,使用intelliPATH染色儀進行染色;GATA3、Mammaglobin購自DAKO公司,應用AutostainetLink 48染色儀進行染色;抗廣譜TRK(pan-TRK,EPR1734)購自Roche公司,應用BenchMark ULTRA染色儀進行檢測。熒光原位雜交(fluorescence in situ hybridization, FISH)檢測:ETS變異體6基因(ETV6)/神經營養酪氨酸激酶受體3型(NTRK3)基因融合探針購自廣州安必平公司。具體操作步驟嚴格按試劑盒說明書進行。
1.3 判讀標準(1)免疫組化:CK7陽性信號定位于細胞膜或細胞質,DOG1陽性信號定位于細胞膜及細胞質,Mammaglobin陽性信號定位于細胞質,S-100陽性信號定位于細胞核及細胞質,GATA3陽性信號定位于細胞核,pan-TRK陽性信號定位于細胞膜、細胞質、細胞核及核膜。(2)FISH檢測:正常情況下被檢測基因不發生融合,顯示為紅、綠信號分離;如紅、綠信號疊加,即呈黃色,提示被檢測基因發生融合重排。判讀標準:每個標本計數100個非重疊腫瘤細胞核,若紅、綠信號重疊呈黃色信號細胞數比例大于15%為陽性,即被檢測基因融合易位為陽性。
2 結果
2.1 臨床特點本組男性7例,女性5例;年齡15~78歲,中位年齡48歲。12例SSC均發生于涎腺,包括腮腺9例、頜下腺2例和氣管小涎腺1例。除發生于氣管小涎腺的1例(例6)有明顯呼吸喘氣費力癥狀外,其余11例均因發現無痛性腫塊而就診。影像學檢查手段主要為彩超,其次是CT和MRI,彩超多顯示為實性結節,部分可見無回聲區;CT示軟組織密度腫塊影,增強不均勻強化;MRI示密度不均勻腫塊影,部分可見液體密度影,增強掃描見邊緣明顯強化(表1)。
2.2 病理檢查眼觀:腫瘤大體多為實性灰白色結節,最大徑0.5~5 cm,平均2.4 cm。鏡檢:低倍鏡下腫瘤無包膜,可邊界清楚,也可浸潤性生長。腫瘤形態結構多樣,包括巢狀、微囊、乳頭狀、實性和小管狀結構(圖1)。微囊和小管的腔內常充滿黏液及嗜酸性膠樣分泌物,可伴有出血、膽固醇結晶、泡沫狀組織細胞聚集(圖2)。高倍鏡下瘤細胞界限不清,細胞質豐富嗜酸性、絮狀或多泡狀;細胞核大小不一,多為卵圓形;核染色質淡,核膜清楚,可見單個小核仁(圖3)。僅例6可見脈管癌栓、核分裂象及壞死(圖4)。
2.3 免疫表型及分子檢測9例腫瘤細胞CK7呈彌漫陽性,9例S-100彌漫細胞核及細胞質陽性(圖5),2例S-100部分陽性,8例Mammaglobin彌漫細胞質陽性(圖6),1例Mammaglobin部分陽性,2例Mammaglobin局灶陽性,5例GATA3彌漫細胞核陽性(圖7)。9例行DOG1檢測,其中4例為局灶陽性,1例部分陽性,4例為陰性;6例行pan-TRK檢測,其中3例呈彌漫細胞核陽性(圖8),1例約10%腫瘤細胞核陽性及核仁陽性,2例為單純核仁陽性(圖9)。12例中有5例行FISH檢測結果顯示,ETV6-NTRK3基因均有融合(圖10)。
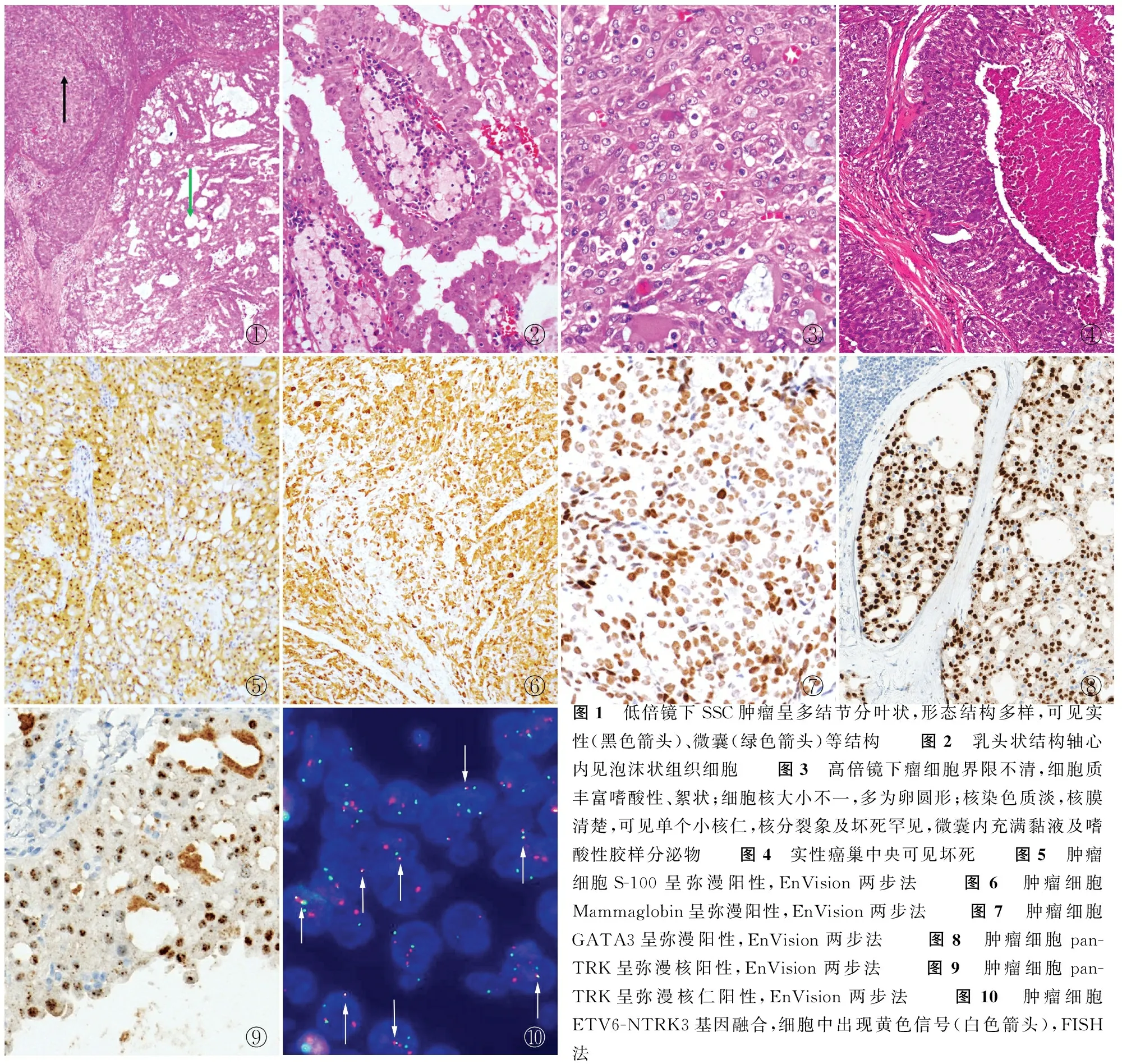
①②③④⑤⑥⑦⑧⑨⑩圖1 低倍鏡下SSC腫瘤呈多結節分葉狀,形態結構多樣,可見實性(黑色箭頭)、微囊(綠色箭頭)等結構 圖2 乳頭狀結構軸心內見泡沫狀組織細胞 圖3 高倍鏡下瘤細胞界限不清,細胞質豐富嗜酸性、絮狀;細胞核大小不一,多為卵圓形;核染色質淡,核膜清楚,可見單個小核仁,核分裂象及壞死罕見,微囊內充滿黏液及嗜酸性膠樣分泌物 圖4 實性癌巢中央可見壞死 圖5 腫瘤細胞S-100呈彌漫陽性,EnVision兩步法 圖6 腫瘤細胞Mammaglobin呈彌漫陽性,EnVision兩步法 圖7 腫瘤細胞GATA3呈彌漫陽性,EnVision兩步法 圖8 腫瘤細胞pan-TRK呈彌漫核陽性,EnVision兩步法 圖9 腫瘤細胞pan-TRK呈彌漫核仁陽性,EnVision兩步法 圖10 腫瘤細胞ETV6-NTRK3基因融合,細胞中出現黃色信號(白色箭頭),FISH法
2.4 治療及預后12例患者均行根治性腫瘤切除術,2例另行區域淋巴結清掃;6例患者術后進行局部放療。8例患者獲得隨訪,截至2021年1月11日,中位隨訪時間24.5個月(8~28.5個月),均無復發或轉移(表1)。
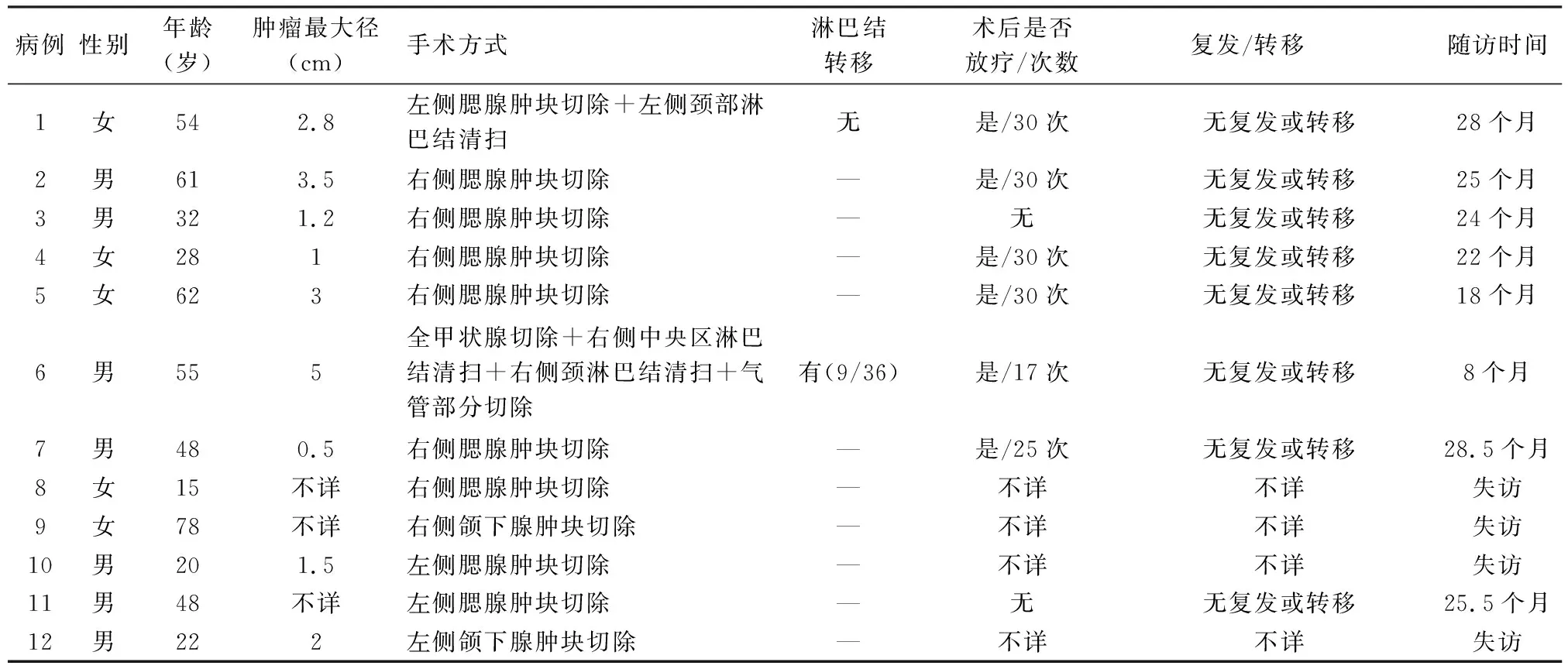
表1 12例SSC患者的臨床資料及隨訪
3 討論
SSC常見于成人,發病年齡13~77歲,平均45歲,男性稍多。常見部位為腮腺約占70%,頜下腺約占7%,其他部位較少見,如軟腭、頰黏膜、舌根和唇。臨床多表現為無痛性腫塊,腫瘤平均直徑2 cm[5]。本組12例中有11例因發現無痛性腫塊就診,男性7例,女性5例;年齡15~78歲,中位年齡48歲,與文獻報道相似。
SSC鏡下腫瘤結構多樣,本組有以下特點:(1)腔內黏液及嗜酸性膠樣分泌物;(2)腫瘤細胞質豐富嗜酸性、絮狀。另外,有9例伴出血,6例出現泡沫狀組織細胞散在分布,為SSC診斷提供線索。文獻報道高級別SSC的組織學特征,以實性和梁狀結構為主,伴壞死,分泌物少見,腫瘤細胞體積大,伴顯著核仁[6]。本組例6鏡下核分裂象易見,且出現壞死、脈管癌栓,頸部淋巴結36枚中有9枚可見癌轉移,提示為高級別SSC。
SSC特征性免疫表型為S-100和Mammaglobin均呈彌漫強陽性,兩者的診斷敏感性大于95%,但并無特異性[5]。另外,SSC中GATA3、GCDFP15、CKpan、CK7、CK8、CK18、CK19、EMA、vimentin、MUC1、MUC4、STAT5a可呈陽性;而高分子量角蛋白、基底細胞/肌上皮標志物(如Calponin、SMA、CK14、CK5/6和p63)和DOG1一般陰性,少數病例可有局灶陽性[5]。NTRK基因融合可通過RT-PCR、FISH、NGS等技術進行檢測,但費用較高,在基層單位開展較為困難;免疫組化與分子檢測相比,成本較低、設備簡單、易開展[7]。pan-TRK抗體可識別NTRK1/2/3基因編碼的Trk-A、Trk-B、Trk-C蛋白的C末端區域,免疫組化pan-TRK(EPR1734)檢出NTRK重排的敏感性高達97%,特異性高達98%[8]。2019歐洲腫瘤內科學會(ESMO)指南建議可以用pan-TRK免疫組化法進行初步篩選,陽性樣本再經NGS法證實[9]。pan-TRK免疫組化染色模式多種多樣,與融合蛋白的細胞定位有關,具有NTRK1或NTRK2重排的腫瘤pan-TRK陽性通常定位于細胞質,而具有NTRK3重排的腫瘤具有細胞核或細胞質染色[9]。本組6例行pan-TRK免疫組化檢測,3例彌漫核陽性病例中有2例ETV6-NTRK3融合基因檢測結果為陽性;1例pan-TRK局灶細胞核及核仁陽性,其ETV6-NTRK3融合基因陽性;另2例pan-TRK為單純核仁陽性,其中1例檢測出ETV6-NTRK3融合基因陽性。目前,文獻報道pan-TRK染色模式有細胞膜、核膜、細胞質、細胞核陽性[10],但核仁陽性尚未見報道。本組6例使用同一儀器同時染色,并設立陽性對照排除非特異性著色,提示核仁陽性可能亦是pan-TRK的免疫表達模式。SSC特征性的分子遺傳學改變為復發性平衡染色體t(12;15)(p13;q25)易位,導致ETV6-NTRK3基因融合。SSC中NTRK3并不是ETV6唯一的融合伴侶,相關研究發現多個新的融合伴侶,包括RET[11]、MET[12]和MAML3[13]。最近有文獻報道1例具有兩種基因融合(ETV6-RET和EGFR-SEPT14)的SSC[14],其進一步擴展了SSC的分子譜。
SSC易與腺泡細胞癌混淆,腺泡細胞癌也可出現微囊狀結構、黏液分泌物,但腺泡細胞癌的細胞及細胞核圓形一致,而SSC細胞核大小不一,多為卵圓形;腺泡細胞癌細胞質呈嗜堿性顆粒狀,富含酶原,而SSC細胞質嗜酸性、絮狀,缺乏酶原顆粒[5]。因此,仔細觀察鏡下形態可為診斷提供蛛絲馬跡。免疫組化標記DOG1對鑒別SSC和腺泡細胞癌有幫助,SSC中DOG1即使有陽性也只局限于腫瘤細胞巢周圍,而在腺泡細胞癌中通常呈彌漫陽性。本組有9例行DOG1檢測,僅1例呈部分陽性,其余均為陰性或局灶陽性,不支持腺泡細胞癌的診斷,對于DOG1陽性細胞較多的病例,需結合其他免疫指標輔助診斷。
Ayre等[15]報道22例SSC,臨床行為惰性,復發風險低,與其他低度惡性涎腺腫瘤無顯著差異,少數病例可出現復發和轉移[16]。由于病例數較少,目前對其治療方式并無統一標準,以手術切除為主,對于進展期病例或切緣陽性者,常行頸部淋巴結清掃及輔助放、化療[17]。本組SSC的常規處理方式為手術加局部放療,其中有2例術后未行放療,分別隨訪24、25.5個月,未見復發或轉移,是否進行術后局部放療還需積累病例進一步分析。多數SSC存在ETV6-NTRK3基因融合,2018、2019年美國食品和藥物管理局(FDA)先后批準兩款TRK抑制劑拉羅替尼及恩曲替尼,用于治療攜帶NTRK基因融合的多種實體瘤患者。多項有關拉羅替尼及恩曲替尼的臨床試驗結果表明,兩者在局部晚期或轉移性腫瘤患者中具有持久的抗腫瘤活性作用及良好的耐受性[18-19],為晚期SSC患者帶來更多的治療選擇。

