脂肪組織棕色化在惡病質脂肪消耗中的作用*
吳 濤, 李 曉, 馬度芳△
(1山東中醫藥大學第一臨床醫學院,山東濟南250000;2山東中醫藥大學附屬醫院,山東濟南250014)
惡病質(cachexia)是一種以體重減輕、肌肉萎縮和脂肪組織功能障礙為特征,伴有代謝紊亂、全身炎癥和胰島素抵抗的多因素綜合征[1]。惡病質通常與一些潛在的慢性退行性疾病有關,如癌癥、終末期心力衰竭、慢性阻塞性肺疾病和慢性腎功能衰竭等。肌肉丟失長期以來主導著惡病質的研究而我們對患者脂肪流失的原因卻知之甚少。脂肪組織也是惡病質不可忽視的參與者,它不僅為機體儲存能量,而且是一個異質的、代謝活躍的器官,在全身具有重要的內分泌和旁分泌作用[2]。
越來越多的證據表明,惡病質時機體會誘導脂肪組織的過度異常分解,而其中白色脂肪組織棕色化是導致脂質動員和機體能量消耗增加的主要原因,減少白色脂肪組織棕色化被認為是改善惡病質/高代謝狀態患者預后有價值的策略[3]。本篇綜述總結了惡病質中導致白色脂肪組織棕色化的主要機制,提示我們未來可以圍繞脂肪組織棕色化機制來開發預防和治療惡病質的藥物。
1 人體脂肪組織的分類
人體內存在著3 種脂肪組織:白色脂肪、棕色脂肪和米色脂肪。這3 種脂肪組織在人體中均發揮著不同的作用。白色脂肪主要作用是合成脂質、儲存能量。白色脂肪細胞包含一個占細胞大部分體積的單眼脂滴和一個由結構蛋白和酶組成的外殼。攝入食物后,脂蛋白釋放脂蛋白脂酶(lipoprotein lipase,LPL),把過量的游離脂肪酸(free fat acid,FFA)酯化成三酰甘油(triacylgycerol,TAG)而儲存在脂滴中[4],并能夠通過分泌脂肪因子、細胞因子等連接適應性免疫系統來影響局部和全身代謝[5]。棕色脂肪主要分布在頸部和肩胛部,通過線粒體脂質氧化解偶聯產生熱量,維持人體的能量平衡。棕色脂肪細胞內有大量富含線粒體的多房脂滴結構從而使其呈現棕色,這些線粒體會表達較多的解偶聯蛋白1(uncoupling protein-1,UCP-1)并通過線粒體內膜的質子泄漏作用將氧化磷酸化產生的化學能轉化為熱量而不是三磷酸腺苷(adenosine triphosphate,ATP)的生成耗散[6],所以UCP-1常作為棕色脂肪激活的標志。米色脂肪細胞則介于白色和棕色脂肪細胞之間,當機體受到寒冷、炎癥或腫瘤等刺激時,白色脂肪會過表達過氧化物酶體增殖物激活受體γ(peroxisome proliferator-activated receptor γ,PPARγ)、PPARγ 輔激活子1α(PPARγ coactivator 1α,PGC1α)、含PR 結構域蛋白 16(PR domain-containing protein 16,PRDM16)等調控因子,調節UCP-1 的表達,增加線粒體密度,變成功能類似于棕色脂肪的米色脂肪[7-8],這種從白色到米色表型的轉變被稱為脂肪組織棕色化。
2 惡病質與白色脂肪棕色化的關系
越來越多的研究發現惡病質與白色脂肪棕色化有著密不可分的關系。在結直腸癌惡病質小鼠模型中發現脂肪積累和脂肪酸β 氧化的關鍵調節因子發生變化,尤其是UCP-1蛋白的表達增加[9];Lewis肺癌(Lewis lung cancer,LLC)惡病質小鼠也表現出高代謝狀態,在白色脂肪組織和肩胛間棕色脂肪組織均表現出產熱因子[如UCP-1、碘化甲腺原氨酸脫碘酶2(iodothyronine deiodinase 2,DIO2)和 PGC1α]的較高表達[10],表明惡病質小鼠模型中某些因素會通過增加棕色脂肪組織活性并刺激白色脂肪組織棕色化來提高機體代謝。而在用正電子發射斷層/計算機斷層掃描(positron emission tomography/computed tomography,PET/CT)評價前列腺癌癥惡病質患者脂肪組織代謝與腫瘤狀態的相關性時發現脂肪組織棕色化進程與腫瘤分期和血清前列腺特異性抗原(prostate-specific antigen,PSA)水平呈顯著正相關,說明惡病質有加快白色脂肪組織棕色化進程的作用[11]。在燒傷惡病質的代謝應激中發現皮下白色脂肪轉變為米色脂肪,并且白色脂肪組織UCP-1 mRNA 的過表達、多房脂肪細胞的出現以及線粒體密度和呼吸能力的增加也證實了白色脂肪在惡病質狀態下的棕色化趨勢[12]。
盡管棕色脂肪在惡病質的研究中越來越受到重視,但是人類平均僅擁有約60 g 的棕色脂肪,在輕度冷刺激期間其每日能耗約在 15~25 kcal[13],僅占總基礎代謝率的3%~5%[14]。因此,只考慮人體本身含有的棕色脂肪在惡病質病程中的能量耗散是遠遠不夠的,還應認識到:白色脂肪組織棕色化形成米色脂肪,進而導致的高代謝作用也是總能量消耗顯著增加的重要原因[15]。
3 脂肪組織棕色化在惡病質中的危害
惡病質患者脂肪棕色化過程中會刺激脂肪分解,增加血清膽固醇水平,特別是低密度脂蛋白(lowdensity lipoprotein,LDL)和極低密度脂蛋白(verylow-density lipoprotein,VLDL),同時脂肪組織在棕色化過程中分泌的抑制脂肪分解的脂聯素(adiponectin)減少,促使斑塊形成和異位脂肪沉積,增加動脈粥樣硬化、脂肪肝和胰島素抵抗的發生。脂肪棕色化還對機體的炎癥反應有重要影響。有研究表明,燒傷患者血清中豐富的FFA 可誘導核苷酸結合寡聚化結構域樣受體蛋白3(nucleotide-binding oligomerization domain-like receptor protein 3,NLRP3)-含caspase 募集結構域的凋亡相關斑點樣蛋白(apoptosisassociated speck-like protein containing a caspase recruitment domain,ASC)炎癥小體的激活[12],隨后引起肝細胞和脂肪細胞中白細胞介素1(interleukin-1,IL-1)的分泌,嚴重情況下會導致細胞凋亡而引起肝衰竭[7]。同時,形成的米色和棕色脂肪細胞會攝取白色脂肪組織水解釋放的FFA,再通過激活線粒體內膜外表面的UCP-1,使FFA 氧化后以熱能形式耗散,增加惡病質患者靜息能量消耗水平,導致脂肪和骨骼肌組織消耗和嚴重的機體虛弱狀態[3]。
4 惡病質時使白色脂肪組織棕色化的機制
4.1 甲狀旁腺激素(parathyroid hormone,PTH)及其相關蛋白(PTH-related protein,PTHrP) PTH 由甲狀旁腺分泌,作用于骨骼和腎臟,維持機體鈣穩態。研究者在LLC 小鼠模型中發現,PTHrP 通過激活UCP-1 來觸發白色脂肪組織棕色化,而抑制癌癥惡病質小鼠模型脂肪組織的PTH 受體(PTH receptor,PTHR)后,這些小鼠體內的白色脂肪棕色化和惡病質程度減輕[16],側面表明了PTHrP 對惡病質白色脂肪組織棕色化的影響。為了證明PTH 對人脂肪細胞產熱和代謝活性的影響,Hedesan等[17]用重組PTH 刺激人類供體中分離出的皮下白色脂肪細胞,結果顯示體外分化的人皮下脂肪細胞在給予PTH 刺激后,PRDM16 與幾種轉錄因子[PPARα、PPARγ、CCAAT/增強子結合蛋白(CCAAT/enhancer-binding protein,C/EBP)]相互作用,顯著增加UCP-1和其他產熱基因的表達,誘導白色脂肪組織棕色化,使脂肪細胞線粒體活性和氧化呼吸能力明顯升高[18]。此外,在相當多的肺癌和結腸癌患者(47 名患者中有17 名)中也檢測到高水平的PTHrP[19],并且發現升高的PTHrP水平可以增加人類棕色和米色脂肪的代謝活性并驅動白色脂肪組織棕色化,使惡病質患者體重減輕[20]。這提示PTH 可能通過對PRDM16 的影響調節UCP-1等產熱因子的表達,從而使脂肪組織棕色化。
4.2 IL-6 IL-6 是一種功能廣泛的多效性細胞因子,可調節多種細胞的生長和分化,調節免疫應答、急性期反應及造血功能,并在機體的抗感染免疫反應中發揮重要作用。有證據表明,IL-6 水平在惡病質的早期逐漸升高,并且在死亡前1 周會急劇升高[21]。Petruzzelli 等[22]發現,與移植表達IL-6 的結腸癌模型小鼠相比,IL-6表達缺失的結腸癌小鼠模型惡病質程度減輕,且UCP-1 表達降低,提示IL-6 可促使白色脂肪棕色化,加重惡病質。Abdullahi 等[23]在燒傷后惡病質小鼠模型血清中也檢測出高水平的IL-6,并在正常小鼠燒傷惡病質模型中發現皮下脂肪從白色到米色的表型轉換,脂肪組織棕色化標志物UCP-1表達增加。而在IL-6沉默的燒傷小鼠模型中,惡病質引起的體重減輕和脂肪組織消耗顯著減少,基因和組織學分析也顯示燒傷后脂肪中多房、UCP-1表達的脂肪細胞較單純燒傷小鼠模型減少。這些研究提示IL-6 水平升高會上調白色脂肪組織UCP-1 的表達,誘導白色脂肪組織棕色化,從而加速機體的能量消耗和惡病質的進程。
4.3 巨噬細胞和嗜酸性粒細胞 巨噬細胞和嗜酸性粒細胞來源于骨髓造血干細胞,是機體免疫反應的重要參與者。研究表明,惡病質狀態下的脂肪組織中,被嗜酸性粒細胞浸潤的單核細胞根據局部微環境分化為具有特定功能表型的M2 型巨噬細胞并誘導白色脂肪組織棕色化[24]。這提示巨噬細胞的交替激活和嗜酸性粒細胞的募集與白色脂肪棕色化有關[25]。Abdullahi等[26]在燒傷惡病質小鼠腹股溝白色脂肪中發現M2 型巨噬細胞浸潤增加并且脂肪棕色化相關因子 UCP-1、PPARγ 和PRDM16 等表達升高,同時檢測到燒傷惡病質小鼠脂肪組織中酪氨酸羥化酶及IL-6 介導的兒茶酚胺上調。相反,在M2 型巨噬細胞募集狀態下,通過抑制去甲腎上腺素能信號的細胞因子和兒茶酚胺的表達也能抑制米色脂肪組織的產熱活性[25]。這提示惡病質狀態下M2 型巨噬細胞主要通過上調酪氨酸羥化酶釋放去甲腎上腺素和影響IL-6 介導兒茶酚胺的產生來控制白色脂肪的棕色化和米色脂肪的活性[27]。
4.4 鳶尾素(irisin) 鳶尾素是一種由肌肉分泌的多肽激素,并隨著運動的增加而增加,同時也會誘導白色脂肪組織棕色化[28-29]。Aydin等[30]用鳶尾素抗體進行免疫組織化學染色,對比胃腸癌與正常組織時發現癌癥惡病質狀態下鳶尾素的分泌增加。Zhang等[29]發現鳶尾素在人類皮下白色脂肪組織中通過激活細胞外信號調節激酶(extracellular signal-regulated kinase,ERK)和絲裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信號通路增加了UCP-1的表達,并且脂肪組織中產熱基因的表達與皮下白色脂肪組織對鳶尾素的棕色化反應呈正相關。這提示惡病質時體內升高的鳶尾素水平可能增加UCP-1表達,誘導白色脂肪棕色化而參與惡病質脂肪消耗[31]。
4.5 鋅-α2-糖蛋白(zinc-α2-glycoprotein,ZGA) 脂質動員因子ZGA 是一種重要的血漿蛋白,近年來發現其水平在癌癥、終末期心力衰竭等疾病中升高[26-27]。Russell等[32]發現,在腫瘤誘導的惡病質小鼠模型中,刺激白色和棕色脂肪組織中ZGA 可增加脂肪動員,促進脂肪消耗。為了探究ZAG 導致白色脂肪組織棕色化的內在機制,Elattar 等[33]用 ZAG 重組蛋白刺激白色脂肪祖細胞后發現ZAG可強烈增強細胞的棕色樣分化。在分子水平上,ZAG 刺激PPARγ和早期B 細胞因子2(early B-cell factor 2,Ebf2)的表達,通過促進 Ebf2/PPARγ 募集到PRDM16啟動子而誘導PRDM16 表達,導致UCP-1 表達增加。這些結果表明,ZAG 通過刺激 PPARγ、Ebf2 和 PRDM16 的表達,促進白色脂肪祖細胞分化為棕色樣脂肪細胞。
4.6 外泌體與微小RNA(microRNA,miRNA,miR)
外泌體即30~100 nm 的細胞外囊泡,在腫瘤轉化惡病質的過程中通過釋放miRNA 調節脂肪組織棕色化來增加機體的能量消耗,促進惡病質進程。Zhang等[34]發現胃癌患者的血漿外泌體中環狀RNA(circular RNA,circRNA)和miRNA 具有特異性表達特征并且與胃癌患者白色脂肪組織的棕色化有關。胃癌細胞的外泌體遞送ciRS-133 到前脂肪細胞中,通過激活PRDM16 和抑制miR-133 的功能在轉錄水平上促進白色脂肪細胞的棕色化。換句話說,來源于胃腫瘤的外泌體circRNA 通過靶向miR-133/PRDM16途徑促進白色脂肪組織棕色化[35]。除在胃癌細胞中特異性表達的ciRS-133和miR-133外,還有其他多種miRNA 參與了白色脂肪棕色化化調節,如來源于腫瘤外泌體的miR-155 通過下調PPARγ 介導脂肪細胞的能量代謝。Wu 等[36]還發現在乳腺癌細胞和過表達miR-155 的脂肪細胞一起培育的脂肪細胞中,參與脂質積累的PPARγ 和p-PPARγ 蛋白水平顯著降低,而在miR-155敲除的乳腺癌細胞和miR-155缺陷的小鼠中其蛋白水平升高,激活了棕色脂肪組織功能并促進了白色脂肪組織的棕色化[37]。這說明miR-155 通過降低PPARγ 及其相關蛋白的表達抑制脂肪組織的棕色化。
4.7 信號調節蛋白 α(signal regulatory protein α,SIRPα) SIRPα 通常被認為是一種參與胰島素抵抗的膜糖蛋白,但近幾年也發現了SIRPα 對機體代謝的調節作用。Wu 等[38]在慢性腎臟病(chronic kidney disease,CKD)惡病質小鼠中發現SIRPα 在白色脂肪中的表達約增加3 倍,同時棕色化介質磷酸化激素敏感性脂肪酶(phosphorylated hormone-sensitive lipase,p-HSL)和磷酸化cAMP 反應元件結合蛋白(phosphorylated cAMP-response element binding protein,p-CREB)的蛋白水平也相應提高,這些反應導致白色脂肪組織中UCP-1 增加并誘發白色脂肪棕色化,而SIRPα敲除的CKD 惡病質小鼠其肌肉和脂肪組織損失明顯減少,且血清SIRPα 水平和脂肪組織UCP-1 蛋白表達明顯降低。與健康人群相比,晚期CKD惡病質患者血清SIRPα增加了2.4倍,白色脂肪棕色化介質及UCP-1 表達也相應增加。以上研究說明SIRPα在惡病質脂肪棕色化進程中通過誘導UCP-1表達參與調節了脂肪和肌肉組織的分解代謝。
4.8 利尿鈉肽 利尿鈉肽是一組參與維持機體水鹽平衡、血壓穩定、心血管及腎臟等器官功能穩態的多肽,主要由心房利尿鈉肽、腦利尿鈉肽和C 型利尿鈉肽組成[39]。在人脂肪細胞中,利尿鈉肽可能通過激活PGC1α 和UCP-1 的表達,誘導線粒體發生,增加解偶聯和總呼吸,促進白色脂肪細胞棕色化以增加能量消耗。Bordicchia 等[40]發現暴露于低溫的小鼠棕色和白色脂肪組織中循環的利尿鈉肽水平和利尿鈉肽信號受體表達增加,利尿鈉肽清除受體表達降低,產熱因子(如UCP-1)的表達升高,并且向小鼠輸注腦利尿鈉肽可顯著增加白色脂肪組織中UCP-1和PGC1α 的表達,從而增加呼吸和能量消耗,這為利尿鈉肽在惡病質狀態下脂肪組織的棕色化提供了理論基礎。在 CKD 惡病質小鼠體內,Luce 等[39]觀察到小鼠血漿中心房利尿鈉肽的水平明顯高于正常小鼠,同時他們還發現附睪白色脂肪的UCP-1、PGC1α和PPARγ 蛋白表達顯著增加。為了驗證心房利尿鈉肽在慢性腎病小鼠模型中促進脂肪棕色化的特定作用,小鼠被給予神經肽抑制劑抑制心房利尿鈉肽的分解,提高血漿心房利尿鈉肽水平,結果發現實驗小鼠的UCP-1 和PGC1α 表達顯著升高,并且用含心房利尿鈉肽的尿毒癥血清刺激健康志愿者的原代脂肪細胞后也發現細胞中UCP-1 和PGC1α 蛋白含量增加。這些結果表明,在慢性腎病惡病質中心房利尿鈉肽可促進白色脂肪棕色化,最終導致能量的浪費。
4.9 時鐘基因 晝夜節律系統以位于下丘腦內視交叉上核(suprachiasmatic nucleus,SCN)為結構基礎。SCN 內的神經元自主運作,并根據光的反應被重置,以協調位于身體組織和細胞中的外周時鐘的計時。晝夜節律由多個時鐘基因組成的正負轉錄和翻譯反饋回路控制(圖1)。時鐘基因主要由兩個DNA 結合轉錄因子CLOCK(circadian locomotor output cycles kaput)和 BMAL1(brain and muscle ARNT-like 1)組成[41],它們通過與啟動子上的E-box 位點結合,使核心時鐘基因和額外的時鐘控制基因如REVERBα等直接轉錄激活,形成一個自我調節的轉錄-翻譯反饋環來調節產熱基因的表達,將晝夜節律和能量代謝聯系起來[42]。研究者在Bmal1基因缺失的小鼠模型中發現,白色脂肪中UCP-1、C/EBPβ 和PPARγ 轉錄物的顯著升高,促進白色脂肪的棕色化和產熱;與同窩的野生型對照相比,Bmal1基因缺失導致米色及棕色脂肪的質量增加了30%,這說明Bmal1 表達會抑制棕色脂肪的形成及其產熱功能[43]。相反,REV-ERBα 在低溫條件下迅速降低,且與UCP-1的表達呈負相關,REV-ERBα缺失的正常體溫小鼠脂肪組織中的UCP-1 水平也相應升高[44]。在觀察MYC癌基因調節人骨肉瘤細胞誘導的惡病質模型中,Masri 等[42]發現 MYC 的異位表達擾亂了晝夜節律基因,使REV-ERBα 激活時鐘基因的負轉錄臂,并刺激AMPK 代謝傳感通路,最終導致蛋白質和脂肪的消耗增加。并且在人類淋巴瘤樣本中,也發現BMAL1 的表達與MYC 呈負相關。這說明了MYC癌蛋白會擾亂晝夜節律基因的表達,從而影響細胞的新陳代謝,加速惡病質進程。在結直腸腫瘤惡病質小鼠中,惡病質打亂時鐘基因表達的節律性,使惡病質小鼠脂質攝取和分解代謝的晝夜表達模式紊亂。在正常小鼠中,PPARδ、PGC1、UCP-1 等參與脂肪酸代謝、機體產熱的調節因子在上午10 點的表達達到最高值,而在惡病質小鼠中,這種晝夜表達周期的節律性被打亂,調節因子在一天中所有的時點都有更高的表達[9]。這說明惡病質時機體脂肪的異常消耗和棕色化可能與部分調節因子的晝夜表達規律被破壞有關。這些研究表明,惡病質腫瘤模型病程中時鐘基因的無節律表達會造成脂肪代謝調節因子晝夜節律性表達的紊亂和脂肪組織棕色化等異常代謝。
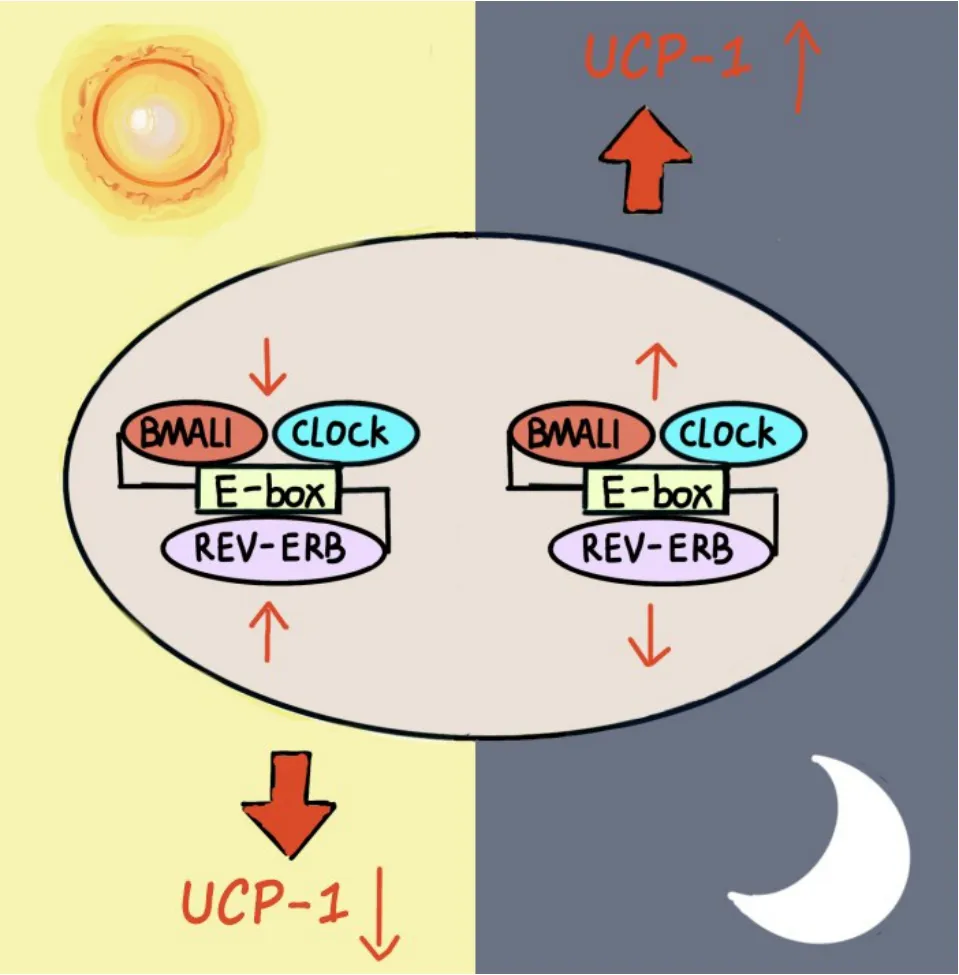
Figure 1. Diurnal heat production is controlled by positive and negative transcription and translation of multiple clock genes. BMAL1(brain and muscle ARNT-like 1)/REV-ERBα binds to E-box sequence to regulate circadian expression and maintain the dynamic balance of 24 h lipid metabolism. Rhythm factor BMAL1 promotes lipid synthesis,reduces the expression of thermogenic protein uncoupling protein-1(UCP-1),and inhibits the growth,development and thermogenesis of brown adipocytes. Its expression increases at night and decreases during the day,which is conducive to the synthesis and storage of lipids at night. On the contrary,REV-ERBα inhibits fat synthesis and storage,increases the expression of thermogenic protein UCP-1 and promotes heat production of brown adipocytes. Its expression increases during the day and decreases at night,which is conducive to the decomposition and utilization of lipids during the day.圖1 晝夜產熱由多個時鐘基因正負轉錄和翻譯控制
除了以上幾種惡病質時導致脂肪組織棕色化的主要機制(圖2)外,也有其他影響機制的報道。有研究發現前列腺素(prostaglandin,PG)合成限速酶——環加氧酶2(cyclooxygenase-2,COX2)在白色脂肪組織中通過COX-2/PG 途徑激活PPARγ 來誘導UCP-1 的過度表達,進而導致惡病質白色脂肪棕色化,增加全身能量消耗[45-46]。有報道證實酒精會增加腫瘤小鼠體內PRDM16 和UCP-1 蛋白的含量,導致白色脂肪組織的棕色化和棕色脂肪組織活性增強,加速脂肪流失[47]。脂肪組織中產熱程序負調節因子組蛋白脫乙酰酶3(histone deacetylase 3,HDAC3)的特異性消融會提高PPARγ和UCP-1增強子的乙酰化水平,從而導致惡病質狀態下白色脂肪組織的棕色化[48]。
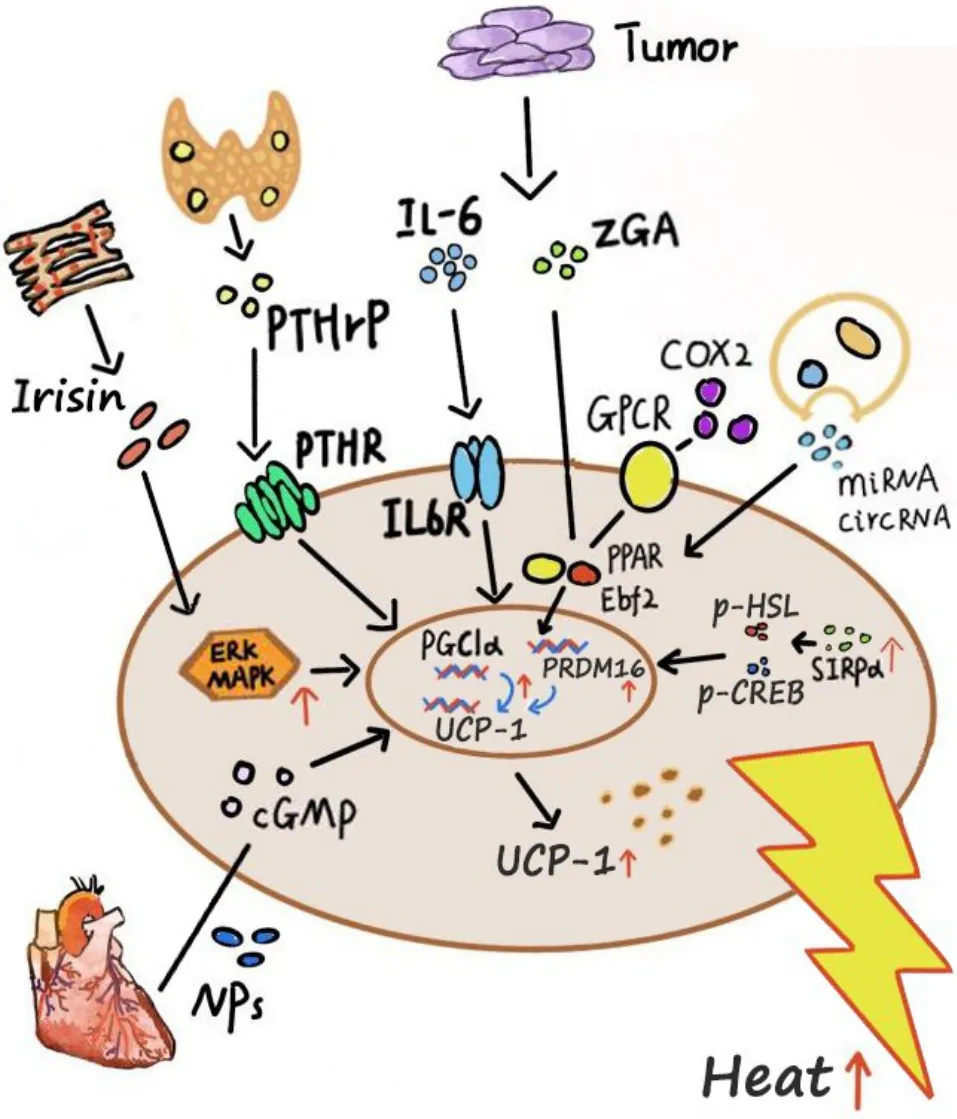
Figure 2. A variety of factors that induce browning of white adipose tissue during cachexia. Natriuretic peptides(NPs)activates peroxisome proliferator-activated receptor γ coactivator 1α(PGC1α)and uncoupling protein-1(UCP-1)expression,and increases mitochondrial uncoupling and total respiration. Irisin increases the expression of UCP-1 by activating extracellular signal-regulated kinase(ERK)and mitogen-activated protein kinase(MAPK)signaling pathways. Parathyroid hormone(PTH)and its related protein(PTHrP)regulate the expression of thermogenic factors such as UCP-1 by affecting PR domain-containing protein 16(PRDM16)and several transcription factors. Zinc-α2-glycoprotein(ZGA)induces PRDM16 to increase the expression of UCP-1 by promoting the recruitment of early B-cell factor 2(Ebf2)/peroxisome proliferatoractivated receptor γ(PPARγ) to the promoter of PRDM16. Exosomes reduce PPAR by delivering circular RNA(circRNA)and microRNA(miRNA)targeting PRDM16 pathway. Signal-regulatory protein α(SIRPα)promotes the phosphorylation of hormonesensitive lipase(HSL)and cAMP-response element binding protein(CREB)to increase the expression of UCP-1. The increase in interleukin-6(IL-6)level upregulates the expression of UCP-1 in white adipose tissue. Cyclooxygenase-2 (COX2) activates PPAR through 7 transmembrane G protein-coupled receptors(GPCRs)through COX-2/prostaglandin pathway to induce the overexpression of UCP-1.圖2 惡病質時誘導白色脂肪組織棕色化的各種因素
5 結語
由上述分析可知,惡病質時脂肪組織異常代謝與白色脂肪棕色化密切相關,脂肪組織棕色化會促進脂肪分解,增加血清膽固醇水平,導致脂肪異位沉積,并會誘發異常的炎癥反應和機體高消耗的虛弱狀態。惡病質時機體異常表達的激素、炎癥因子、信號分子和時鐘基因等是引起白色脂肪棕色化的重要分子機制。據此,臨床治療上我們可以通過對參與白色脂肪組織棕色化的潛在機制和關鍵調節因素的干預來緩解甚至阻斷惡病質的進程。

