海昆腎喜膠囊通過激活自噬改善SAMP8小鼠認知功能障礙
張 松,王振國,陳宇航,蘭江純,何 珊,,張秀云
(山東中醫藥大學1.藥學院;2.中醫藥經典理論教育部重點實驗室,山東 濟南 250355)
阿爾茨海默病(Alzheimer’s disease,AD)是老年性癡呆中發病率最高的一種神經系統性疾病,臨床上以記憶衰退、學習及認知障礙為特征,主要的臨床病理學標志為腦內β-淀粉樣蛋白(amyloid β-protein, Aβ)異常積聚以及細胞內Tau蛋白過度磷酸化[1]。研究顯示,AD發病機制復雜,多與腦內異常蛋白質積聚有關,特別是Aβ的過度產生及清除不足是關鍵誘因,促進其清除或是防治此癥的重要策略[2]。而自噬作為細胞內錯誤折疊蛋白質清除的關鍵途徑,在神經系統疾病發病中作用顯著[3]。
AD屬中醫“呆病”、“健忘”、“善忘”等范疇,近代中醫多傾向從“腎虛”論治。隨著研究深入,發現“毒損腦絡”、“濁毒損腦”也是AD的重要病機[4]。而過度沉積的Aβ和過度磷酸化的Tau蛋白,是機體腎精虧虛、臟腑功能紊亂產生的痰濁瘀血,直接損傷腦髓,屬“內生濁毒”范疇[4-5]。而自噬可降解過量沉積的蛋白,清除痰濁瘀血[5],對于神經細胞內Aβ等的清除及減輕其毒性發揮重要作用[3]。所以,自噬通路為化濁/祛瘀中藥防治AD的研究提供了新的思路。
海昆腎喜(HKSX)膠囊主要成分為中藥昆布中提取的褐藻糖膠,是由α-L-巖藻糖-4-硫酸酯形成的水溶性雜多糖,有化濁、排毒之效。臨床上用于慢性腎功能衰竭濕濁證[6]。此外,研究發現HKSX可以改善AD模型小鼠空間學習記憶障礙,提高腦內乙酰膽堿含量[7],但具體機制尚不清楚。
HKSX化濁排毒,其對AD的干預作用是否與自噬相關?因此,本實驗采用近交系快速老化P8(senescence-accelerated mouse prone 8,SAMP8)小鼠模擬人類衰老導致的學習記憶障礙,探討HKSX是否通過調節自噬實現其對AD的干預作用,為其防治AD的臨床應用提供科學依據,并為其他化濁/化瘀類中藥防治AD的作用機制研究提供思路。
1 材料
1.1 實驗動物16周齡雄性SAMP8小鼠48只,同周齡雄性抗快速老化小鼠1(senescence-accelerated mouse/resistance 1,SAMR1)小鼠16只,均為SPF級,購自北京維通利華實驗動物技術有限公司,飼養于山東中醫藥大學實驗動物中心屏障設施,實驗動物許可證號:SCXK(京)2016-0010。
1.2 實驗主要試劑HKSX膠囊(吉林省輝南長龍生化藥業股份有限公司, 015200507),Aβ1-40ELISA試劑盒(酶聯生物,m1001859),Aβ1-42ELISA試劑盒(酶聯生物,m1002201),Radio Immunoprecipitation Assay(RIPA)裂解液(碧云天生物,P0013B),BCA蛋白定量/濃度測定試劑盒(500 T)(美侖生物,MA0082-1),PAGE凝膠超快速制備試劑盒10%(美侖生物,MA0382),10X蛋白電泳緩沖液(美侖生物,PK10002),PVDF膜(0.22 μm)(Merck Millipore,ISEQ00010),10X電泳轉移緩沖液(索萊寶,D1060),TBST緩沖液(美侖生物,T1081),兔抗Beclin-1(Cell Signaling TECHNOLOGY,3495)、兔抗LC3B(Cell Signaling TECHNOLOGY,2775)、兔抗SQSTM1/p62(Cell Signaling TECHNOLOGY,5114)、兔抗Syn(Cell Signaling TECHNOLOGY,4329)、兔抗PSD95(Cell Signaling TECHNOLOGY,2507)、兔抗β-Actin(Cell Signaling TECHNOLOGY,4967),兔抗GAPDH(proteintech,10494-1-AP),Western一抗稀釋液(碧云天生物,P0023A),山羊抗兔IgG/辣根酶標記(中杉金橋,ZB-2301),靈敏ECL化學發光試劑盒(proteintech,PK10002),甲醇(天津富宇,JC-01)
1.3 實驗主要儀器醫用離心機(湖南平凡科技有限公司,TGL-16A),XR-SuperMaze動物行為分析系統、Morris水迷宮實驗系統、物體識別實驗系統(包括相同、不同物體)均為上海欣軟信息科技有限公司,新物體識別箱-小鼠(深圳市瑞沃德生命科技有限公司,63040),酶標儀(賽默飛,MultiskanSky),微孔板恒溫振蕩器(杭州佑寧儀器有限公司,WZ80-2),凝膠圖像分析系統(上海天能科技有限公司,Tanon 4800Multi)。
2 方法
2.1 動物分組及給藥將16 周齡SAMP8小鼠[8]隨機分成模型組(P8組)、HKSX低劑量組(L-HKSX組)、HKSX高劑量組(H-HKSX組)3組,同周齡SAMR1小鼠作為正常對照組(R1組),每組16只。其中,HKSX低、高劑量組分別給予100、200 mg·kg-1·d-1(以其有效成分FPS的量計算,以人與小鼠的等效劑量比折算得到低劑量給藥量,上調一倍得到高劑量給藥劑量,給藥時都以超純水為溶媒),R1組和P8組代之以同等體積的超純水灌胃,每日1次,連續給藥60 d(HKSX說明書中的一個療程),之后進行行為學檢測。
2.2 行為學檢測
2.2.1新物體識別(New Object Recognition,NOR)實驗 首先進行NOR實驗,實驗歷時3 d。d 1:將小鼠放入40 cm×40 cm的曠場中自由探索5 min;d 2:使小鼠熟悉大小、顏色、形狀相同的兩物體5 min;d 3:換入一大小、顏色、形狀均不同的物體,再讓小鼠熟悉5 min,并記錄小鼠對兩物體的探索時間[9]。實驗全程由視頻分析系統跟蹤分析。每次實驗結束后,用75%乙醇溶液擦拭測試箱和物體,防止氣味干擾。結果用新物體識別指數(discriminition index),即小鼠探究新物體所用時間占其探究兩物體所用時間和的比例表示。
2.2.2Morris水迷宮(Morris Water Maze,MWM)實驗 NOR實驗結束d 2進行MWM實驗。Morris水迷宮主要由圓形水池(直徑90 cm,高50 cm)、水下平臺(直徑9 cm,高35 cm)以及圖像采集分析系統SuperMaze組成,平臺放置于第四象限。測試時,水深36 cm,水溫為(22±2)℃,SuperMaze系統全程跟蹤記錄。實驗前1 d,讓小鼠自由游泳120 s,以便適應游泳環境。實驗中為減少對動物行為的影響,盡量保持水溫及外界環境穩定,SuperMaze系統全程跟蹤記錄。實驗方法參考以往實驗[10]。
(1)定位航行(acquisition trail)實驗 實驗共計6 d。每天以四個不同象限作入水點,將小鼠頭部面向池壁放入水中,小鼠找到隱藏平臺需要的時間記錄為逃避潛伏期(escape latency,EL)。如果在60 s內沒有找到平臺,則將小鼠引至平臺停15 s,以形成記憶,同時記錄逃避潛伏期為60 s。
(2)空間探索(probe trial)實驗 d 7撤去平臺,將小鼠從目標象限的對側象限(第二象限)以相同方法放入,記錄60 s內小鼠的游泳軌跡,分析其在目標象限的游泳時間和穿越平臺的次數。
2.3 標本采集行為學實驗結束后,小鼠斷頭,將海馬組織剝離出,稍吸干后稱重,置于-80 ℃冰箱保存,待測各項指標。
2.4 ELISA法測海馬組織中Aβ1-40和Aβ1-42的表達取2.3項下各組組織,按說明書操作提取總蛋白,BCA法定量蛋白濃度并調至同一濃度水平;按說明書操作設置標準孔、樣品孔和空白孔,分別加入相應試劑;封板膜封板,37 ℃溫育60 min;再經洗滌、加顯色液、避光孵育、加終止液等步驟,最后在450 nm波長下檢測各孔吸光度,根據標準曲線,算出組織中Aβ1-40和Aβ1-42的表達[11]。
2.5 Western blot檢測方法參考以往實驗[12],取2.3項下各組組織,按說明書操作提取總蛋白,BCA法定量各組蛋白濃度并調至同一水平;SDS-PAGE電泳分離,每孔上樣10 μL;轉膜;5%脫脂奶粉封閉2 h;一抗(p62,1 ∶1 500;LC3B,1 ∶1 500;Beclin-1,1 ∶1 500;PSD95,1 ∶1 500;Syn,1 ∶1 500;β-actin,1 ∶2 500;GAPDH,1 ∶6 750)4 ℃過夜孵育;二抗室溫孵育1 h;ECL化學發光成像,Image J軟件分析蛋白表達量。
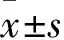
3 結果
3.1 HKSX膠囊改善SAMP8小鼠學習、記憶能力
3.1.1NOR實驗 NOR測試是一種敏感的認知能力測定,如果實驗動物在d 2 已經對兩個相同物體形成記憶,那么在d 3的識別階段,它們將花費更多時間來探索新物體[9]。如Fig 1所示,NOR實驗中,與R1小鼠相比,P8組小鼠明顯降低對新物體的辨別力(P<0.01);給藥后,低、高劑量組小鼠對新物體的識別指數均有所增加(P<0.05,P<0.01),由此可見,HKSX能提高AD小鼠對新物體的分辨能力和識別率,改善其學習、記憶障礙。
3.1.2HKSX膠囊改善小鼠定位航行和空間探索能力 如Fig 2A、B所示,在定位航行實驗中,AD模型組小鼠尋找逃避平臺的時間最長,且隨訓練天數的延長無明顯改善,說明SAMP8小鼠的學習記憶能力較差;而正常組小鼠訓練過程中逃避潛伏期明顯縮短,提示其學習適應能力較強。給藥組小鼠尋找平臺所需的逃避潛伏期明顯降低,說明HKSX可以明顯改善SAMP8小鼠的學習能力,且以高劑量組效果更佳。
分析圖2C-E,與R1組相較,P8組小鼠在目標象限的停留時間和穿越平臺的次數明顯偏少(P<0.01),說明AD小鼠的確存在記憶障礙;而與模型組相比,HKSX高、低劑量都能改善這一現象,即HKSX很大程度上提高SAMP8小鼠的學習、記憶及記憶再提取的能力,且高劑量組的改善效果更好(P<0.01)。
3.2 HKSX膠囊降低SAMP8小鼠海馬組織中Aβ1-40和Aβ1-42水平ELISA實驗顯示(Fig 3),與R1組相比,P8組小鼠腦內Aβ1-40和Aβ1-42水平均有大幅度增多(P<0.01),而L-HKSX組和H-HKSX

Fig 1 Effect of HKSX on memory ability of SAMP8 mice in NOR Test n=16)

Fig 2 HKSX improved learning and memory function of SAMP8 mice in MWM test n=16)

Fig 3 Effect of HKSX on level of Aβ1-40 and Aβ1-42 in SAMP8 mice n=8)
組小鼠腦內Aβ1-40和Aβ1-42水平較于P8組均明顯降低(P<0.01,P<0.05),尤其H-HKSX的清除效果更明顯。說明HKSX可清除Aβ在腦組織中的過度沉積,降低其帶來的神經毒性損傷,進而對AD起到防治效果。
3.3 HKSX膠囊調節自噬相關蛋白表達,激活自噬如Fig 4所示,與R1組相比,P8組小鼠海馬組織p62蛋白表達明顯偏多(P<0.01),而LC3-Ⅱ和Beclin-1蛋白表達量明顯減少(P<0.01)。這一相對

Fig 4 Effect of HKSX on expression of autophagy-related proteins in SAMP8 mice n=8)
表達趨勢說明模型組小鼠自噬功能受到損害。HKSX給藥后,LC3-Ⅱ和Beclin-1的表達明顯提升,同時下調p62水平,提示HKSX低、高劑量可不同程度激活自噬,改善自噬功能障礙,增強異常蛋白的清除,其以高劑量效果更明顯(P<0.01)。
3.4 HKSX膠囊提高突觸可塑性WB結果顯示(Fig 5),相較于R1組,P8組小鼠腦內Syn、PSD95水平明顯降低(P<0.01),表明P8組小鼠的突觸傳導受到阻滯,印證了AD確實可導致小鼠學習記憶能力障礙;與P8組相比,低、高劑量HKSX均能上調Syn、PSD95在海馬組織中的表達(P<0.05,P<0.01),增加神經突觸可塑性,增強突觸傳導,最終達到干預AD的目的。

Fig 5 Effect of HKSX on expression of synaptic plasticity-related proteins in SAMP8 mice n=8)
4 討論
自噬是真核細胞中發生的一種自我降解的過程,可以吞噬損傷的細胞器、錯誤折疊的蛋白等廢物,供給細胞重新利用或排出體外,從而維持細胞結構和功能、延緩衰老[5]。研究表明,隨著機體衰老,自噬水平明顯下降[13]。而上調自噬功能,Aβ蛋白的異常聚集及其導致的神經元死亡都能夠表現出減緩的現象[14-15]。因此,激活自噬的發生為AD治療提供了新的視角。
細胞自噬受多條信號通路調節,其中Beclin-1、LC3和p62是參與自噬的重要蛋白[3,14]。Beclin-1參與自噬起始階段,可形成Beclin1-Vps34-Vps15復合結構而啟動自噬、促進吞噬泡成核并召募蛋白形成自噬前體[14]。LC3能被Atg4激活成LC3-Ⅰ,并與磷脂酰乙醇胺連接成復合物,參與調控自噬體擴散和延展過程[3]。p62與泛素化蛋白和LC3-Ⅱ結合成復合體,啟動自噬體形成,而自身則會連接異常致病蛋白一同被自噬溶酶體降解[16]。研究表明,自噬相關蛋白Beclin-1在AD患者腦中減少,p62含量增加,LC3-Ⅱ水平與AD樣本的Aβ斑塊密切相關,載滿未消化Aβ等底物的自噬結構則驗證了AD小鼠確實存在自噬受損的情況[14]。
HKSX的成分為中藥昆布中提取的褐藻糖膠,為昆布的主要活性成分。《本草綱目》記載,昆布性寒,咸,歸經于肝,胃,腎經,有消毒解痰,軟堅散結,利尿活水、化瘀消腫等重要功效,用于治療癭瘤,瘰疬,睪丸腫痛,痰飲水腫等病癥。所以,從中醫中藥學分析,HKSX善利水化痰,適用于癥瘕痰瘀膠結之證。如前所述,自噬功能障礙可能是AD“濁毒損腦”發病的微觀機制,細胞自噬則是消除內生痰濁瘀血的重要機制[5],而HKSX可以化濁排毒,所以推測HKSX可以通過激活自噬,改善AD認知障礙。
藥效學實驗表明,HKSX可提高SAMP8小鼠對新穎物體的識別指數,且明顯縮短水迷宮實驗中小鼠的逃避潛伏期,增加其在目標象限停留時間和穿越平臺的次數,ELISA結果顯示腦內Aβ水平減少。這表明,HKSX可以化濁排毒,促進Aβ的降解,從而改善記憶,那么其作用機制是否與自噬有關?Wenstern btot研究結果表明,自噬相關基因Beclin-1、LC3-Ⅱ在SAMP8小鼠中表達下降,而p62表達水平上升,說明AD小鼠的自噬功能的確是損傷的;而HKSX治療能調節上調Beclin-1、LC3-Ⅱ表達,下調p62水平,以激活自噬。
此外,Syn和PSD95主要調節神經元突觸的形成和突觸可塑性改變,研究表明Syn和PSD95含量下降現象存在于AD模型小鼠的大腦海馬組織中[17]。我們同樣發現SAMP8小鼠海馬組織中Syn和PSD95蛋白表達下調,表明在SAMP8小鼠中神經元突觸形成及功能障礙。而HKSX給藥后,蛋白Syn和PSD95表達量增多,表明HKSX可以促進突觸結構的重建,改善突觸傳導和神經信息的傳遞。
總之,本文結果表明HKSX膠囊可以上調自噬相關蛋白Beclin-1、LC3-Ⅱ,同時下調p62含量,改善自噬功能障礙,進而減少腦內Aβ的異常集聚,減輕神經毒性作用;并且提高了PSD95和Syn蛋白的表達量,提高神經元的突觸可塑性,進而改善SAMP8小鼠的學習和記憶障礙。關于HKSX膠囊如何調節自噬,目前的研究表明,多糖在腸道菌群的發酵下代謝產生短鏈脂肪酸(short chain fatty acids, SCFAs),而SCFAs在“腸-腦軸”相互作用中具有關鍵作用[18],腸道內游離的SCFAs可以通過單羧酸轉運蛋白穿過血腦屏障;此外,SCFAs還可以通過G蛋白偶聯受體結合,進一步調節腺苷酸激活蛋白激酶(AMP-activated protein kinas, AMPK)、核因子等信號通路,從而直接或間接影響腦功能[18]。而其中AMPK信號通路與自噬密切相關[14],這些結果為我們下一步詳細的機制研究提供了啟示和思路。

