冠狀動脈功能學評價指標在經皮冠狀動脈介入術中的應用進展
胡強,張權宇
1空軍軍醫大學附屬西京醫院心內科,西安 710032;2北部戰區總醫院心內科,沈陽 110016
冠狀動脈粥樣硬化性心臟病(coronary atherosclerotic heart disease,CHD)是一種嚴重威脅人類健康的心血管系統疾病。2019年全球疾病負擔(global burden of disease,GBD)報告指出,缺血性心臟病是全球傷殘調整壽命年(disability adjusted life year,DALY)增加的主要原因之一[1]。經皮冠狀動脈介入術(percutaneous coronary intervention,PCI)是治療CHD的有效方法,能夠迅速恢復心肌血流灌注、減少心肌梗死面積,提高患者生存率及生存質量。對于梗死相關血管,一般依據冠脈造影結果行血運重建[PCI或者冠狀動脈旁路移植術(coronary artery bypass grafting,CABG)],而對于非梗死相關血管是否需要血運重建目前尚存在爭議[2],大多數患者行藥物治療,少部分依據冠脈造影結果行PCI治療。由于患者的疾病預后與非梗死相關血管及臨界病變的進展相關[3],因此,合理的血運重建至關重要,而單純依據冠脈造影結果進行指導具有一定的局限性。血流儲備分數(fractional flow reserve,FFR)等冠狀動脈功能學評價指標可為病變血管尤其是臨界病變血管的血運重建提供一定依據[4-5]。因此,本文主要針對FFR、瞬時無波形比值(instantaneous wave-free reserve,iFR)、定量血流分數(quantitative flow ratio,QFR)及其他冠狀動脈功能學評價指標在血運重建及預后評估中的價值進行綜述。
1 概 述
冠狀動脈功能學評價指標是指用于判斷冠脈病變是否導致心肌缺血,從而指導冠心病患者血運重建的功能性指標。這些指標不僅能夠反映病變血管的形態學異常,還可用于評估病變血管功能改變的程度[3]。《冠狀動脈血流儲備分數臨床應用專家共識》[4]及《中國經皮冠狀動脈介入治療指南(2016)》[6]均指出,FFR能夠特異性反映冠脈狹窄的功能學嚴重程度,可用于評估臨界病變、非罪犯血管及不明確的罪犯血管,此外,iFR等功能學指標目前仍在不斷地進步發展。在指導血運重建方面,功能學指標與形態學指標有著相似甚至更好的結果,如一項Meta分析結果表明,FFR指導血運重建組的主要心血管不良事件(major adverse cardiovascular event,MACE)發生率明顯低于冠脈造影(OR=1.71,95%CI 1.31~2.23)[7]。此外,與形態學指標相比,功能學指標指導下的血運重建的比例不高[8-11],相關研究表明,這兩種指標在指導中等病變程度血管的血運重建中存在約40%的不一致,主要與冠脈造影指導下的血運重建率更高有關[12]。總之,與冠脈造影相比,功能學指標能在達到相同預后結果的基礎上降低血運重建率。
2 冠狀動脈功能學評價指標的分類及優缺點
除FFR外,常見的功能學評價指標還包括iFR、冠狀動脈血流儲備(coronary flow reserve,CFR)、QFR等。FFR是指病變血管最大血流量與理論上該血管無病變情況下的最大血流量之比,可簡化為在心肌最大充血狀態下,狹窄遠端冠狀動脈內平均動脈壓(Pd)與冠狀動脈口部主動脈內的平均動脈壓(Pa)之比[9]。CFR是指充血期和靜息條件下冠狀動脈血流速度之比或平均過渡時間之比[3,13]。iFR為FFR的改良版,是指靜息條件下的舒張期Pd與Pa之比[14-17]。QFR為基于影像重建的FFR,是通過冠脈造影行3D重建計算的FFR值[18-20]。此外,還有其他類型的功能學評價指標,包括微循環阻力指數(index of microvascular resistance,IMR)、充血性微血管阻力指數(hyperemic microvascular resistance,HMR)[3]、基于光學相干斷層掃描(OCT)測量的FFR值(optical coherence tomography derived-fractional flow ratio,OFR)[21]等。上述指標均有各自的優缺點,臨床上應基于實際情況選擇恰當的指標來指導血運重建,具體見表1。
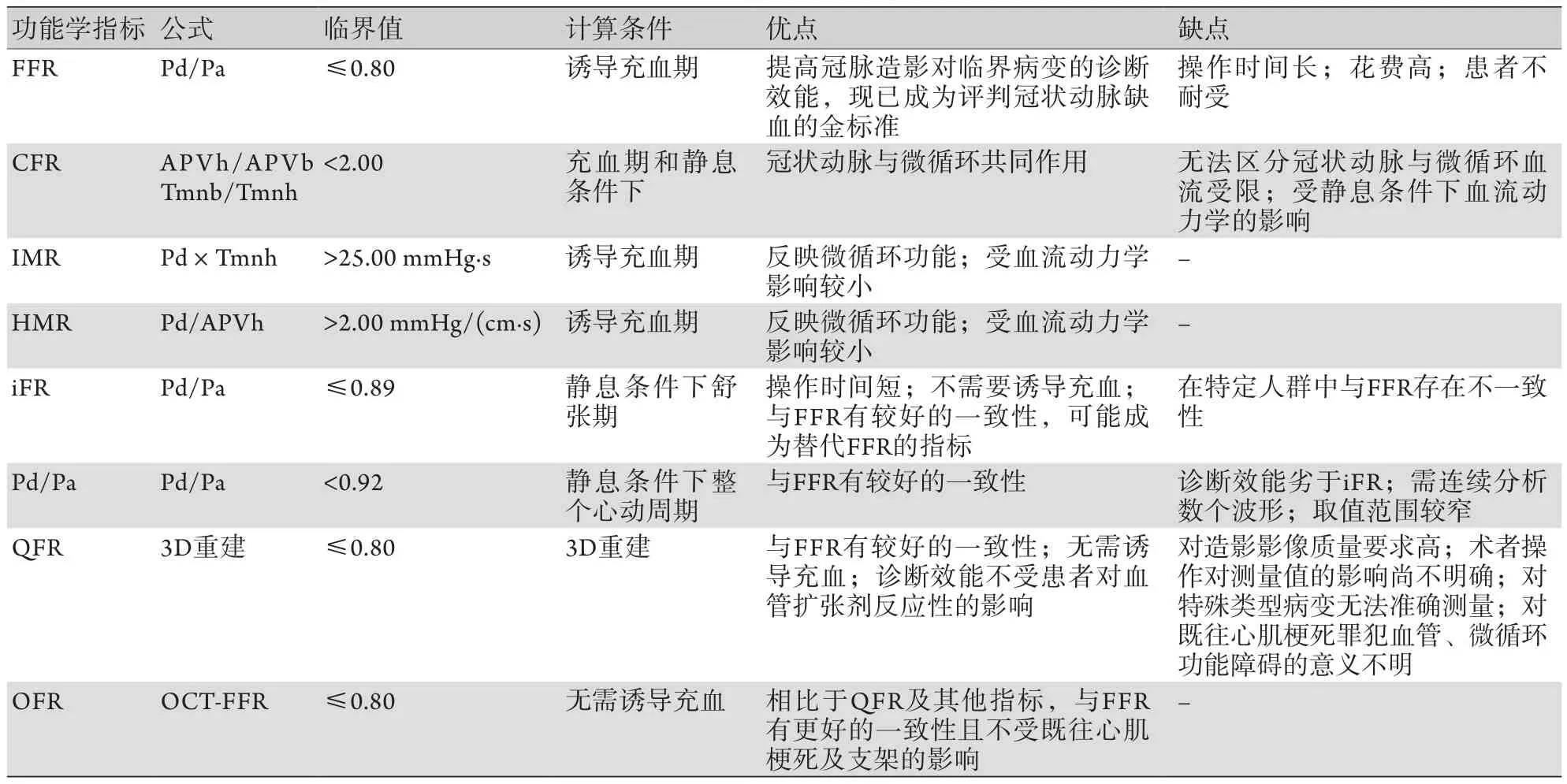
表1 各種冠狀動脈功能學評價指標特點闡述Tab.1 Characteristics of various coronary artery functional evaluation indices
3 各類冠狀動脈功能學評價指標的臨床應用價值
冠狀動脈功能學評價指標可指導冠心病患者的血運重建,尤其對臨界病變具有重要意義,能減少不必要的血運重建,提高其效率。目前,已有各具特色的多種功能學評價指標用于指導血運重建。
3.1 FFR的臨床應用價值 歐洲心臟病學會(ESC)及歐洲心胸外科協會(EACTS)2019年聯合發表的血運重建指南推薦FFR指導中等病變血運重建(Ⅰa),并推薦FFR指導多支血管病變血運重建(Ⅱa B)[22]。FFR診斷及預測預后的能力與冠脈造影無明顯差異,甚至優于冠脈造影。DEFER研究發現,在冠脈造影結果相似的情況下,FFR<0.75的病變即使血運重建后,其預后也劣于FFR≥0.75的病變[23]。FAME研究發現,FFR指導的血運重建組1年死亡、非致死性心肌梗死及再次血運重建的復合終點發生率均低于冠脈造影組(13.2%vs.18.3%,P=0.02),2年的死亡及心肌梗死發生率低于冠脈造影組(8.4%vs.12.9%,P=0.02),但二者5年的終點結局事件發生率卻無明顯差異(28.0%vs.31.0%,P=0.31)[24-26]。FAMOUS-NSTEMI研究[27]及COMPARE ACUTE研究[28]分別顯示FFR在非ST段抬高型急性冠脈綜合征(non-ST segment elevation acute coronary syndrome,NSTE-ACS)患者及ST段抬高型急性心肌梗死(ST segment elevation myocardial infarction,STEMI)患者中具有與冠脈造影相似的作用。同時,FFR在合并如重度貧血、敗血癥、心動過速、呼吸衰竭等疾病的患者中有一定的診斷價值,此類患者在冠脈造影或其他輔助條件下未檢測到血栓形成、斑塊破裂或其他形態學改變,卻可能存在FFR陽性且與缺血相關的病變血管[29]。但FFR可能由于微循環功能障礙、冠狀動脈鈣化等原因引起充血期血流減少而增高,造成假陰性[30],因此STEMI患者急性期(發病<6 d)FFR值可能會偏高,進而低估其病變程度[31]。
3.2 iFR的臨床應用價值
3.2.1 iFR與FFR的相關性及診斷一致性 iFR為FFR的改良版,與FFR存在一定的線性關系(R2=0.66)[17],兩者的區別主要是iFR的測量無需誘導充血[14-17]。iFR與FFR具有相似的診斷價值,且在二者指導下行血運重建后冠心病患者的MACE事件發生率接近,但iFR操作時間較短[32-34]。基于iFR與基于FFR行延期PCI的急性冠脈綜合征(4.12%vs.4.05%,P=0.60)[16,35]及前降支病變患者(2.44%vs.5.26%,P=0.04)[36]的臨床結果相似。iFR同樣可用于指導有心肌梗死既往史的患者,iFR與FFR在指導治療有無心肌梗死既往史的患者中均具有較好的一致性(r=0.81和r=0.72,P<0.001),在聯合使用iFR和FFR的策略下,二者的1年生存率接近(HR=0.87,95%CI 0.10~7.76,P=0.90)[15]。對于冠心病合并糖尿病患者,iFR組中非致死性心肌梗死發病率較高,但與FFR組比較差異無統計學意義(10.0%vs.7.2%,P=0.30)[37]。總之,iFR具有與FFR相似的診斷和預測預后能力,且存在操作時間短、患者依存性好、支架置入較少及無需誘導充血等優勢,有望取代FFR用于指導血運重建[16]。
3.2.2 iFR與FFR診斷的不一致性 在評價冠脈病變程度尤其是中等程度的病變時,約20%的病例FFR與iFR的結果一致[38-39],可能與充血期血流速度[40]、基線血流量[39,41]及血管舒張功能[42]有關。高充血期血流速度可導致跨壓差增大,進而使FFR減小,產生FFR(+)/iFR(-)的結果;基線血流量較少可使iFR增大,進而導致FFR(+)/iFR(-);而微循環功能減退引起的血管舒張功能降低,可最終導致FFR(-)/iFR(+)[40]。導致FFR(+)/iFR(-)的因素包括年齡小、血栓位置(主要包括左主干和左前降支開口處病變)、病變程度重及心率慢,而導致FFR(-)/iFR(+)的因素包括年齡大、病變程度輕及不使用β受體阻滯劑[39]。此外,還有研究報道,性別、非透析狀態、糖尿病、血栓形態可能均與FFR和iFR兩個指標的診斷不一致相關[38-39,41]。在性別方面,男性易產生FFR(+)/iFR(-)的結果,而女性易產生FFR(-)/iFR(+)的結果,這可能與男性微循環功能較好、管腔面積較大、心臟舒張功能較差、心肌數量多或斑塊性質等因素導致其在充血期血流較多,從而使FFR值變小有關,也可能與女性對充血反應較遲鈍從而產生較大的FFR值[43-44]或靜息狀態下女性的血流較多從而產生較小的iFR值有關[41]。非透析狀態是FFR(+)/iFR(-)的獨立影響因素,這與非透析患者基線血流量較少,進而導致iFR值較高有關[41]。還有研究發現,FFR(-)/iFR(+)的患者具有較高的糖尿病發生率,可能與糖尿病引起微循環功能障礙從而出現FFR(-)/iFR(+)有關[40]。此外,血栓自身形態對FFR與iFR的不一致性具有一定影響,以聚集為主的血栓容易導致FFR(+)/iFR(-),而以彌散為主的血栓容易導致FFR(-)/iFR(+)[38]。盡管兩項指標存在不一致的情況,但在預后方面,兩者不一致且行延期PCI的患者5年后復合終點(patientoriented composite outcome,POCO)發生率卻無統計學差異[42],因此,兩者的不一致性對預后的影響不大,但需要依據不同的條件,選用合適的功能學指標來評價,以獲得良好的效果。
3.3 QFR的臨床應用價值 QFR是一項新型的功能學評價指標,是基于三維定量冠狀動脈造影(three-dimensional quantitative coronary angiography,3D-QCA)計算FFR值的方法[18,45]。Smit等[46]發現,造影劑激發血流(contrast-flow QFR,cQFR)是負荷核素心肌灌注顯像(SPECT-MPI)的獨立影響因素,能較好地評估心肌缺血狀態。FAVOR Ⅱ CHINA研究結果顯示,以FFR為參考標準,QFR在患者水平與血管水平的術中評估診斷準確性分別為92.4%和92.7%,在血管水平的術后評估診斷性為93.3%,均明顯高于定量冠狀動脈造影(QCA)術中評估及術后分析的診斷準確性(分別為59.6%和64.0%)[47]。Hwang等[45]發現,在急性心肌梗死及穩定的缺血性心臟病中,QFR與FFR(r=0.863)或iFR(r=0.74)均有較好的相關性,且與FFR在評估非罪犯血管的病變程度上一致性較好[48]。此外,QFR還具有計算時間短[49]、無需使用導絲和血管擴張劑等優勢[47]。因此,臨床上QFR可用于對血管擴張藥過敏以及無法進行FFR測量的患者,效果優于冠脈造影及FFR等金標準,并可用于線上指導血運重建。但在臨界病變中,QFR與FFR同樣存在約21.4%的不一致,且FFR(-)/QFR(+)往往與微循環功能差及血栓病變較重進而導致血流速度減慢有關[50]。PCI術后QFR對預后評估和預測有一定的幫助。Biscaglia等[20]發現,PCI術后QFR值是血管水平的復合終點事件(vessel oriented composite endpoint,VOCE)的獨立影響因素,QFR≤0.89的血管較QFR>0.89的血管VOCE發生率高(25%vs.3.5%,P<0.001),提示QFR對支架置入后的預后預測能力較強。
4 冠狀動脈功能學評價指標的應用進展
4.1 FFR測量方法學的改進 FFR的測量具有裝置特殊、輻射較大及信號偏移等缺點,且由于需要使用血管擴張劑,FFR不能用于合并哮喘及重度房室傳導阻滯的患者[29,51]。針對上述缺點,由FFR衍生出多種功能學評價指標,主要分為FFR的改良版及影像重建FFR,前者主要包括iFR、Pd/Pa、對比劑FFR(angiography-derived fractional flow reserve,FFRangio),而后者主要包括QFR、OFR、冠狀動脈CT血管成像FFR(computed tomography-fractional flow reserve,CT-FFR)。
4.1.1 FFRangio FFRangio是一種使用對比劑測量FFR值的無創性功能學評價指標,臨界值以常規FFR為標準。相比于其他非充血期測量指標,FFRangio與常規FFR具有更高的一致性[52],且較常規FFR有更高的診斷價值,但臨床預后結果差異仍有待進一步驗證[51,53]。
4.1.2 OFR OFR是基于OCT計算FFR值的方法,該方法可進行形態學及生理功能學評估[54],且在罪犯血管、PCI術后血管、不同病變程度血管中進行測量時,與FFR均有較好的一致性,與QFR及傳統形態學指標相比有一定優勢,可更好地評估病變血管功能,進而提高PCI的使用效率[21,54-57]。
4.1.3 CT-FFR CT-FFR是一項基于CT計算FFR值的方法,與常規FFR測量有較好的一致性[58]。在短期隨訪中,該指標與常規指標在終點事件發生率上相似,同時還具有診斷價值較好、花費少、生存質量較高等優點,但該值受CT分辨率的影響[51],此外還缺乏長期隨訪的證據[59]。
4.1.4 FFR測量方法的改進 微導管FFR值測量技術(microcatheter derived FFR,mc-FFR)具有導絲位置穩定,可在較少的信號漂移下重復測量等優勢。但mc-FFR與常規FFR比較有一定的差異,主要與OCT測量下的最小管腔面積(r=-0.3359)、病變長度(r=0.07)及mc-FFR值(r=-0.603)相關[60]。
4.2 聯合指導血運重建 由于iFR與FFR存在不一致性,以FFR≤0.80為參考標準,iFR的診斷準確性為84%,但iFR與FFR聯合指導血運重建則可使診斷準確性達到90%,且約64.9%的病變血管可避免使用腺苷誘導充血[17]。因此,為降低操作難度及減少不良反應,可聯合應用FFR與iFR指導血運重建,即當iFR值在0.86~0.93時計算FFR值,當iFR<0.86時進行血運重建,而當iFR>0.93時則延期進行血運重建。該指導方式與FFR的不一致率約為9.4%,低于單獨使用iFR與FFR的不一致率[61]。因此,聯合指導血運重建可在提高準確性的同時,減少FFR測量的不良反應。
4.3 預后評分系統 基于QFR測量的評分系統有兩種,一種是計算3支血管的QFR之和(threevessel contrast-flow quantitative flow ratio,3vQFR)來預測患者的預后,3vQFR值是MACE的獨立影響因素(HR=0.971)[18,62];另一種是基于QFR的功能性SYNTAX評分(functional SYNTAX score derived from QFR,fSSQFR),即計算QFR≤0.8的病變血管SYNTAX評分,當fSSQFR>0時心血管事件發生率較高,且其預測預后的能力也高于傳統SYNTAX評分(classic anatomic SYNTAX score,cSS)[18,63]。此外,在血運重建后,采用基于QFR的SYNTAX評分(quantitative flow ratio guided residual functional SYNTAX score,Q-rFSS)進行分組,不完全血運重建組MACE事件發生率較完全血運重建組高(22.0%vs.7.4%,HR=3.21,P≤0.001),且缺血驅動的血運重建發生率也高(19.3%vs.4.4%,HR=4.74,P<0.001),提示采用Q-rFSS進行危險等級評估較殘余SYNTAX評分(residual SYNTAX score,rSS)評價效果好,QFR可作為提高SYNTAX評分預后預測能力的補充指標[64]。
5 總結與展望
FFR、iFR和QFR作為評價病變程度的功能學指標,不僅可指導血運重建,還可用于評估PCI術后患者的預后[20,37]。冠狀動脈的病變程度尤其是臨界病變不能單純依靠冠脈造影結果來評判,還需借助冠脈腔內影像及功能學指標進行綜合判斷,從而最終確定是否需要進行血運重建。此外,針對單支多處血栓病變,采用常規的針對單個血栓的評價方式達不到評價血栓病變程度的效果,因此需要結合功能學及形態學特點對單個血栓的病變程度進行綜合診斷,根據臨床癥狀、冠脈腔內影像、功能學評價,以及有無病變分支等特點決定是否需要行血運重建[65]。
綜上所述,FFR目前已成為評價冠脈病變嚴重程度的金標準,可為臨界病變提供一定的診斷作用,但因存在一定局限性,在臨床上的應用并不廣泛。因此,FFR的改良版和影像重建FFR逐漸發展起來。iFR作為FFR的改良版,因具有測量時間短、無需使用血管擴張劑的特點,可用于無法測量FFR的患者,但仍為有創性指標。QFR則是一種無創的影像重建FFR,且與FFR一致性較好,具有較好的診斷及預后評估能力。此外,OFR作為另一種影像重建FFR,可在功能學評估的同時評價支架的放置情況,因此有望為將來指導血運重建尤其是臨界病變提供更好的客觀證據。各類指標均存在相應的診斷、預后評估能力及優劣勢,在以后的研究中可針對各類功能學指標的缺點進一步改進,或聯合使用多種功能學和形態學指標,進而合理地進行診斷并指導血運重建,以獲得較好的診斷及預后結果。

