CO2協同低溫有水對卵形鯧鲹麻醉保活效果的影響
杜 歡,秦小明,范秀萍,張家勝,李盛基
CO2協同低溫有水對卵形鯧鲹麻醉保活效果的影響
杜 歡,秦小明,范秀萍,張家勝,李盛基
( 廣東海洋大學食品科技學院 // 廣東省水產品加工與安全重點實驗室 // 廣東省海洋食品工程技術研究中心 // 水產品深加工廣東普通高等學校重點實驗室,廣東 湛江,524088)
【目的】探究二氧化碳CO2麻醉協同低溫對卵形鯧鲹有水保活的影響,延長卵形鯧鲹()的保活時間。【方法】研究保活過程中CO2質量濃度、麻醉時間、麻醉溫度和魚質量水比對卵形鯧鲹有水保活時長的影響;在最佳麻醉保活條件下,測定其血清生化指標、肌肉及肝臟氧化應激指標及代謝指標。【結果】卵形鯧鲹在16 ℃、100 mg/L CO2水溶液中麻醉3 min其麻醉效果最佳。在15 ℃低溫下進行有水保活,魚水質量比為2∶1,存活時間最長,為(359±2)min,此條件下復蘇率達100%。經過CO2麻醉協同低溫有水保活后的卵形鯧鲹血清谷草轉氨酶(GOT)活性顯著升高(<0.05)、尿素氮(BUN)和甘油三酯(TG)含量上升,血糖含量下降。肌肉中的乳酸脫氫酶(LDH)活性顯著上升(<0.05),乳酸(LD)和糖原含量上升,過氧化氫酶(CAT)活性和丙二醛(MDA)含量下降;肝臟中的LDH活性顯著上升(<0.05)、CAT活性和LD的含量上升,MDA和糖原的含量下降。【結論】CO2協同低溫有水對卵形鯧鲹有較好的麻醉效果,有助于保活運輸。在保活過程中卵形鯧鲹通過提升能量代謝水平和抗氧化能力應答環境應激,在一定程度上影響卵形鯧鲹保活過程的存活時間。
卵形鯧鲹;二氧化碳麻醉;低溫;有水保活;血清生化;氧化應激;代謝
卵形鯧鲹(),屬于硬骨魚綱鱸形目鲹科鯧鲹屬[1],主要分布在我國熱帶及亞熱帶海域,是湛江市主要經濟養殖類之一[2]。卵形鯧鲹肉中不飽和脂肪酸含量高,富含亞油酸、二十二碳六烯酸(DHA)和二十碳五烯酸(EPA),營養豐富、肉質鮮美[3],但其在運輸中常因激烈掙扎導致外皮破損、撞傷等因素會使代謝速率加快、激素水平的上升[4],極易引起品質受損甚至死亡,因此卵形鯧鲹長途運輸保活技術亟待發展。
二氧化碳(CO2)因其無毒、無藥性消退期的優勢,麻醉后的魚可直接進入市場,引起研究者們廣泛關注[5]。目前國內CO2麻醉技術主要應用在水產品保活,楊豐等[6]發現,羅氏沼蝦()在生態冰溫結合CO2麻醉技術下保活時間更長,可達到48 h,存活率高于90%,雖對蝦體肝臟和心肌造成損傷,但在一定時間內能保證蝦體正常生存;周翠平等[7]發現,用CO2麻醉羅非魚()的無水組ATP降解速度比有水組快,得出有水保活比無水保活機體體能消耗小的結果。而國外CO2麻醉主要應用在宰殺前和安裝魚類遙測發射器前,Erikson等[8]將CO2麻醉技術應用在宰殺大西洋鮭()上,發現麻醉宰殺后的大西洋鮭魚在冷凍貯藏1 ~ 2周后其營養價值與剛捕撈上來的鮭魚沒有差異;Christopher等[9]將CO2麻醉應用在梭鱸()植入手術,將魚類遙測發射器植入魚體內以監測魚的生長變化參數,可見CO2在水產品麻醉上具有較好效果。目前,CO2結合低溫有水保活卵形鯧鲹的研究尚未見報道。
基于此,本研究采用CO2麻醉卵形鯧鲹后進行低溫有水保活,探究在CO2麻醉卵形鯧鲹的較佳麻醉液濃度、麻醉時間、麻醉液溫度等保活條件下,保活復蘇后卵形鯧鲹的生理生化指標、氧化應激指標的變化情況,探明其對卵形鯧鲹的保活運輸的影響,以期為卵形鯧鲹的保活運輸提供技術支持。
1 材料與方法
1.1 材料與試劑
卵形鯧鲹,購自湛江市東風市場,體質量(490±30)g,挑選無外傷、鱗片完整、體長相近的魚體于塑料桶中停食暫養,暫養密度26.7 g/L,海水鹽度20 ~ 25,水溫24 ~ 26 ℃,采用砂濾循環海水(650 L/h),25 L/min空氣泵充氧,保證水體溶解氧質量濃度為6 ~ 8 mg/L,暫養6 h后用于試驗。
尿素氮BUN測定試劑盒(貨號 C013-2-1)、葡萄糖GLU測定試劑盒(貨號A154-1-1)、甘油三酯TG測定試劑盒(貨號 A110-1-1)、谷草轉氨酶GOT測定試劑盒(貨號 C010-2-1)、過氧化氫酶CAT測定試劑盒(A007-2-1)、丙二醛MDA測定試劑盒(貨號A003-1-1)、乳酸脫氫酶LDH測定試劑盒(貨號A020-2-2)均購于南京建成生物工程研究所;皮質醇測定試劑盒(貨號ml-E4005)購于上海酶聯生物科技有限公司;糖原測定試劑盒(貨號BC0345)、乳酸測定試劑盒(貨號BC2235)均購于北京索萊寶科技有限公司。
1.2 主要儀器與設備
TP688便攜式溫度計,溫州市德福智能科技有限公司;Varioskan全自動酶標儀,美國Thermo Fisher 公司;雙光束紫外可見分光光度計,北京譜析通用儀器有限責任公司;CO2麻醉設備由CO2鋼瓶、氧氣鋼瓶、玻璃魚缸等相關部件構成。
1.3 二氧化碳協同低溫有水保活卵形鯧鲹的條件優化
1.3.1 卵形鯧鲹麻醉及復蘇行為特征評估 參考范興[10]的魚類麻醉和復蘇的判定標準,并根據卵形鯧鲹的表形和生物特性做相應修改,具體見表1。魚死亡的判定是通過魚尾部的敲打無反應或魚眼的反射。

表1 卵形鯧鲹在不同麻醉和復蘇階段的行為表現
1.3.2 CO2常溫麻醉條件優化
1.3.2.1 CO2麻醉濃度的確定 選取健康的卵形鯧鲹在水溫(25±1)℃,海水鹽度20 ~ 25,暫養24 h;同時將CO2氣瓶連接氣石(氧泵供氧量為6 mg/L)放入魚缸中,對卵形鯧鲹(每次放入1尾)進行麻醉,在麻醉液溫度為25 ℃條件下,將卵形鯧鲹(每次1尾)分別放入質量濃度為70、100、165 mg/L(pH值分別為5.9、5.7、5.5)的CO2水溶液中進行麻醉至A3級;每個麻醉濃度選取6尾魚重復3次以上實驗,觀察實驗卵形鯧鲹的行為特征,記錄卵形鯧鲹所需的麻醉時間及在海水中的復蘇時間。
1.3.2.2 CO2麻醉時間的確定 暫養條件同1.3.2.1節。在25 ℃水溫下,將卵形鯧鲹放入100 mg/L CO2溶液中分別浸浴1、3、5、7 min后放入清水中復蘇至R4級,記錄復蘇率。以上4組實驗皆同時通入相同速率的O2供給魚體呼吸,每個重復用魚6尾。
1.3.3 CO2麻醉溫度對卵形鯧鲹保活的影響 暫養條件同1.3.2.1節。根據不同CO2濃度對卵形鯧鲹的麻醉效果,選擇質量濃度為100 mg/L的CO2溶液,分別在16、19、22和25 ℃的水溫下進行麻醉,麻醉后30 min內未能復蘇的魚記為死亡,記錄該條件下卵形鯧鲹所需麻醉時間和復蘇時間。另分別在16、19、22和25 ℃的溫度下用100 mg/L的CO2溶液麻醉卵形鯧鲹,裝袋充氧后于15 ℃生化培養箱進行無水保活[10],每組各取6尾魚,觀察不同麻醉液溫度下相同保活溫度的卵形鯧鲹保活時間。
1.3.4 魚水質量比對卵形鯧鲹保活的影響 暫養條件同1.3.2.1節。由保活麻醉溫度實驗的保活時間,選取16 ℃為麻醉溫度,采用0.5 ~ 1.0 ℃/h梯度降溫到達16 ℃后,將卵形鯧鲹投入到質量濃度為100 mg/L的CO2水溶液中,同時通入O2,麻醉后將卵形鯧鲹放置在魚水質量比分別為1∶0、
2∶1、1∶1、1∶2的袋中充氧打包后,放進15 ℃的生化培養箱進行無水保活,各取6尾魚,觀察不同魚水比下卵形鯧鲹的保活時間。
1.4 CO2協同低溫有水保活對卵形鯧鲹的影響
1.4.1 卵形鯧鲹有水保活處理 卵形鯧鲹按照1.3.2.1節條件暫養6 h后,使用碎冰以2 ℃/h梯度使水溫降至20 ℃,再以0.5 ~ 1.0 ℃/h梯度降溫到16 ℃,最后以1 L/min的流量向水中通入CO2至水溶液中CO2質量濃度為100 mg/L待其完全進入麻醉后,取出裝入袋中,使魚水質量比保持2∶1。充入純O2,每袋裝入1尾魚,置于15 ℃培養箱中保活,隨機從桶里取出3尾取樣測定肌肝指標、血清指標,作為新鮮組(CK)。將剩余卵形鯧鲹分為4組,每組6尾,第1組為CO2麻醉后的魚未進行保活,即保活0 h,作為麻醉對照組;第2組為CO2麻醉后的魚保活3 h組,第3組為保活6 h組,第4組為保活6 h后的復蘇6 h組。每組隨機取3尾測定相關指標。卵形鯧鲹尾部靜脈取血,將血液注入10 mL離心管中,4 ℃靜置2 ~ 3 h,3500 r/min下離心20 min,取上血清,置于4 ℃冰箱備用,并取背部肌肉與肝臟,液氮處理后放-80 ℃冷凍備用。
1.4.2 指標測定 血清中BUN、Glu、TG、GOT含量、CAT活性和MDA含量,均采用南京建成生物工程研究所試劑盒測定。Cortisol含量用酶聯免疫法測定(= 0.783 6- 0.038 9,2= 0.993 9);Gly、LD含量和LDH活性,使用Gly試劑盒、LD試劑盒和LDH試劑盒,采用試劑盒說明書對肝臟與肌肉樣品進行制備與檢測。
1.5 數據處理
應用SPSS 26.0軟件對實驗數據進行統計分析,結果以平均值±標準差表示。組間差異比較采用單因素方差分析,對于復蘇率非正態分布數據采用平方根反正弦變換后進行統計分析,兩兩比較方差齊時采用 LSD 檢驗法,方差不齊時采用 Dunnett’s T3 進行比較。0.05表示有顯著差異,圖表的繪制采用Origin 2017軟件。
2 結果與分析
2.1 卵形鯧鲹CO2麻醉協同低溫有水保活條件的確定
2.1.1 CO2常溫麻醉條件的優化
2.1.1.1 CO2麻醉濃度對麻醉時間及復蘇時間的影響 圖1中隨CO2水溶液的麻醉濃度上升,卵形鯧鲹麻醉時間呈增加趨勢,且變化顯著(<0.05),而對應的復蘇時間有所下降。MARKING等[11]發現,控制麻醉時間在3 min以內,復蘇時間在5 min以內時麻醉液濃度最佳。CO2質量濃度為70 mg/L時麻醉時間比CO2質量濃度為100 mg/L時長89 s, CO2質量濃度為165 mg/L時復蘇時間比CO2質量濃度為100 mg/L時長100 s,均導致機體耗能大。CO2水溶液質量濃度為100 mg/L進行麻醉魚處理時,麻醉時間為(321±5)s,復蘇時間為(279±8)s,綜合認為,100 mg/L為較佳的CO2麻醉質量濃度。

凡含一個相同字母表示同一指標差異不顯著(P>0.05)
2.1.1.2 CO2麻醉時間對復蘇時間及復蘇率的影響 在圖2(A、B)中顯示,在麻醉時間3 min時,復蘇時間最短,為(305±21)s,復蘇率100%。即3 min為最佳麻醉時間。麻醉5 min的復蘇時間比麻醉1 min長258 s,這可能是因為魚體長時間浸泡于麻醉液時,會導致魚體呼吸和血管舒縮中樞被麻醉液麻醉[12]。但其中麻醉1 min的復蘇時間比麻醉3 min的復蘇時間長91 s,這是因為此時魚麻醉深度不足,魚腦中的修復基因未來得及修復,導致細胞受損,復蘇階段需要更長的反應時間。
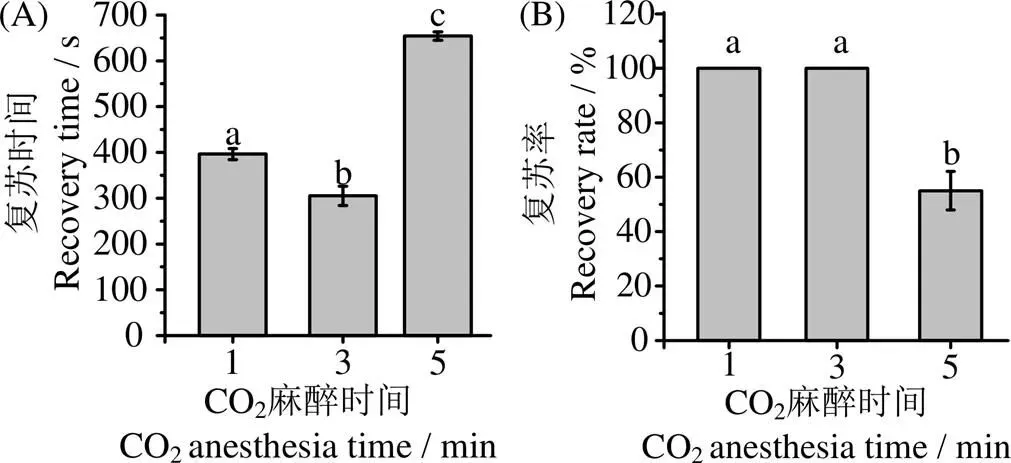
凡含一個相同字母表示差異不顯著(P>0.05)
2.1.2 麻醉溫度對魚體保活時間的影響 圖3(A、B)可看出,CO2麻醉液溫度16 ℃時麻醉時間為(158±2)s,比19 ℃時卵形鯧鲹的麻醉時間縮短1.13倍;復蘇時間為(1 004±9)s,復蘇時間較19 ℃長12.25%;保活時間為(111±7)min,比19 ℃長30.59%。可能是因為16 ℃接近卵形鯧鲹的生態冰溫的溫度,使其更容易進入休眠狀態,所以麻醉時間短。雖然25℃麻醉時間和復蘇時間符合MARKING等[11]發現,但相對于16 ℃,25 ℃對魚體的耗能大,保活時間為(37±5)min不利于保活運輸;且16 ℃時麻醉時間在3 min以內,復蘇時間較長方便魚的保活預處理,因此16 ℃為較佳的麻醉溫度。但16 ℃無水保活時間為(111±7)min,無水保活時長不到2 h,因此卵形鯧鲹運輸過程中需要通過一定的魚水質量比延長其保活時間。
2.1.3 不同魚水質量比對保活時間的影響 由圖4可看出,魚水質量比1∶0時(即無水保活),卵形鯧鲹保活時間為(111±3)min;魚水質量比為2∶1時,卵形鯧鲹保活時間為(359±2)min,比1∶0時保活時間多2.23倍。可能是因為與對含氧量要求較低的鲆鰈類等相比,卵形鯧鲹等需氧量較大的洄游性魚類,較難實現無水保活運輸[13]。完全無水不符合卵形鯧鲹的生存環境,保活袋中的水能使其鰓和皮膚濕潤,減少魚腮上的表皮黏液,更好地進行有氧呼吸;且魚水質量比2∶1比例下,實際操作更方便,能夠節約用水成本和運輸成本。

凡含一個相同字母表示同一指標差異不顯著(P>0.05)
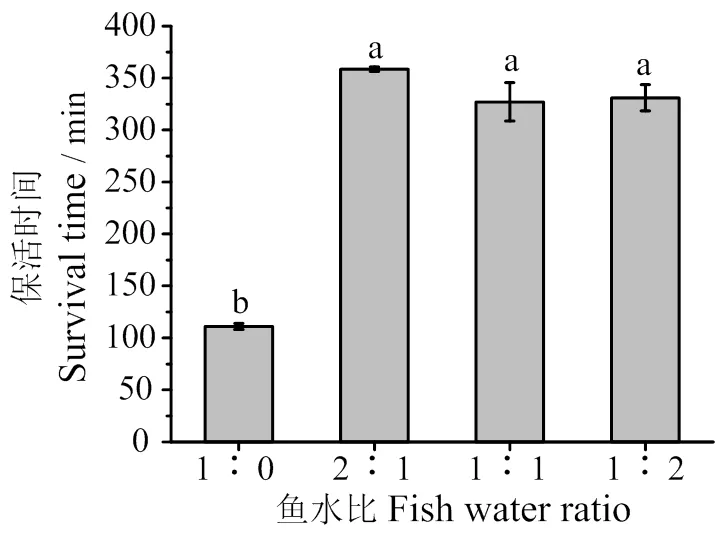
凡含一個相同字母表示差異不顯著(P>0.05)
2.2 CO2協同低溫有水保活對卵形鯧鲹血清生化指標的影響
圖5(A)中,卵形鯧鲹經CO2麻醉后血糖濃度顯著下降(< 0.05),而在復蘇6 h時恢復到初始水平。其中保活3 h的血糖含量比0 h少50.94%,保活6 h時比0 h少54.72%。麻醉后血糖下降是因為保活過程中卵形鯧鲹因應激供能需要加快糖酵解,導致血糖下降。卵形鯧鲹復蘇6 h時血糖濃度比新鮮組上升4.15%。
圖5(B)中,血清中皮質醇質量濃度保活過程中無顯著差異,復蘇6 h后也無顯著差異(> 0.05)。皮質醇在保活開始時上升,在保活結束復蘇6 h后下降。其中皮質醇上升可能是因為2∶1的魚水比改變魚的生活環境,造成一定的應激,復蘇時下降是因為回到正常的生存環境,但皮質醇激素水平顯著高于新鮮組水平(< 0.05)。
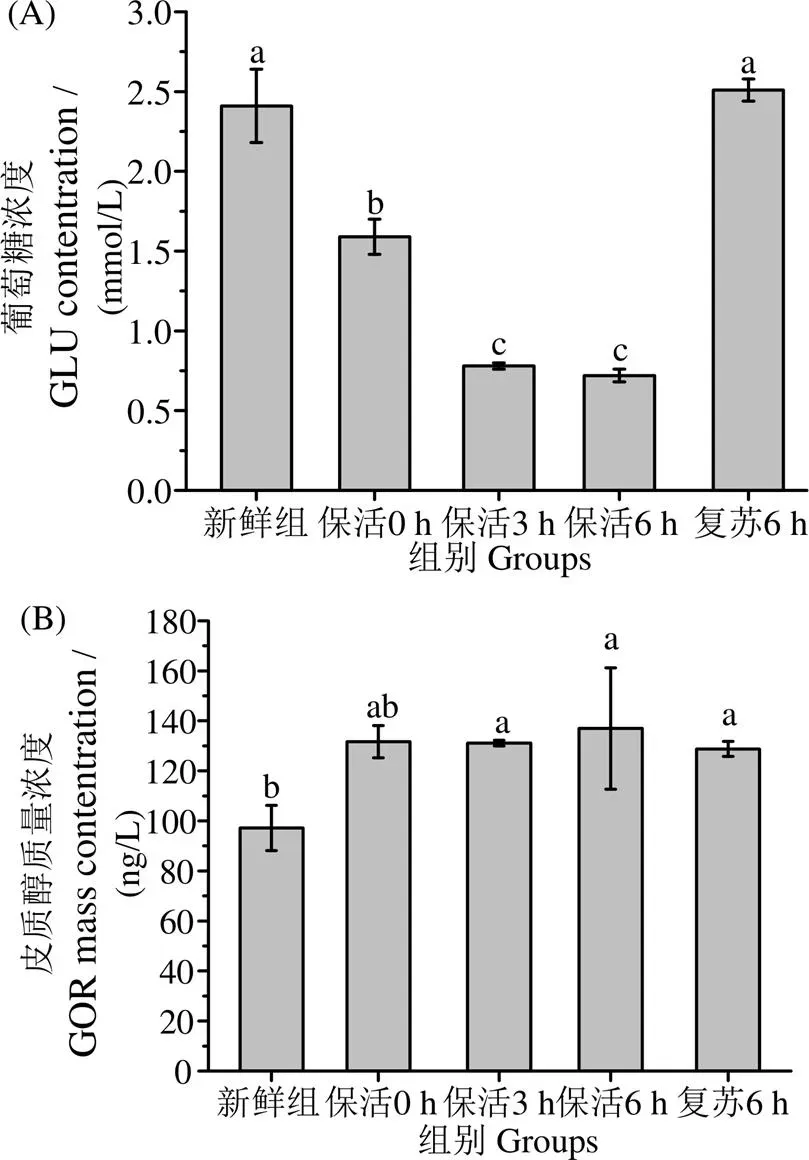
凡含一個相同字母表示差異不顯著(P>0.05)
谷草轉氨酶GOT活性的變化間接反映肝臟受損程度。圖6(A)中,卵形鯧鲹經二氧化碳結合低溫有水保活后血清中的GOT活性顯著上升(<0.05),復蘇后下降。這是因為當卵形鯧鲹受到刺激時,肝臟中GOT會釋放到血清中,導致血清中的GOT活性上升。表明經CO2和低溫協同保活后,隨著保活時間的延長,肝臟損傷會加重。
圖6(B)中,保活后卵形鯧鲹血清中的甘油三酯TG濃度顯著升高(<0.05),保活3 h和6 h分別是0 h的1.09倍和1.60倍;復蘇6 h時下降,是新鮮組的1.39倍。
尿素氮BUN含量的變化可以反映腎臟功能的代謝狀況。圖6(C)中,保活后卵形鯧鲹血清中的尿素氮濃度顯著升高(<0.05)。復蘇6 h時尿素氮濃度基本恢復至新鮮組水平。

凡含一個相同字母表示差異不顯著(P>0.05)
2.3 CO2協同低溫有水保活對卵形鯧鲹糖原與乳酸含量、乳酸脫氫酶活性的影響
圖7(A)卵形鯧鲹保活中肝糖原質量分數顯著下降(<0.05)。保活3 h比0 h少5.92%,保活6 h比0 h少18.09%;復蘇6 h后仍顯著低于新鮮組(<0.05),少14.72%,說明肝糖原在復蘇后尚未得到完全恢復。肌肉糖元被分解而肝糖原在保活過程中變化不顯著,肌糖原復蘇6 h比新鮮組多6.48%,可能是因為此時魚處于饑餓狀態,血液中葡萄糖無法滿足魚體的需要。
圖7(B)中,肌肉與肝臟的乳酸LD質量摩爾濃度在保活和復蘇整個過程中均呈先上升后下降的趨勢,肌肉中LD質量摩爾濃度在保活和復蘇過程中變化不顯著(> 0.05),復蘇6 h比新鮮組多22.22%。肝臟LD質量摩爾濃度保活時顯著高于新鮮組樣品(<0.05),復蘇6 h比新鮮組多28.57%。說明肝臟受損比肌肉受損嚴重,這可能也是隨著保活時間延長卵形鯧鲹復蘇率下降的重要原因之一。
圖7(C)中,在卵形鯧鲹保活復蘇過程中,肌肉乳酸脫氫酶LDH活性先下降后上升。肌肉LDH活性保活3 h為0 h的1.28倍,保活6 h為0 h的1.39倍,復蘇6 h為新鮮組的1.31倍。肝臟LDH的活性呈先上升后下降的變化,在整個保活和復蘇過程中差異不顯著(> 0.05)。保活0 h的肝臟LDH活性最高,保活3 h比0 h下降27.91%,保活6 h比0 h下降19.15%,復蘇6 h時為新鮮組的2.59倍,說明肝臟受損程度在復蘇后并未得到完全恢復。

凡含一個相同字母表示同一組織差異不顯著(P>0.05)
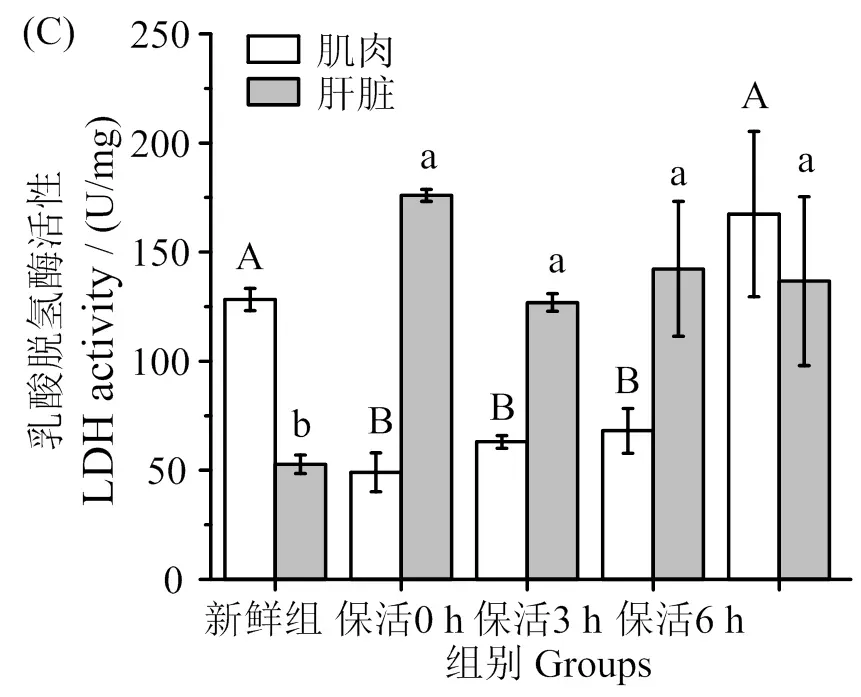
圖7(續)
Fig. 7(Continued)
2.4 CO2協同低溫有水保活卵形鯧鲹保活過程對CAT活性及MDA含量的影響
圖8(A)中,卵形鯧鲹在保活復蘇過程中肌肉過氧化氫酶CAT活性呈先下降后上升趨勢。與保活0 h相比,保活3 h活性減少61.42%,保活6 h活性減少75.82%,復蘇組比新鮮組少62.43%。肝臟CAT活性在保活復蘇過程中呈先上升后下降的趨勢,與保活0 h相比,保活3 h活性升高1.62倍,保活6 h升高2.91倍,復蘇6 h是新鮮組的2.68倍。這可能是因為保活過程中卵形鯧鲹的肝臟出現氧化應激的反應,需要補充CAT對其進行消除。
丙二醛MDA含量作為評價脂質過氧化的指標。圖8(B)中,卵形鯧鲹在保活復蘇過程肌肉與肝臟MDA質量摩爾濃度均下降后上升,且整個過程均顯著低于新鮮組(<0.05)。可能是因為在CAT等的作用下,卵形鯧鲹脂質過氧化水平有所降低。
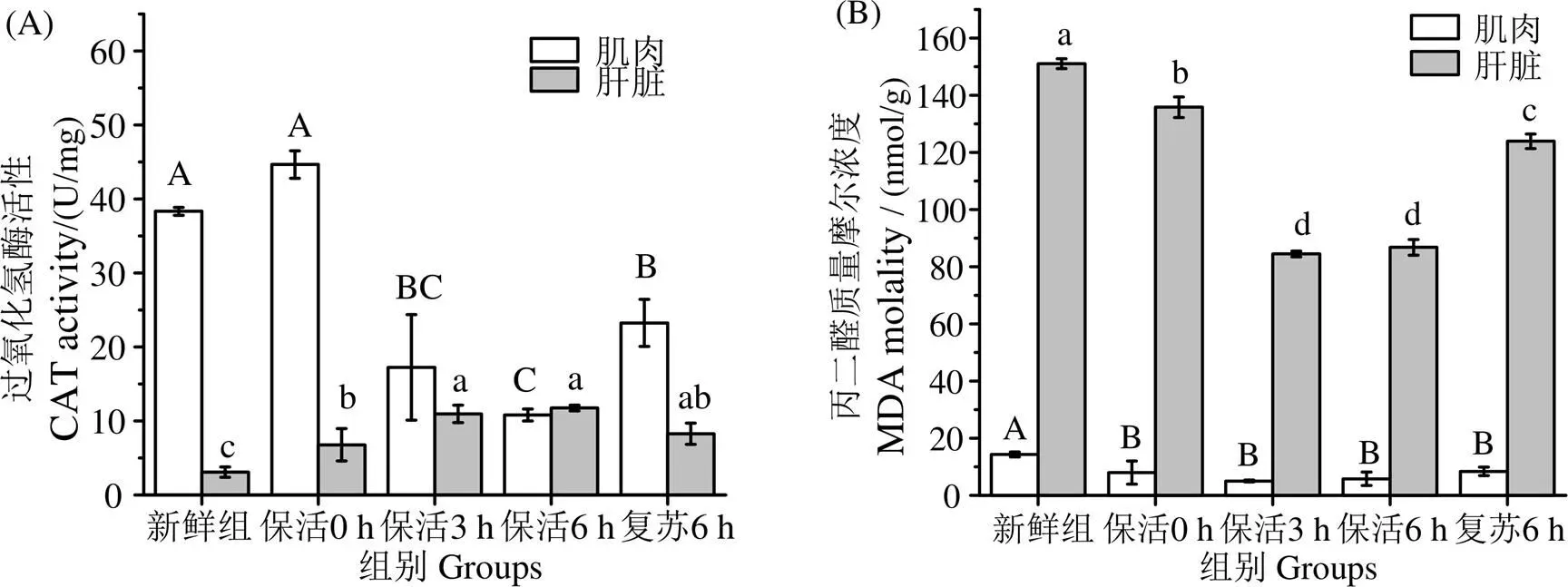
凡含一個相同字母表示同一指標差異不顯著(P>0.05)
3 討論
3.1 CO2質量濃度、麻醉時間、水溫及魚水比對卵形鯧鲹麻醉效果及保活效果的影響
3.1.1 CO2質量濃度、麻醉時間對卵形鯧鲹麻醉效果影響 卵形鯧鲹在CO2質量濃度為165 mg/L麻醉時,比100 mg/L的復蘇時間增加24.37%。這可能是魚浸泡于高麻醉液時,會導致的神經中樞處于深度麻醉,導致魚體復蘇時間延長,甚至死亡[12]。當CO2麻醉質量濃度為100 mg/L時,卵形鯧鲹的復蘇時間隨著麻醉時間的升高而降低,麻醉時間越高,復蘇率越低。其中麻醉1 min比麻醉3 min的復蘇時間長,主要是因為在缺氧環境中,(基因)可以激活抗氧化酶活性使神經元再生等方式保護腦內神經細胞[14 -15],麻醉1 min時魚腦中的基因未能及時反應,細胞受損導致復蘇時間延長。實驗發現,CO2麻醉質量濃度為100 mg/L時,卵形鯧鲹產生的應激反應較小;當CO2麻醉質量濃度為165 mg/L時,卵形鯧鲹在短時間內出現激烈撞擊麻醉缸、跳躍現象,表明魚體對高濃度麻醉液產生激烈的應激反應。本實驗得出,CO2麻醉卵形鯧鲹的較佳質量濃度為100 mg/L,這與CO2麻醉鳊()(90 mg/L)[16]所得的質量濃度相近,與CO2麻醉鰱()(155±15)mg/L[17]和大口黑鱸()(200 mg/L)[18]研究結果差別較大。這可能是因為不同種類的魚有不同的代謝速率,由于魚種類差異,相同的麻醉劑對不同魚的麻醉效果和適宜麻醉濃度具有一定差異[19]。綜合考慮,在25 ℃常溫下100 mg/L的CO2麻醉液麻醉3 min為卵形鯧鲹的最佳麻醉條件。
3.1.2 CO2麻醉水溫及魚水比對卵形鯧鲹保活效果的影響 一般情況下,水體溫度越高,魚類的代謝強度越強,氧氣消耗量越大,相對保活時間下降。吳云輝等[20]研究在不同溫度環境下半滑舌鰨()的存活率發現,3 ℃時半滑舌鰨存活率最高。水溫的降低可以減緩魚的代謝速率,降低氧氣消耗,是減少水中氨的產生的主要條件之一,減少溶氧的消耗,從而提高保活運輸時間。本研究發現,16 ℃為卵形鯧鲹保活預處理最佳麻醉溫度。
降低魚水比是保活運輸中重點考慮的經濟成本,無水保活為最佳狀態。但由于水產動物的生物學特性,在保活過程中不同魚的最大魚水比不同。本實驗結果表明,選擇魚水質量比2∶1的保活條件對卵形鯧鲹保活運輸時間有積極影響。
3.2 CO2麻醉協同低溫有水保活過程中對卵形鯧鲹血清生化指標、肌肉及肝臟指標變化的影響
卵形鯧鲹經暫養一段時間后運輸時,魚處于肌餓狀態,血液葡萄糖不能及時提供魚體消耗的能量,魚體進行無氧代謝,分解肌糖原,糖原產生乳酸。與丁亞濤等[16]發現CO2麻醉保活運輸鳊過程中肌糖原與肌肉LD上升的變化趨勢一致。肝臟與肌肉組織中的LD上升與糖元分解產生乳酸有關,因魚類利用肝糖元的能力差,主要分解肌糖元[21]。本研究發現,卵形鯧鲹在保活運輸過程中肝臟受損比肌肉受損程度大,這可能也是隨著保活時間的延長復蘇率下降的重要原因之一。
魚類的應激、代謝和行為受到下丘腦-垂體-腎間軸(HPI) 的調控[22]。皮質醇作為魚體應激指標,可以快速反映魚體激素水平。本研究中與新鮮組相比,麻醉后的卵形鯧鲹血清皮質醇含量升高,與Mohammad等[23]研究一致。而卵形鯧鲹經CO2麻醉后在保活過程中皮質醇的變化不顯著,表明CO2麻醉對卵形鯧鲹的保活應激有一定的安撫作用。
血液尿素氮含量的變化能夠反映腎功能的代謝情況。保活6 h時卵形鯧鲹血液中尿素氮含量上升,可能是因為保活過程中低溫脅迫應激導致其腎功能失常。保活中卵形鯧鲹血清的TG含量隨著保活時間的延長而增加,可能是因為保活過程中魚活性變弱,脂質利用率降低,未能起到供能作用。王美垚[24]也發現,吉富羅非魚()在低溫脅迫下無氧代謝增強,有氧與脂代謝受限,血清中TG上升。GOT是反應魚體應激響應的重要指標,是肝臟連接糖、脂質、蛋白質代謝中重要的酶。研究發現,保活0 h ~ 6 h組GOT酶活性顯著升高(<0.05),這可能是因為魚體受到刺激響應,供能不足,需要分解糖等能量物質或其肝臟受到了一定損傷,這也是卵形鯧鲹比鳊[16-18]等保活時間短的原因之一。
LDH主要存在于心肌細胞和腎臟中,其活性增強能反映心肌細胞和腎臟的受損程度[25]。與新鮮組相比,保活0 h組的肝臟LDH活性顯著上升(<0.05),表明CO2麻醉會對卵形鯧鲹造成肝臟損傷。
保活0 h組肌肉與肝臟CAT活性均增強,表明CO2麻醉對魚體造成一定的應激,在保活0 h ~ 3 h組肌肉中的CAT顯著下降(<0.05),可能是因為在保活袋中溶氧下降魚體受到低氧脅迫損傷[26]。而保活0 h ~ 3 h組中肝臟CAT的活性上升,可能是由于氧化應激的損傷,故肝臟會通過CAT等酶來對其進行消除。與周文等[27]發現史氏鱘()在低溫保活運輸中CAT活性變化一致。與新鮮組相比,保活0 ~ 6 h組肌肉與臟中MDA均呈下降趨勢,可能是因為保活時間的延長及在CAT等的作用下脂質過氧化水平降低,與低溫休眠保活珍珠龍膽石斑魚()的結果[28]一致。
4 結論
本研究采用綠色安全的CO2在16 ℃下麻醉質量濃度為100 mg/L CO2水溶液中對卵形鯧鲹麻醉3 min后,其麻醉效果最佳,在低溫下進行有水保活,魚水質量比為2∶1,存活時間最長,為(359±2)min,此條件下復蘇率達100%。CO2麻醉協同低溫有水保活卵形鯧鲹過程中,血清谷草轉氨酶活性、尿素氮和甘油三酯含量上升,血糖含量下降;肌肉中的乳酸脫氫酶活性、糖原和乳酸含量上升,過氧化氫酶活性、丙二醛含量下降;肝臟中的乳酸脫氫酶活性、過氧化氫酶活性、乳酸含量上升,糖原和丙二醛含量下降。可見CO2協同低溫有水保活對卵形鯧鲹的應激響應主要在能量代謝和氧化應激方面,提示在實際保活運輸中可加入一定劑量綠色安全的抗應激劑,減緩保活過程中低溫脅迫的損傷。
[1] 區又君, 陳世喜, 王鵬飛, 等. 低氧環境下卵形鯧鲹的氧化應激響應與生理代謝相關指標的研究[J]. 南方水產科學, 2017, 13(3): 120-124.
[2] 羅茵. 深水網箱養殖海域使用金新規出臺養殖業界盼調降[J]. 海洋與漁業, 2020(5): 56-57.
[3] 戴梓茹, 鐘秋平, 林美芳, 等. 金鯧魚營養成分分析與評價[J]. 食品工業科技, 2013, 34(1): 347-350.
[4] 陳名帥. 宰前二氧化碳處理對羅非魚和金鯧魚肉品質及應激性的影響[D]. 南寧: 廣西大學, 2014.
[5] 劉驍, 謝晶, 黃碩琳. 魚類保活運輸的研究進展[J]. 食品與發酵工業, 2015, 41(8): 255-260.
[6] 楊豐, 王逸鑫, 沈思遠, 等. CO2麻醉處理對羅氏沼蝦保活的影響[J]. 大連海洋大學學報, 2020, 35(6): 874-882.
[7] 周翠平, 鐘賽意, 秦小明, 等. CO2麻醉無水保活過程中羅非魚主要呈味成分的變化[J]. 中國食品學報, 2017, 17(5): 247-254.
[8] ERIKSON U, HULTMANN L, ERIK STEEN J. Live chilling of Atlantic salmon () combined with mild carbon dioxide anaesthesia[J]. Aquaculture, 2006, 252(2/3/4): 183-198.
[9] VANDERGOOT C S, MURCHIE K J, COOKE S J, et al. Evaluation of two forms of electroanesthesia and carbon dioxide for short-term anesthesia in walleye[J]. North American Journal of Fisheries Management, 2011, 31(5): 914-922.
[10] 范興. 麻醉對羅非魚和金鯧魚離水保活的影響[D]. 南寧: 廣西大學, 2014.
[11] MARKING L L, MEYER F P. Are better anesthetics needed in fisheries?[J]. Fisheries, 1985, 10(6): 2-5.
[12] Iwama G K, Ackerman P. Biochemistry and MolecularBiology of Fishes[J]. Anesthetics, 1994(3): 1-15.
[13] 張玉晗, 謝晶. 魚貝類生態冰溫無水活運研究進展[J]. 漁業現代化, 2017, 44(2): 38-42.
[14] CHEN Y H, COMEAUX L M, EYLES S J, et al. Auto-hydroxylation of FIH-1: an Fe(ii), alpha-ketoglutarate-dependent human hypoxia sensor[J]. Chemical Communications (Cambridge, England), 2008(39): 4768-4770.
[15] LI X, CHEN Y B, SHAO S Y, et al. Oxidative stress induces the decline of brain EPO expression in aging rats[J]. Experimental Gerontology, 2016, 83: 89-93.
[16] 丁亞濤. 鳊魚保活運輸技術的研究[D]. 上海: 上海海洋大學, 2019.
[17] 胡鑫, 丁晨雨, 葉勤, 等. 二氧化碳麻醉對鰱生理生化指標及神經調控相關基因表達的影響[J]. 淡水漁業, 2020, 50(1): 9-14.
[18] 張高立, 金晶, 呂維娜, 等. 大口黑鱸CO2麻醉保活運輸工藝研究[J]. 浙江農業科學, 2021, 62(3): 588-591.
[19] 謝晶, 曹杰. 漁用麻醉劑在魚類麻醉保活運輸中應用的研究進展[J]. 上海海洋大學學報, 2021, 30(1): 189-196.
[20] 吳云輝, 陳慧斌, 葉福財, 等. 溫度對半滑舌鰨無水保活的影響[J]. 食品工業, 2016, 37(1): 177-180.
[21] 李黎, 曹振東, 付世建. 力竭性運動后鲇魚幼魚乳酸、糖原和葡萄糖水平的變動[J]. 水生生物學報, 2007, 31(6): 880-885.
[22] 元輝明, 鄒華鋒, 呂為群. 活潑與不活潑褐牙鲆尾部神經系統UI表達差異的研究[J]. 基因組學與應用生物學, 2018, 37(8): 3322-3330.
[23] MAZANDARANI M, HOSEINI S M. Menthol and 1, 8-cineole as new anaesthetics in common carp,(Linnaeus, 1758)[J]. Aquaculture Research, 2017, 48(6): 3041-3051.
[24] 王美垚. 急性低溫脅迫及恢復對吉富羅非魚血清生化、免疫以及應激蛋白基因表達的影響[D]. 南京: 南京農業大學, 2009.
[25] Wang Y, Huang Y, Li X, et al. Changes of AST, ALP, CK and LDH-L level in biological injury models caused by 18.4 mm rubber bullet [J]. Int J Lab Hematol, 2012(15): 1828?1829.
[26] AFONSO V, CHAMPY R, MITROVIC D, et al. Reactive oxygen species and superoxide dismutases: Role in joint diseases[J]. Joint Bone Spine, 2007, 74(4): 324-329.
[27] 周文, 白嬋, 王炬光, 等. 無水保活運輸溫度對史氏鱘氧化應激的影響[J]. 肉類研究, 2021, 35(7): 32-37.
[28] 范秀萍. 珍珠龍膽石斑魚低溫休眠無水保活的脅迫響應與機制研究[D]. 湛江: 廣東海洋大學, 2019.
Synergistic Effect of CO2and Low Water Temperature on the Anesthesia and Survival of
DU Huan, QIN Xiao-ming, FAN Xiu-ping, ZHANG Jia-sheng, LI Sheng-ji
(,//////,524088,)
【Objective】 In order to prolong the survival time ofand explore the effect of carbon dioxide ( CO2) anesthesia combined with low temperature on the water survival of. 【Methods】 Effects of CO2concentration, anesthesia time, anesthesia temperature and fish-water mass ratio on survival time ofwere studied. Under the optimal survival conditions, the serum biochemical indexes, oxidative stress indexes and metabolic indexes of muscle and liver were determined. 【Results】was anesthetized in 100 mg/L CO2aqueous solution at 16 ℃ for 3 min, and the anesthetic effect was the best. The fish was kept alive with water at 15 ℃, and the fish-water ratio was 2∶1. The longest survival time was (359±2) min, and the recovery rate was 100%. After preservation, the serum GOT activity increased significantly (< 0.05), BUN and TG content increased, and blood glucose content decreased. LDH activity in muscle increased significantly (< 0.05), LD content increased, CAT activity, glycogen and MDA content decreased ; lDH activity in liver increased significantly (< 0.05), CAT activity, glycogen and LD content increased, MDA content decreased.【Conclusion】Synergistic effect of CO2and low water temperature has good anesthetic effect on, which is helpful to keep alive and transport. In the survival process,responds to environmental stress by improving energy metabolism and antioxidant capacity, which affects the survival time of.
; carbon dioxide anesthesia; low temperature;water preservation; serum biochemistry; Oxidative stress; metabolism
TS254.1
A
1673-9159(2022)01-0035-09
10.3969/j.issn.1673-9159.2022.01.006
杜歡,秦小明,范秀萍,等. CO2麻醉協同低溫有水保活對卵形鯧鲹麻醉保活效果的影響[J]. 廣東海洋大學學報,2022,42(1):35-43.
2021-10-10
“十三五”國家重點研發計劃“藍色糧倉科技創新”重點專項(2019YFD0901601)
杜歡(1996―),女,碩士研究生,研究方向為卵形鯧鲹生態冰溫保活運輸技術。E-mail:1027428913@qq.com
秦小明(1964―),男,博士,教授,研究方向為水產品加工與保活流通。E-mail:xiaoming0502@21cns.com
(責任編輯:劉朏)

