鐵磁性納米材料的制備及對17b-雌二醇的選擇性富集——基于分子印跡技術
管安浙,趙旭東,張婷婷,李 易,李建生,陸 銳
鐵磁性納米材料的制備及對17b-雌二醇的選擇性富集——基于分子印跡技術
管安浙,趙旭東,張婷婷,李 易,李建生,陸 銳*
(南京理工大學環境與生物工程學院,江蘇 南京 210094)
將鐵磁性分離與分子印跡技術結合,以四氧化三鐵納米顆粒為核,以17β-雌二醇(E2)為模板分子,3-氨基丙基三乙氧基硅烷(APTES)為功能單體, 利用表面聚合法制備了E2分子印跡納米材料(MIPs)和不含E2的非印跡納米材料(NIPs).通過傅里葉變換紅外光譜(FT-IR)、X射線衍射(XRD)、X射線光電子能譜(XPS)和掃描電鏡(SEM)等方法對MIPs和NIPs進行分析和表征,顯示MIPs形狀規則呈球狀粒徑統一在790nm左右.選擇吸附實驗中,MIPs和NIPs對E2的飽和吸附量分別為9.69,6.25mg/g,說明材料具有較好的選擇性.對靜態吸附數據進行Freundlich線性擬合,結果證明MIPs具有良好的吸附能力.同時,MIPs表現出優秀的可重復利用性,7次吸附-解吸后吸附損失量僅為3%.
分子印跡;磁性納米材料;表面聚合;17β-雌二醇
17β-雌二醇(E2)是一種天然的雌激素,廣泛應用于畜牧業,起到促進動物生長,增強脂肪沉積,增加原料奶產量的作用[1].E2可以通過食物鏈在人體內富集[2-4].小劑量E2可治療功能性子宮出血等疾病,緩解骨質疏松癥.然而,過量攝入E2會擾亂內分泌系統,導致子宮內膜異位癥、卵巢癌、睪丸癌和前列腺癌等疾病[5-6].因此對E2環境殘留量檢測分析意義重大,但環境樣品中E2通常以低濃度存在,且存在干擾組分,檢測需要對E2進行分離富集.
分子印跡技術是指制備出能對目標分子進行選擇性識別的聚合物的技術,其制備原理是模板分子與功能單體先進行預聚合[7-8],再在交聯劑[9]、引發劑的作用下,形成含有模板分子的高分子聚合物[10],最后破壞預聚合物間的作用力將印跡分子洗去[11],得到分子印跡聚合物(MIP).這種人工合成材料的識別性能與酶、抗體等天然物質相似[12],同時還具有協同識別能力、穩定性和制備成本低等優勢[13],被廣泛應用于手性分離、固相萃取、模擬酶、化學傳感器等領域[14-16].然而,傳統的MIP具有識別點位分布不均和非特異性識別等缺點.隨著對分子印跡技術的研究的深入,表面印跡技術的出現則有效改善了這些問題.表面印跡法,即在固相基質表面進行印跡聚合反應.本文選擇納米材料作為固相基質,是因為納米顆粒尺寸小,比表面積高[17],可以加快結合模板分子的動力學[18],有效提高印跡分子的洗脫-吸附速率.本文將分子印跡技術與磁性納米材料結合,以Fe3O4@SiO2納米粒子為核,1,2-二(三乙氧基硅基)乙烷(BTESE)為交聯劑、3-氨基丙基三乙氧基硅烷(APTES)為功能單體,通過表面印跡法制備17β-雌二醇磁性分子印跡納米材料.同時,對制備的納米材料進行了傅里葉變換紅外光譜(FT-IR)、X射線衍射(XRD)、X射線光電子能譜(XPS)、掃描電鏡(SEM)和動態光散射(DLS)等一系列儀器分析和吸附動力學、選擇性吸附、再生吸附等實驗研究.
1 材料與方法
1.1 實驗試劑
六水合氯化鐵(FeCl3×6H2O)、無水乙酸鈉(NaAC)、氨水,均為分析純試劑,購于南京化學試劑有限公司;正硅酸四乙酯(TEOS,AR)、乙二醇(AR)和十六烷基三甲基溴化銨(CTAB,AR)由國藥集團化學試劑有限公司提供;1,2-二(三乙氧基硅烷)乙烷(BTESE,CP)、3-氨基丙基三乙氧基硅烷(APTES,CP)和17β-雌二醇(E2,BR)購自上海麥克林生化有限公司;冰乙酸(AR)購于南京晚晴化學試劑有限公司.
1.2 合成Fe3O4@SiO2納米微球
Fe3O4納米粒子的制備:將1.35g FeCl3×6H2O, 3.60g NaAC溶解在50mL乙二醇并攪拌均勻,再將混合溶液轉移至特氟龍不銹鋼高壓反應釜中,在200℃下反應6h,制得的Fe3O4依次用水、乙醇各洗滌3次后,真空干燥備用.
制備硅烷化的Fe3O4納米顆粒:取100mg上一步驟中制得的Fe3O4,溶于20mL水中,超聲使溶液分散均勻后,再加入115mL乙醇和2mL氨水,超聲15min,然后緩慢地滴加2mL TEOS,室溫下快速攪拌12h.制得的產物在外加磁場的輔助下,用乙醇和水反復洗滌,以除去未反應的TEOS,45℃真空干燥過夜.
1.3 基于Fe3O4@SiO2的表面分子印跡聚合物的制備
取0.5465g CTAB溶解于20mL的水和10mL乙醇的混合液中,再加入100mL水,然后將3mL氨水(28%,質量分數)、3mL BTESE(交聯劑)、235μL APTES(功能單體)和70mg E2(模板分子),加入至上述混合液中,超聲分散均勻后,于室溫下攪拌1h, 使模板分子和功能單體進行預組裝.然后加入80mg Fe3O4@SiO2,超聲使其分散均勻后,在室溫下攪拌聚合6h.反應完成后,在外加磁場的輔助下分離產物,得到含有模板分子的印跡聚合物.再以甲醇溶液(含2%(體積分數)冰乙酸)為洗脫劑去除聚合物中的模板分子,用高效液相色譜檢測洗脫液,直至洗脫液中檢測不到17β-雌二醇為止,最后將Fe3O4@SiO2@MIPs置于55℃真空干燥箱中烘干,用于后續實驗.制備流程見圖1. Fe3O4@SiO2@NIPs的制備過程與MIPs的制備條件相同,只是不加入模板分子E2.
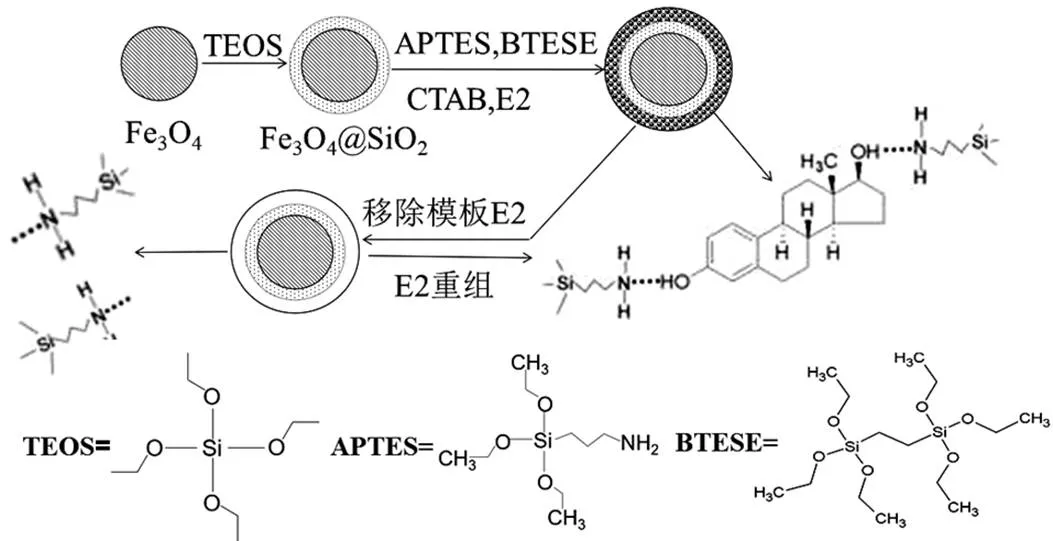
圖1 E2磁性分子印跡聚合物的制備流程
1.4 實驗設備
實驗使用的儀器主要有X-射線衍射儀(XRD, D8Advance,德國-Bruker)、Zeta電位-粒徑分析儀(美國-Brookhaven)、掃描電子顯微鏡(SEM, Quante 400FEG,美國-FEI)、高分辨Zeta電位及粒度分析儀(Zeta PALS,Brookhaven)綜合物性測量系統(PPMS- 9TM,美國-Quantum Design)、傅里葉紅外光譜儀(FT-IR,Nicolet iS10,美國-Thermo Fisher)、X射線光電子能譜(XPS,ESCALAB 250Xi,美國-Thermo Fisher)以及高效液相色譜儀(HPLC,E2695,美國-Waters).
1.5 吸附性能研究
1.5.1 靜態吸附實驗 探究了E2初始濃度變化對吸附性能的影響.分別稱取適量MIPs和NIPs,浸入5mL不同濃度的E2溶液中(1~200mg/L),然后于室溫下振蕩吸附6h,在外加磁場的作用下分離上清液,用高效液相色譜檢測上清液中E2的濃度.
1.5.2 吸附動力學實驗 分別稱取適量的MIPs和NIPs,分別置于25mL具蓋樣品瓶中,加入10mL 70mg/L的E2溶液,在30℃恒溫振蕩,取不同時間段(1,2,3,4,5,6,7,8h)的上清液,用高效液相色譜測定上清液中E2的濃度吸附后溶液中殘留的E2濃度.
1.5.3 選擇性吸附實驗 首先配置70mg/L 的E2、雌三醇(E3)、雙酚A(BPA)和3,4-苯并芘(BaP)的乙醇溶液,其中E3、BPA為E2的結構類似物,BaP為非結構類似物.然后分別稱取適量MIPs和NIPs,浸入5mL上述溶液中,室溫下振蕩至吸附平衡后,取上清液,用高效液相色譜檢測上清液中E2、E3、BPA和BaP的濃度.
1.5.4 吸附再生實驗 分別稱取適量MIPs和NIPs浸入5mL 70mg/L的E2溶液中,室溫下振蕩至吸附平衡后,在外加磁場的作用下分離上清液,用高效液相色譜檢測上清液中E2的濃度.然后用甲醇(含2%(體積分數)冰乙酸)溶液洗脫吸附后的MIPs和NIPs,同樣用高效液相色譜檢測洗脫液中E2的濃度.洗脫后的MIPs和NIPs真空干燥后,重復7次上述吸附-解吸過程,探究MIPs的循環使用情況.
2 結果與討論
2.1 表征結果與分析
由圖2a可知Fe3O4呈球狀結構且大小均一;圖2b為Fe3O4@SiO2的掃描電鏡圖,表面硅烷化的Fe3O4的粒徑明顯增加,并從明暗程度可清晰看出核-殼結構納米顆粒的形成;圖2c、d為MIPs和NIPs的掃描電鏡圖,Fe3O4@SiO2表面明顯包覆了一層物質,粒徑略有增加.

圖2 Fe3O4 (a)、Fe3O4@SiO2 (b)、MIPs (c)和NIPs (d)的SEM圖
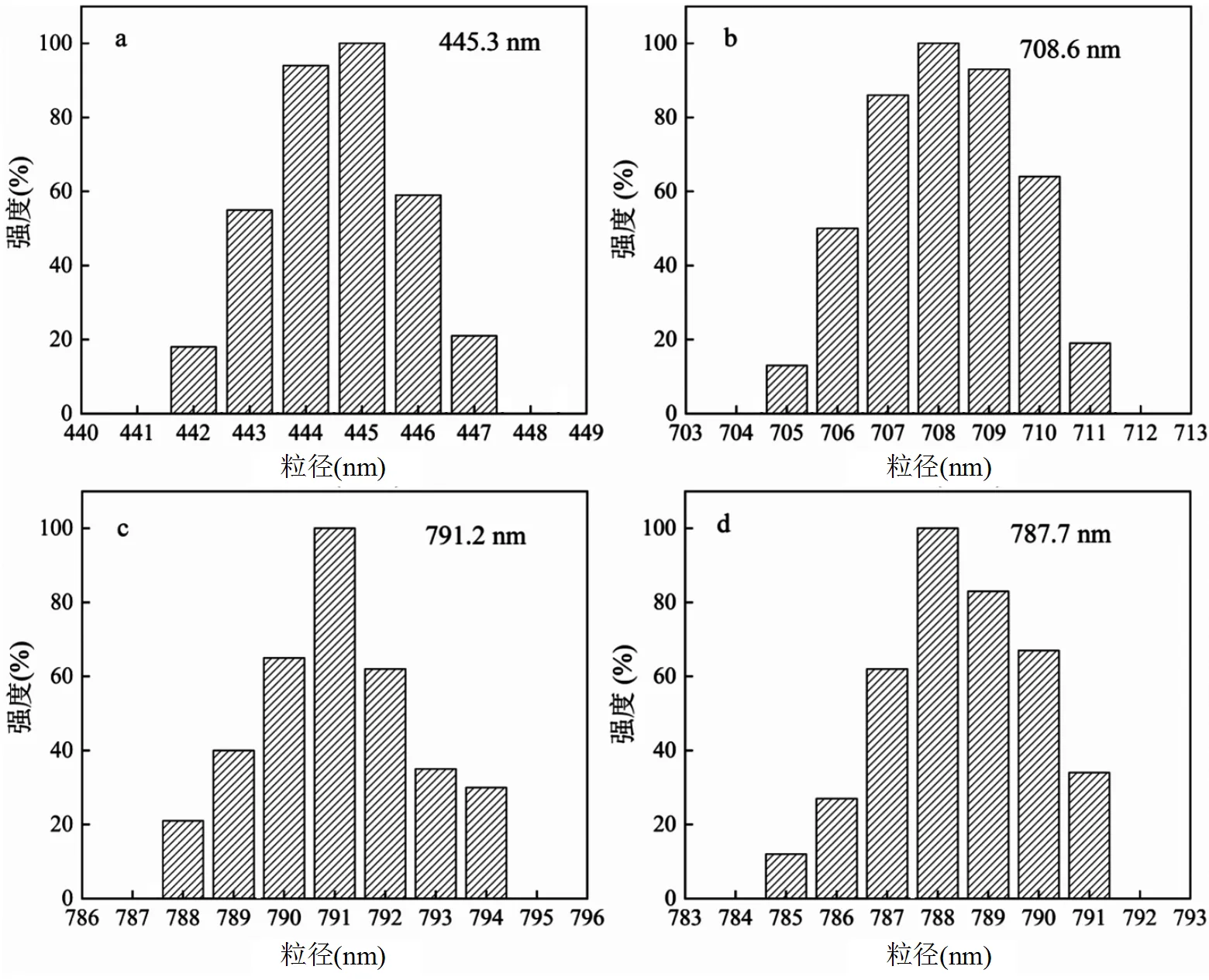
圖3 Fe3O4(a)、Fe3O4@SiO2(b)、MIPs(c)和NIPs(d)的動態光散射圖
由圖3可知,4種粒子的直徑分別為445.3, 708.6, 791.2和787.7nm,其中,SiO2層的平均厚度在125nm左右;MIPs和NIPs層的平均厚度為40nm左右,DLS的結果與SEM觀測結果一致.制備的印跡材料形狀規則,粒徑均一.
如圖4所示,710.76和532.48eV位置處的峰對應Fe 2p和O s1的特征峰,證明有效合成了Fe3O4.在包覆SiO2后,可以觀察到102.85eV處的Si 2p峰,且710.76eV處的Fe 2p峰強大幅度降低,這是由于SiO2較厚造成的.表面印跡聚合后,MIPs和NIPs中都可以觀察到405eV的N 1s峰(圖4e),N元素來源于功能單體中的氨基,證明材料按照預想制備成功.
如圖5所示,這4種納米材料在570cm-1處都存在明顯吸收峰,對應的是Fe3O4中Fe-O伸縮振動;包覆SiO2后,765, 904和1021cm-1處的峰分別對應于Si-O的彎曲振動,Si-OH的對稱伸縮振動和Si-O不對稱伸縮振動;包覆聚合物后,1635cm-1處為BTESE中C=O的伸縮振動特征峰,2882和2983cm-1對應于APTES中長鏈烷基的伸縮振動.這些峰的出現說明聚合物成功包覆在Fe3O4@SiO2表面.
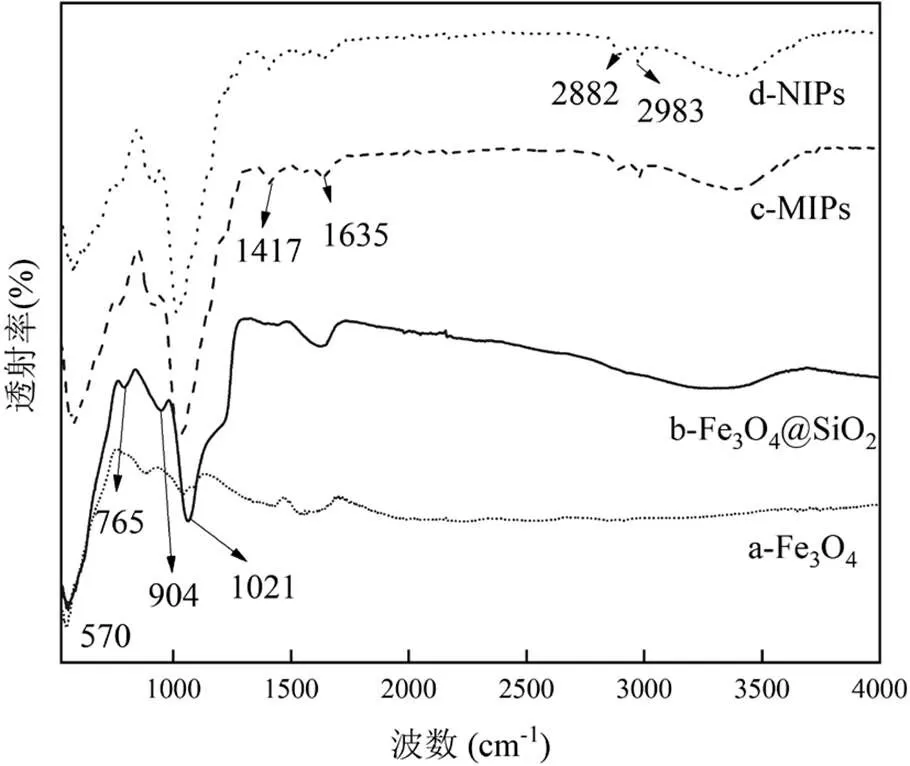
圖5 Fe3O4(a)、Fe3O4@SiO2(b)、MIPs(c)和NIPs(d)的FT-IR圖
如圖6所示,這4種樣品中,都能在2值為30.15, 35.49, 43.24, 53.72, 57.22和62.84°處觀察到明顯的衍射峰,這些峰位置與Fe3O4的晶面指數(220)、(311)、(400)、(422)、(511)和(440)相對應.在SiO2和聚合物依次包覆后,Fe3O4衍射峰強度有所降低,但峰位置沒有發生偏移.說明成功制備出Fe3O4,且Fe3O4的晶體結構沒有發生變化,納米材料具有良好的磁性.
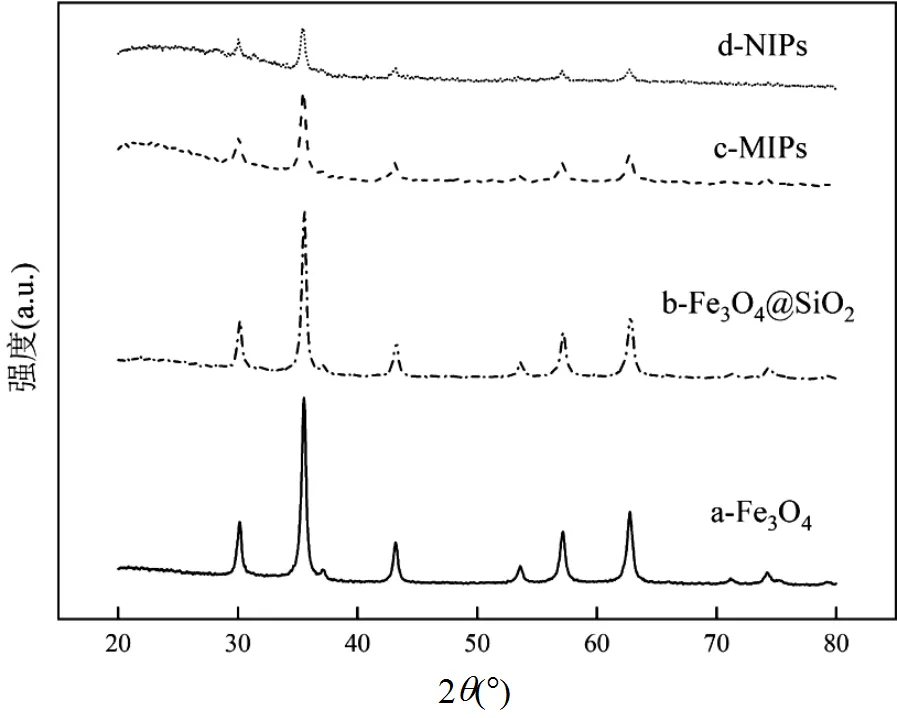
圖6 Fe3O4、Fe3O4@SiO2、MIPs和NIPs的XRD圖
如圖7所示,Fe3O4的磁化強度值為80.47emu/g, SiO2包覆后強度有所降低,降低至61.18emu/g,MIPs和NIPs包覆后,磁化強度值分別降至31.28 和26.86emu/g.與Fe3O4相比,MIPs和NIPs納米顆粒的磁性降低,但仍然具有足夠的磁場強度實現在外加磁場下快速分離.
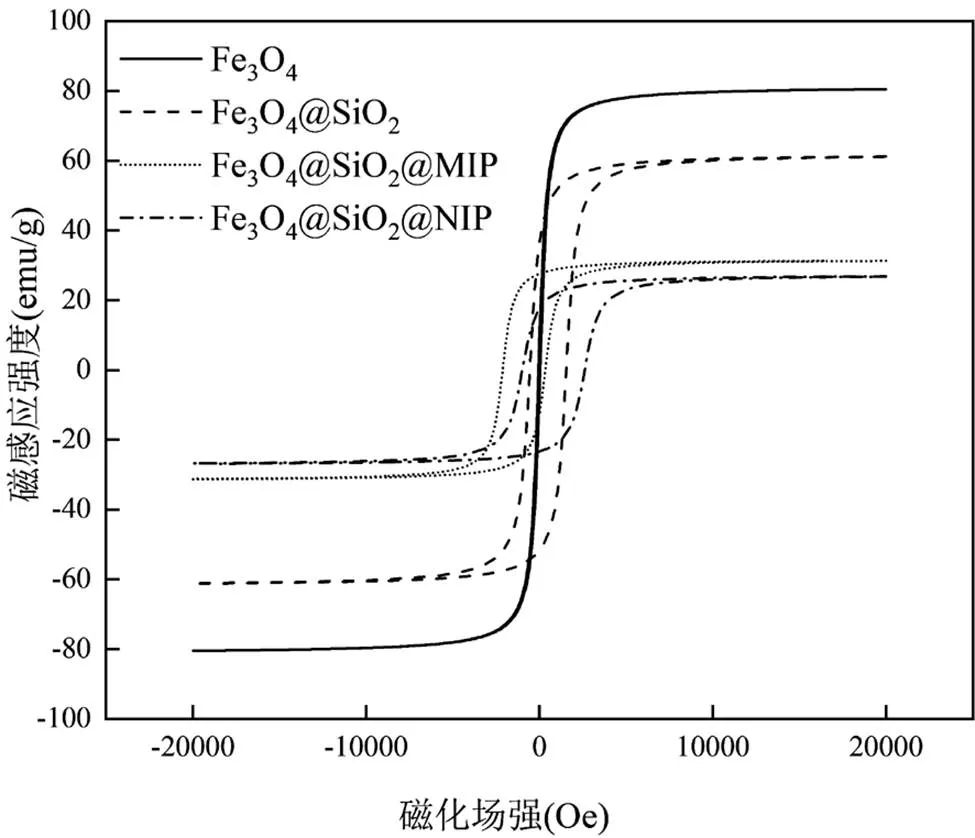
圖7 Fe3O4、Fe3O4@SiO2、MIPs和NIPs的磁滯回線測試(VSM)圖
2.2 吸附等溫線
探究MIPs和NIPs對E2的結合性能,測定了室溫下MIPs和NIPs對E2初始濃度在0~200mg/L濃度范圍內的吸附容量,繪制了吸附等溫線(圖8)從圖中可以看出,隨著E2濃度增加,MIPs和NIPs對E2的吸附量也隨之增加,且MIPs對E2的吸附量明顯高于NIPs,這表明MIPs對E2存在選擇性吸附,對E2的識別能力強,吸附容量大.
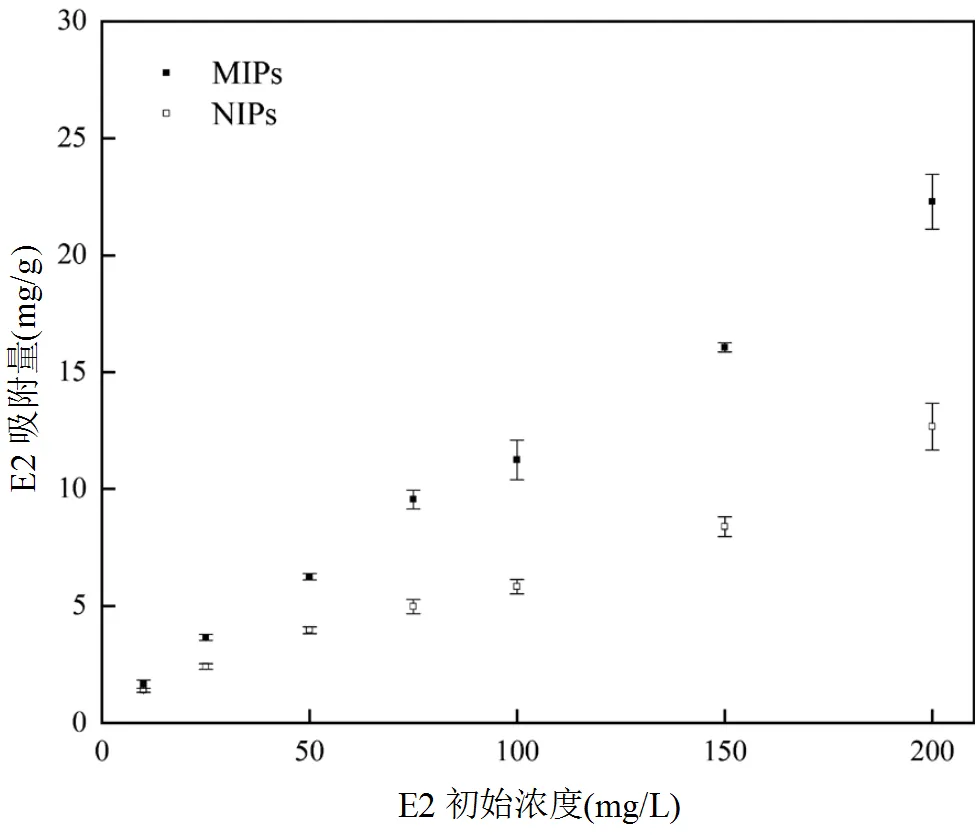
圖8 MIPs和NIPs的吸附等溫線
為了更加直觀地表達MIPs和NIPs對E2吸附性能的差異,利用Freundlich吸附等溫模型對吸附數據進行分析.
MIPs和NIPs的擬合結果見表1和圖9.MIPs的f值遠遠高于NIPs的f值,說明MIPs對E2的吸附能力強;MIPs的1/值小于NIPs的1/值,說明MIPs對E2的吸附比NIPs更容易進行.結合圖8可知,MIPs具有優秀的選擇性吸附性能.

表1 MIPs和NIPs的Freundlich等溫線擬合參數
注:f是Freundlich結合常數,是吸附劑吸附能力的指標;表示吸附過程的支持力,1/值越小表示模板分子越易吸附.
2.3 吸附動力學
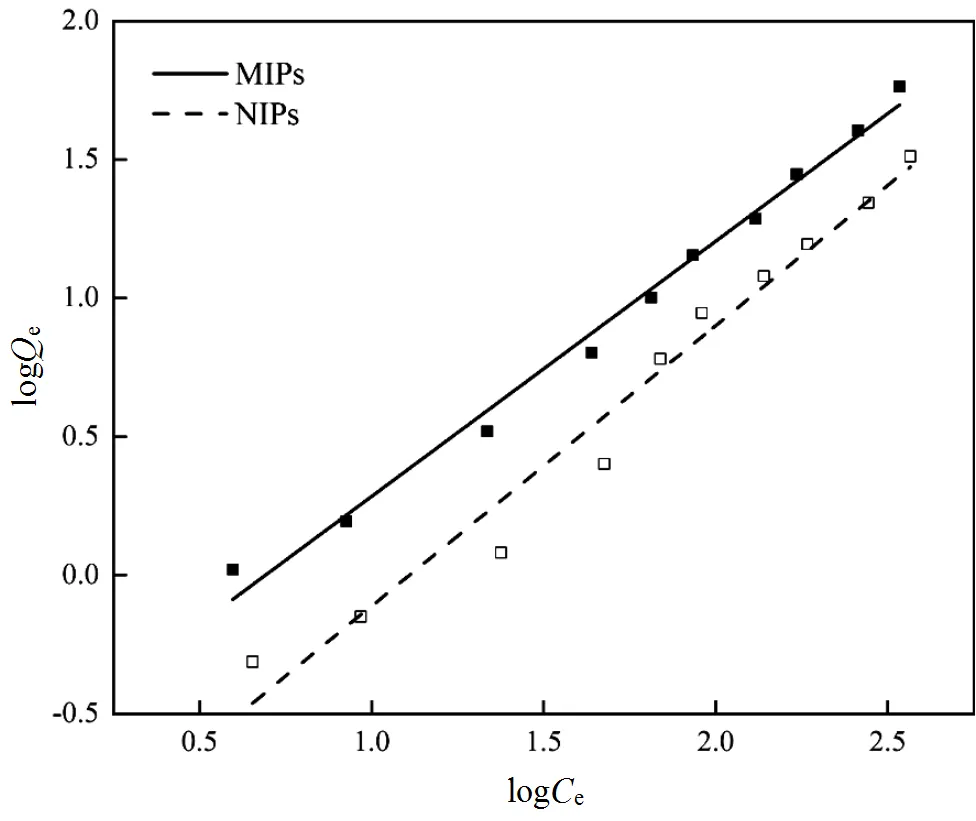
圖9 MIPs (a)和NIPs (b)的Freundlich線性擬合圖
e為平衡吸附量, mg/g;e為吸附平衡時E2的溶液濃度, mg/L
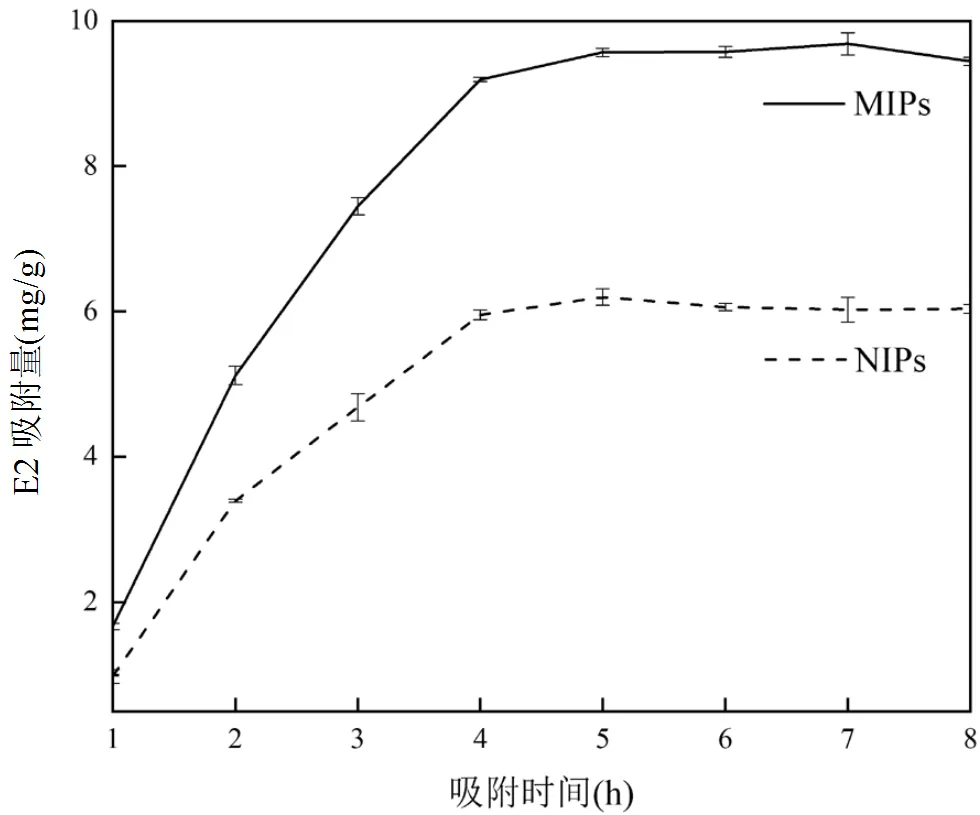
圖10 MIPs和NIPs的動態吸附曲線
在吸附動力學實驗中,E2初始濃度為70mg/L,于30℃下振蕩吸附,每隔一段時間取1.5mL上清液測定E2的含量.結果如圖10所示,隨著吸附時間的增加,MIPs和NIPs對E2的吸附量逐漸增加并趨于平衡.在3h內,吸附速率上升較快,在4h后吸附量基本趨于平衡,在5h之后基本達到平衡.并且,MIPs的平衡吸附量明顯大于NIPs的吸附量,說明MIPs對E2具有較好的吸附動力學性質.
2.4 選擇性吸附
如圖11所示,與其他化合物相比,MIPs和NIPs對E2的吸附量最大,分別為9.69和6.25mg/g,表現出明顯的選擇性.對結構類似物E3、BPA的吸附容量次之,分別為4.05, 1.39mg/g和3.73, 1.57mg/g.對結構非類似物BaP的吸附量最少,低至0.67和0.60mg/g.同時,MIPs對4種物質的吸附量都大于NIPs.以上結果表明,MIPs對模板分子及其結構類似物具有較好的選擇性能.
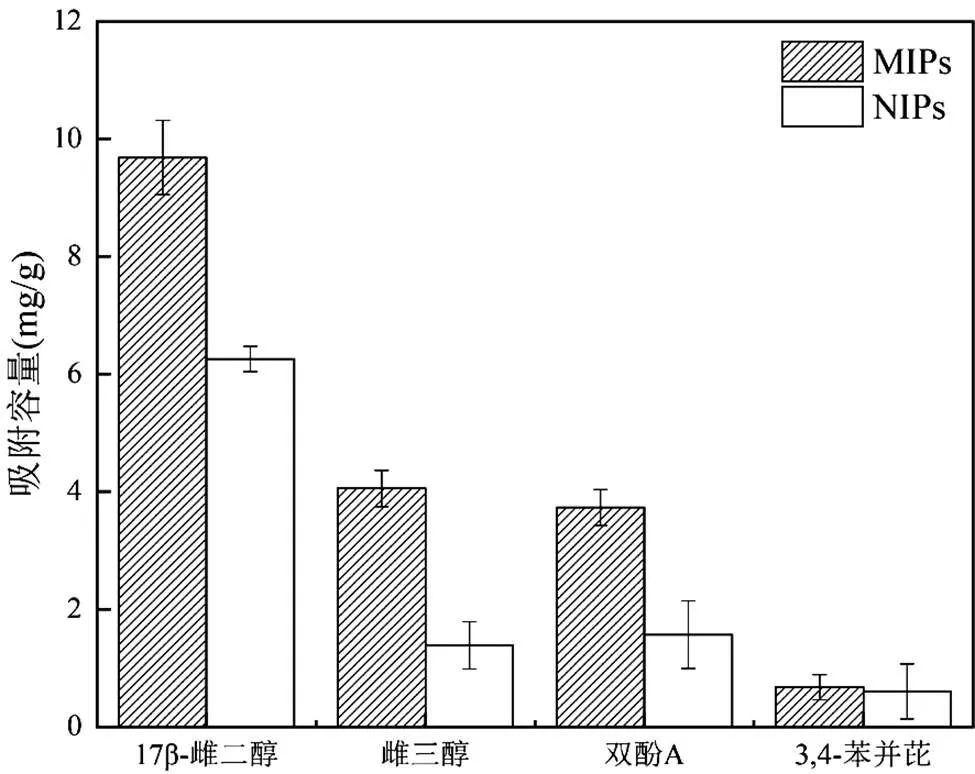
圖11 常溫下MIPs和NIPs對E2、E3、BPA和BaP的選擇性吸附
2.5 吸附再生
從圖12中可知,經過7個循環后,MIPs和NIPs的吸附性能并未產生明顯變化,MIPs穩定在9mg/g上下,NIPs穩定在6mg/g上下.圖13為MIPs每次循環對E2的吸附量和解吸量變化,吸附損失量約3%.表明MIPs在具有良好吸附能力的同時,表現出優秀的可重復利用性.綜上可知,本文制備的MIPs具有較好的化學穩定性和使用壽命長的優點,可用于E2的快速分離富集.
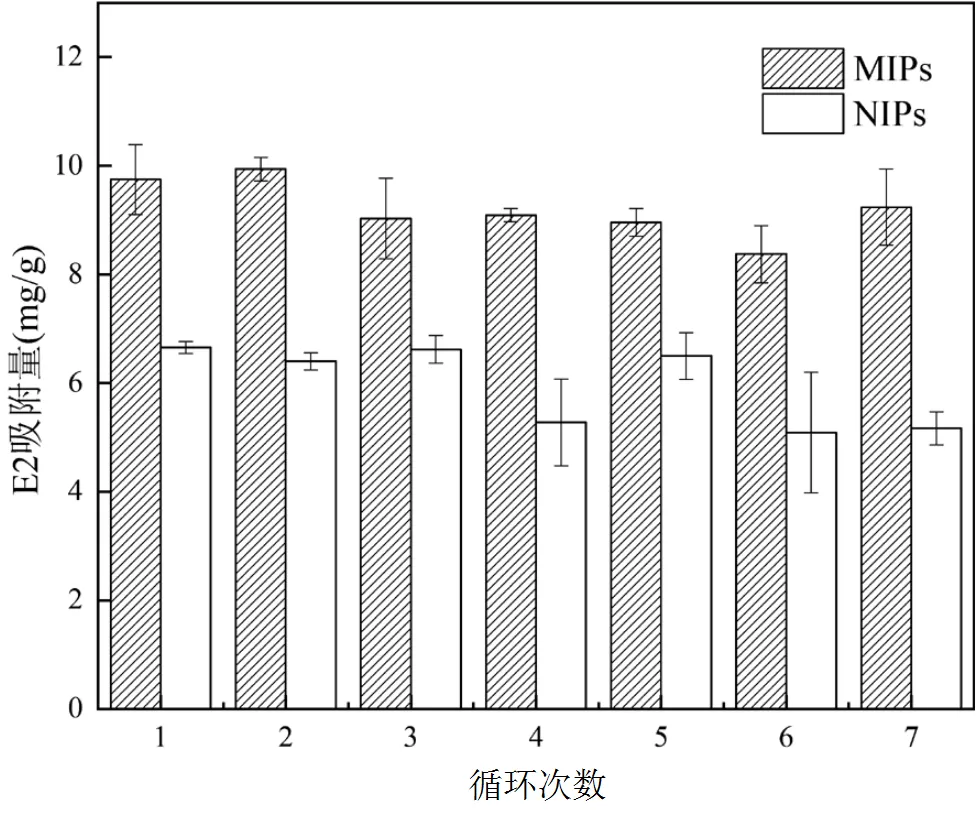
圖12 MIPs和NIPs循環使用后的吸附量
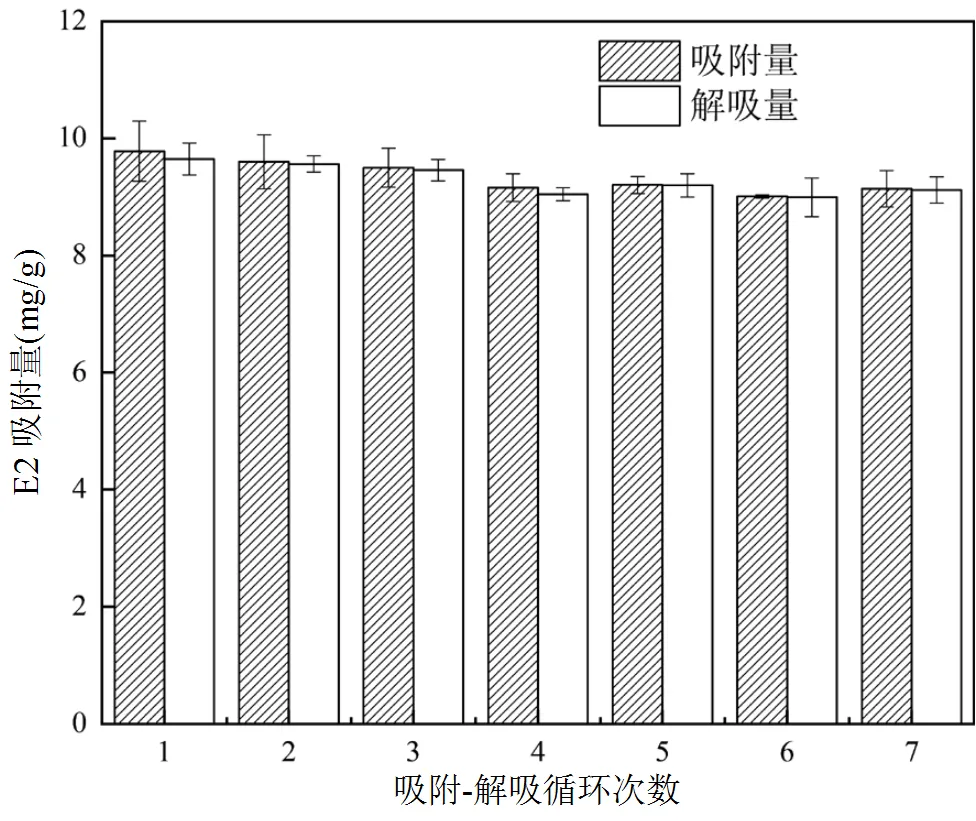
圖13 MIP的吸附和解吸量
3 結論
3.1 成功制備出Fe3O4@SiO2@MIPs,且納米材料大小均勻、形狀規則.
3.2 對MIPs進行一系列吸附試驗,得出MIPs對E2具有良好的選擇識別能力和吸附能力,MIPs和NIPs對E2的飽和吸附量分別為9.69mg/g,6.25mg/g.
3.3 MIPs具有優秀的物理化學穩定性,使用壽命長,7次吸附-解吸后吸附損失量僅為3%.
3.4 結合Fe3O4的磁性可實現印跡聚合物快速地回收再利用,有效簡化E2檢測前的預處理工作.
[1] Malekinejad H, Scherpenisse P, Bergwerff A. Naturally occurring estrogens in processed milk and in raw milk (from gestated cows) [J]. Journal of Agricultural and Food Chemistry, 2006,54(26):9785-9791.
[2] Courant F, Antignac J, Lille J, et al. Exposure assessment of prepubertal children to steroid endocrine disruptors. 2. Determination of steroid hormones in milk, egg, and meat samples [J]. Journal of Agricultural and Food Chemistry, 2008,56(9):3176-3184.
[3] Gao Q, Luo D, Bai M, et al. Rapid determination of estrogens in milk samples based on magnetite nanoparticles/polypyrrole magnetic solid-phase extraction coupled with liquid chromatography-tandem mass spectrometry [J]. Journal of Agricultural and Food Chemistry, 2011,59(16):8543-8549.
[4] Gao R, Hao Y, Zhang L, et al. Core-shell nano-sized magnetic molecularly imprinted solid phase extractant coupled with HPLC for the selective isolation and determination of 17β-estradiol in a lake water sample [J]. Analytical Methods, 2014,6(24):9791-9799.
[5] Mao Y, Zhang Y, Qu Q, et al. Cancer-associated fibroblasts induce trastuzumab resistance in HER2 positive breast cancer cells [J]. Molecular Biosystems, 2015,11(4):1029-1040.
[6] Zhen Y, Li F, Gui Y, et al. Label-free aptamer-based electrochemical impedance biosensor for 17β-estradiol [J]. Analyst, 2012,137(4):819- 822.
[7] Ze H, Li N, Yan P, et al. Imprinted monoliths: recent significant progress in analysis field [J]. Trac Trends in Analytical Chemistry, 2017,86:84-92.
[8] Gao D, Wang D, Zhang Q, et al. In vivo selective capture and rapid identification of luteolin and its metabolites in rat livers by molecularly imprinted solid-phase microextraction [J]. Journal of Agricultural and Food Chemistry, 2017,65(6):1158-1166.
[9] Zheng X, Lian Q, Yang H, et al. Surface molecularly imprinted polymer of chitosan grafted poly(methyl methacrylate) for 5- fluorouracil and controlled release [J]. Scientific Reports, 2016, 6(1):99-100.
[10] Ncube S, Kunene P, Tavengwa N T, et al. Synthesis and characterization of a molecularly imprinted polymer for the isolation of the 16US-EPA priority polycyclic aromatic hydrocarbons (PAHs) in solution [J]. Journal of Environmental Management, 2017,199:192- 200.
[11] González G P, Hernando P F, Alegria J S, et al. An optical sensor for the determination of digoxin in serum samples based on a molecularly imprinted polymer membrane [J]. Analytica Chimica Acta, 2009, 638(2):209-212.
[12] Ulbricht M, Oechel A, Lehmann C, et al. Gas-phase photoinduced graft polymerization of acrylic acid onto polyacrylonitrile ultrafiltration membranes [J]. Journal of Applied Polymer Science, 1995,55:1707-1723.
[13] Davis M E, Katz A, Ahmad W R. Rational catalyst design via imprinted nanostructured materials [J]. Chemistry of Materials, 1996, 8(8):1820-1839.
[14] Gao D, Zhang Z, Wu M, et al. A surface functional monomer-directing strategy for highly dense imprinting of TNT at surface of silica nanoparticles [J]. Journal of the American Chemical Society, 2007, 129(25):7859-7866.
[15] Xie C, Liu B, Wang Z, et al. Molecular imprinting at walls of silica nanotubes for TNT recognition [J]. Analytical Chemistry, 2008,80(2): 437-443.
[16] Zhou H, Xu Y, Tong H, et al. Direct synthesis of surface molecularly imprinted polymers based on vinyl-SiO2nanospheres for recognition of bisphenol A [J]. Journal of Applied Polymer Science, 2013,128(6): 3846-3852.
[17] Xue X, Lu R, Liu M, et al. A facile and general approach for the preparation of boronic acid-functionalized magnetic nanoparticles for the selective enrichment of glycoproteins [J]. Analyst, 2019,144(2): 641-648.
[18] 劉 冰,王德平,黃文旵,等.溶膠-凝膠法制備核殼SiO2/Fe3O4復合納米粒子的研究 [J]. 無機材料學報, 2008,23(1):33-38.
Liu B, Wang D P, Huang W C, et al. Preparation of core-shell SiO2/ Fe3O4composite nanoparticles by sol-gel method [J].Journal of Inorganic Materials, 2008,23(1):33-38.
Preparation of ferromagnetic nanomaterials based on molecular imprinting technology and their performance for selective enrichment of 17β-estradiol (E2).
GUAN An-zhe, ZHAO Xu-dong, ZHANG Ting-ting, LI Yi, LI Jian-sheng, LU Rui*
(School of Environment and Biological Engineering, Nanjing University of Science & Technology, Nanjing 210094, China)., 2022,42(1):102~108
Ferromagnetic separation and molecular imprinting technology were combined together. Ferromagnetic oxide nanoparticles were used as core, while 17β-estradiol (E2) was used as the template molecule and (3-Aminopropyl) triethoxysilane was used as the functional monomer E2 molecularly imprinted polymer (MIPs) and non-imprinted polymer (NIPs) were prepared by surface polymerization. Then E2MIPs and NIPs were characterized by FT-IR, XRD, XPS, SEM and other methods. The results showed that MIPs have a regular spherical shape, and the particle size is uniform at about 790nm. In the selective adsorption experiment, the saturated adsorption capacity of MIPs and NIPs for E2 is 9.69 and 6.25mg/g, respectively. These results indicated good selectivity of the material. Freundlich linear fitting was performed on the static adsorption data, and the results proved that MIPs have good adsorption capacity. Meanwhile, MIPs showed excellent reusability as the adsorption capacity only lost 3% after 7 adsorption-desorption processes.
molecular imprinting;magnetic nanomaterials;surface polymerization;17β-estradiol(E2)
X56
A
1000-6923(2022)01-0102-07
管安浙(1998-),男,安徽合肥人,南京理工大學碩士研究生,主要從事分子印跡及拉曼光譜研究.
2021-05-27
江蘇省自然科學基金資助項目(BK20191294);中央高校基本科研業務費專項資金資助(30919011214);環境污染控制與廢棄物資源化利用安徽省重點實驗室(2020EPC03)
* 責任作者, 副教授, rlu@njust.edu

