生物炭原位添加對養殖池塘底泥中微生物群落結構的影響
趙漢胤,陳潘毅,唐欣哲,陳以芹,李娟英*
(1.上海海洋大學海洋生態與環境學院,上海 201306;2.上海中學東校,上海 201306)
隨著養殖技術的高速發展,水產養殖已呈現出規模化、集約化等特點,但與此同時,養殖池塘的污染狀況也日漸凸顯。焦寶玉等[1]對萬灘鎮養殖池塘底泥中重金屬的污染現狀進行研究,結果表明該地區底泥中的重金屬Cr 已超《農產品安全質量無公害水產品產地環境要求》(GB/T 18407.4—2001)國家標準最高限值,存在潛在的生態風險;劉云飛等[2]對崇明島草魚池塘沉積物中多環芳烴(PAHs)的分布狀況進行調查,結果表明該沉積物中PAHs 的總含量范圍為ND~1 654.09μg·kg?1,其中4~5環PAHs對總濃度的貢獻率較高,來源分析表明沉積物中的PAHs 主要來自于生物燃燒和石油燃燒,崇明島草魚池塘整體的生態風險較低,但個別池塘存在潛在生態風險,需引起重視。本課題組先前的研究表明,我國東部地區的養殖池塘底泥普遍存在PAHs污染[3]。
目前,修復受污染養殖底泥的主要方法包括生物法、物理法和化學法。但生物修復和物理修復存在修復周期長、修復成本高等問題,因此不適用于養殖底泥的修復[4]。化學修復中的吸附固定法,因其修復成本低、效果顯著而被廣泛應用[5]。該方法將生物炭作為修復劑添加到底泥中,以達到固定污染物的目的,且已被證明效果可靠[6?7]。小麥秸稈生物炭是一種具有高污染物固定能力的生物炭,已經被廣泛用作模型生物炭用于土壤/沉積物的修復[8?9]。同時,將小麥秸稈制成生物炭,不僅可以減少傳統處理過程(堆肥或焚燒)對大氣污染的影響,也可以達到以廢治廢的目的。
通常,生物炭除了吸附固定污染物外,還可以改善植物生長[10],增加土壤陽離子交換能力[11]和土壤孔隙度[12],降低土壤密度并增強土壤通氣性[13]。已有的研究還表明,添加生物炭可以改變微生物群落組成[14?15],提高微生物的生物量[16],增加微生物的總體活性并促進有機污染物的微生物降解[17?18],從而達到修復底泥的目的。因此,本文選擇小麥秸稈生物炭,將其原位添加到養殖池塘底泥中,以底泥中的微生物作為研究對象,通過高通量測序方法,研究小麥秸稈生物炭的添加對底泥中微生物群落結構的影響,以期為養殖池塘底泥原位修復提供理論指導和科學依據。
1 材料與方法
1.1 藥品與試劑
有機溶劑二氯甲烷和乙腈均為色譜純(Sigma?Aldrich);層析硅膠和銅片等為分析純,購自國藥集團。層析硅膠650 ℃下灼燒6 h,冷卻后轉移到干燥器中保存待用;PAHs 標準物質購自Sigma?Aldrich 公司(NIST1647F),將其置于4 ℃冰箱中保存待用。
1.2 小麥秸稈生物炭特性的測定
本文所選用小麥秸稈生物炭購于河南譽中奧農業科技有限公司。生物炭的C、H、O、N、S 含量用EA有機元素分析儀(德國,Vario EL Cube)測定;小麥秸稈生物炭的比表面積采用比表面積與孔隙度分析儀(Autosorb?IQ3)測定;生物炭的表面結構特征采用六硼化鑭掃描電子顯微鏡(Vega LaB6?SEM)觀察。
1.3 養殖池塘底泥原位生物炭的添加
養殖池塘的選取:魚蝦混養養殖池塘位于上海市浦東新區書院鎮祥園路(121°50′04″E,30°58′40″N),養殖品種包括蝦類(南美白對蝦和羅氏沼蝦)和魚類(鰱、鳙、草魚、鯽魚、鳊魚),同時混有螺螄、三角帆蚌等底棲生物。這些魚蝦類生物與上海市居民水產品消費結構中的優勢品種高度吻合[19],因此該養殖池塘作為研究對象具有很強的代表性。
生物炭添加:該養殖池塘底泥含水率約為60%,濕泥密度為1.4×103kg·m?3。在該養殖池塘的清塘階段,將生物炭與實驗塘的養殖池塘表層5 cm 底泥混合,添加3%干質量比的小麥秸稈生物炭(參考本實驗室之前的研究結果[20]),即每平方米底泥中生物炭的添加量約為0.84 kg(熱解老化處理后的生物炭[21])。實驗中每個池塘面積約為104 m2(8 m×13 m),為更好地促進生物炭與底泥的混合,將每個池塘分割成10個面積約為10 m2的小塊。用瓢將事先稱好質量的生物炭均勻覆蓋在其表面,再利用鐵鏟等工具將其與表層底泥進行混合,重復多次,直至充分混勻。處理完成后,保持生物炭與底泥接觸自然老化4 周,池塘放水再接觸老化2 周后投放養殖生物。整個實驗分為實驗塘(n=3)和對照塘(n=3)兩組,在養殖池塘飼養階段對塘內水質做定期監測以保證各個池塘無明顯差異。該試驗屬于小型現場試驗,以此探究生物炭在實際原位應用時的修復效果,但此方法并不適用于大范圍修復。
1.4 底泥樣品的采集
實驗自6月放水開始持續28周,分別在實驗過程中的第1、7、14、21、28、42、56、84、112、140、168 d對實驗塘和對照塘中的底泥樣品進行取樣,在12 月份時結束整個實驗。每個養殖池塘設置3 個采樣點,在池塘的中心線上等分3 個采樣點,且每個采樣點設3 個平行,樣品用經滅菌后的竹勺裝入離心管中,置于干冰保溫箱帶回實驗室,將其保存于?80 ℃的低溫冰箱中,一部分用于提取樣品的DNA,另一部分用于測定樣品的PAHs。
1.5 底泥樣品中總DNA的提取方法
1.5.1 DNA抽提和PCR擴增
根據E.Z.N.A.?soil DNA kit(Omega Bio?tek,Nor?cross,GA,U.S.)說明書進行底泥樣品總DNA 抽提,用1%的瓊脂糖凝膠電泳檢測DNA 的提取質量,用NanoDrop2000 測定DNA 的濃度和純度;同時采用338F(5’?ACTCCTACGGGAGGCAGCAG?3′)和806R(5′?GGACTACHVGGGTWTCTAAT?3′)對16S rRNA基因V3~V4可變區進行PCR擴增,每個樣本3個重復。
1.5.2 Illumina Miseq測序
將同一樣本的PCR 產物混合后使用2%瓊脂糖凝膠回收PCR 產物,利用AxyPrep DNA Gel Extraction Kit(Axygen Biosciences,Union City,CA,USA)進行回收產物純化,2%瓊脂糖凝膠電泳檢測,并用Quantus?Fluorometer(Promega,USA)對回收產物進行檢測定量。利用Illumina 公司的Miseq PE300 平臺進行測序(上海美吉生物醫藥科技有限公司)。
1.5.3 數據處理
使用UPARSE軟件,根據97%的相似度對序列進行OTU 聚類并剔除嵌合體。利用RDP classifier 對每條序列進行物種分類注釋,比對Silva 數據庫(SSU128),設置比對閾值為70%。
1.6 底泥樣品PAHs預處理及測定
稱取3.0 g冷凍干燥的底泥樣品,過100目篩后置于微波萃取管中,加入12 mL 二氯甲烷萃取2 h,將萃取溶液移入10 mL 玻璃離心管中,再用5 mL 二氯甲烷淋洗微波管兩次。將兩次10 mL 溶液氮吹合并至2 mL 左右后過濾。用活化銅和層析柱硅膠凈化上述溶液,并用10 mL 二氯甲烷洗脫,最后將洗脫液用氮氣吹至近干,用乙腈定容至0.5 mL,待上機測定。所有PAHs 樣品用氣相色譜?質譜法(GC?MS,Agilent 7890B/5975C)測定。
1.7 質量控制與數據分析
為保證實驗結果的準確性和科學性,所有樣品設置3 個平行樣,底泥樣品中PAHs 的檢出限和回收率如表1 所示。本文圖表制作及數據分析均采用Prism 8.0和SPSS 20.0完成。
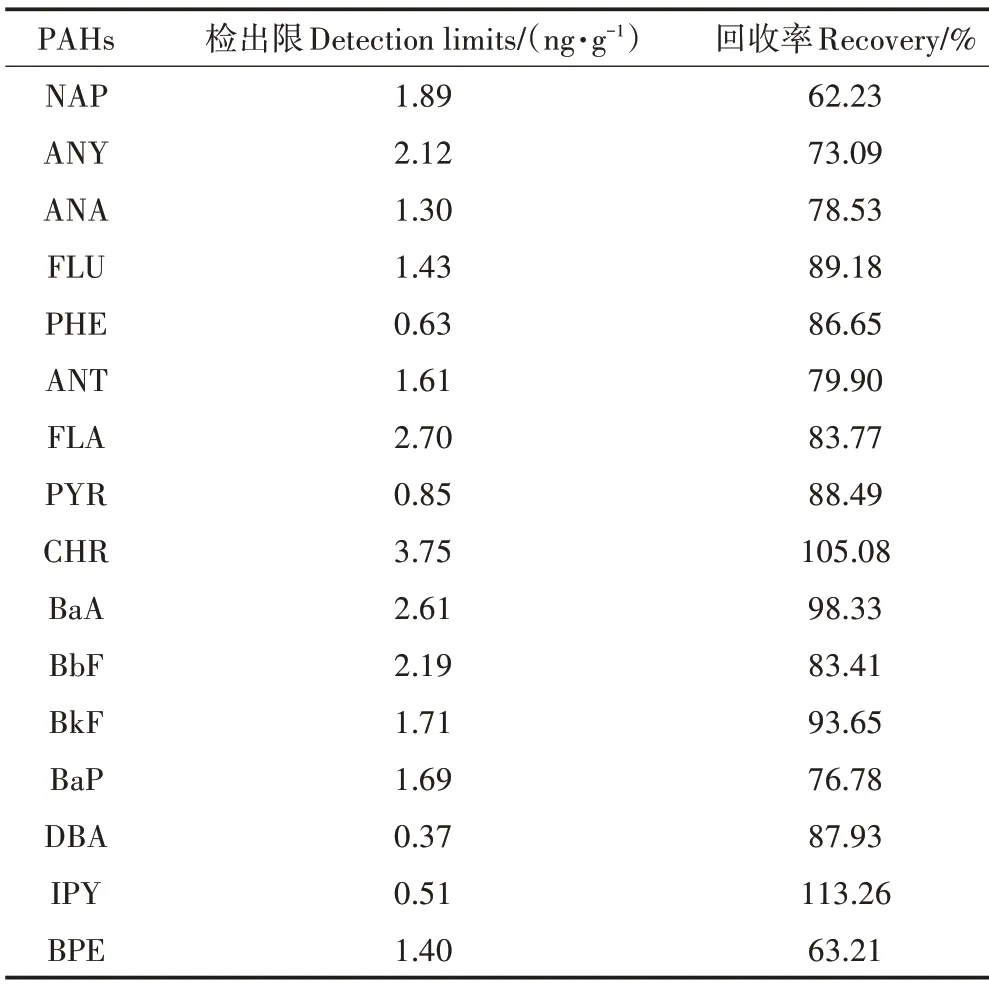
表1 底泥樣品(干質量)中PAHs的檢出限與回收率Table 1 Detection limits and recoveries of PAHs in sediment(dry weight)
2 結果與討論
2.1 待修復池塘底泥污染特征及小麥秸稈生物炭的特性
2.1.1 待修復池塘底泥污染特征
待修復池塘底泥(干質量)中∑PAHs 的濃度為396.68±3.50 ng·g?1(表2),共檢出11 種PAHs,以2、3、4 環為主,占ΣPAHs 的76%~97%。絕對性優勢的單體污染物為FLU、PHE 和PYR,其中FLU 的濃度為111.67±5.12 ng·g?1,處于LONG 等[22]提出的效應區間低值(16 ng·g?1)與效應區間中值(500 ng·g?1)之間,即已具有一定的潛在生態毒性。因此,該待修復養殖底泥具有典型污染特征,與之前本課題組對長三角區域養殖池塘底泥污染的調查結果基本一致[3]。為提高養殖水產品的質量,減小其食用的健康風險,有必要利用技術手段對養殖底泥展開修復。
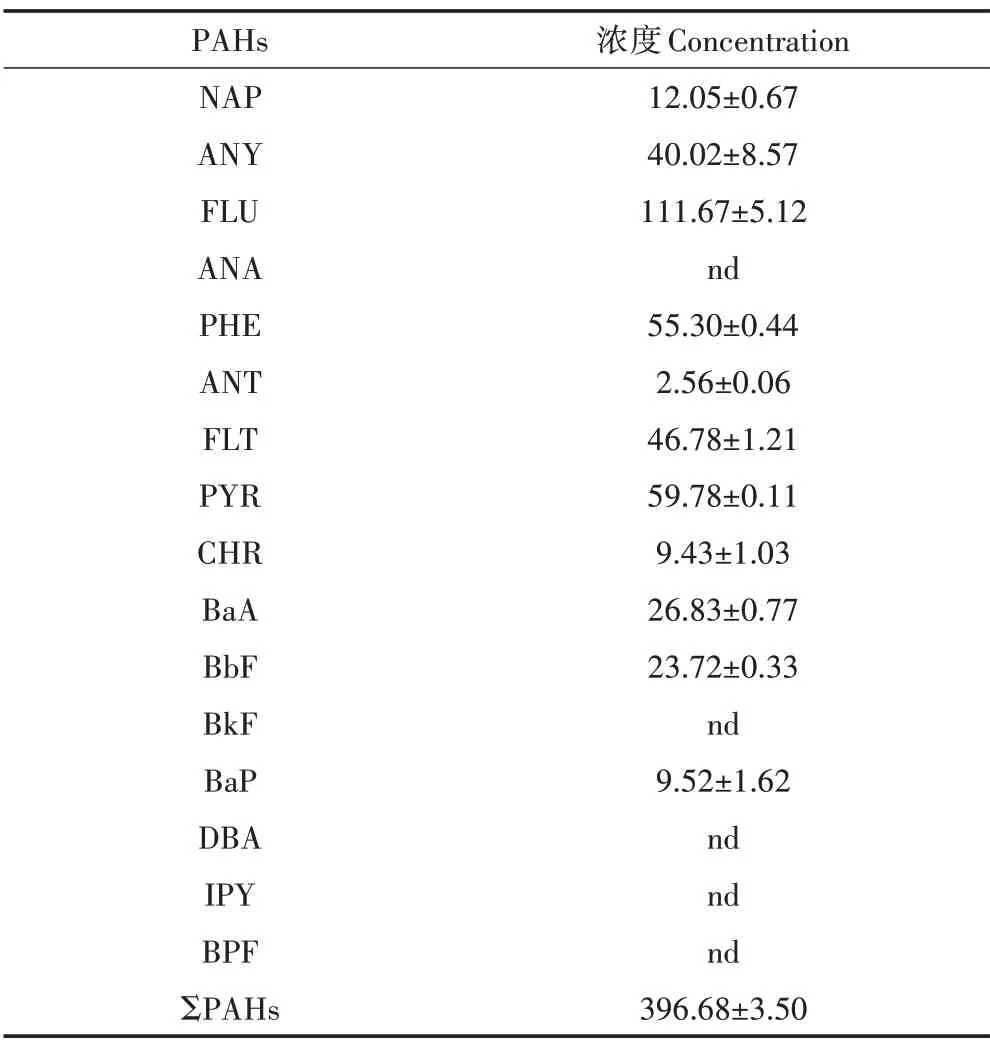
表2 養殖池塘底泥(干質量)中PAHs的濃度(ng·g?1)Table 2 Concentration of PAHs in aquaculture sediment(dry weight)(ng·g?1)
2.1.2 小麥秸稈生物炭的特征
在5μm 分辨率的掃描電鏡(SEM)下觀測小麥秸稈生物炭(圖1),其表面有很多凸起的細小顆粒,且具有大量無規則的孔隙結構。這些孔隙結構可為微生物提供更多的棲息地并成為它們的庇護所,從而有利于其生長[23]。生物炭呈堿性(表3),可以提高底泥的pH,而中性或弱堿性的土壤條件可刺激細菌的增長,增加其菌落豐度[24]。綜合而言,該小麥秸稈生物炭施用于養殖底泥有利于底泥微生物的生長。
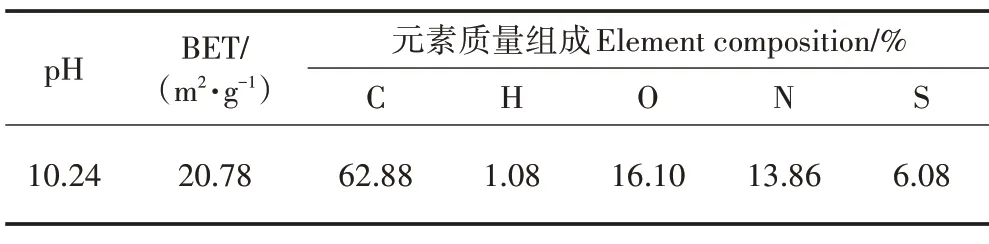
表3 小麥秸稈生物炭的基本理化性質Table 3 Physical?chemical properties of wheat straw biochar
2.2 生物炭添加對底泥中微生物群落多樣性的影響
2.2.1 底泥中細菌OTU分布
圖2 為小麥秸稈生物炭添加后,不同修復時間的底泥樣本組之間共有OTU 的花瓣圖分析。不同修復時間共有的OTU 數目為904,而特有OTU 數目存有一定差異。與第1 d 相比,小麥秸稈生物炭處理后的底泥特有OTU 數目相對增加,實驗開始時特有OTU 數僅為62,隨著修復時間的增加,改善作用明顯。除實驗第21 d和168 d時特有OTU 數目較低外(63和27),其余時間特有OTU 數目均高于原有數目。在實驗第42 d時,OTU特有數目升高到272,這可能是因為生物炭多孔的結構有利于微生物的生長發育[25]。之后特有OTU數目呈持續下降趨勢,在實驗的第168 d,特有OTU 數目降至最低的27,這可能與現場實驗中環境條件的變化有關。實驗進行到第168 d 時,正值12 月底,水溫處于10 ℃左右,微生物生長受到溫度影響而持續下降。周濤等[26]和任海偉等[27]的研究皆表明,低溫會降低微生物生長的多樣性,因此,在實驗臨近結束時出現了OTU數目的下降。
2.2.2 底泥中細菌群落Alpha多樣性
為進一步分析添加小麥秸稈生物炭對底泥微生物群落多樣性的影響,本文采用3 種方法計算了底泥細菌豐度,包括Simpson 指數、Shannon 指數以及Chao1 指數[28]。Simpson 指數是用來估算樣本中微生物多樣性的指數之一,由Edward Hugh Simpson 提出,該指數在生態學中常用來定量描述一個區域的生物多樣性。Shannon指數也是用來估算樣本中微生物多樣性的指數之一,常用于反映群落Alpha 多樣性[29]。Simpson 指數側重于對物種的均勻度,而Shannon 指數側重于物種的豐富度。Chao1 指數則反映的是群落的豐富度。
隨著現場修復實驗的持續進行,實驗組中Simpson菌群豐度指數呈現先降低后升高的趨勢(表4),說明底泥中微生物的豐度是先升高再降低的。在實驗的第42 d,底泥細菌群落的Simpson 指數達到最低(0.16),此時微生物的豐度達到最高。Shannon 多樣性指數在實驗過程中則呈現先上升后逐漸下降的趨勢,同樣是在第42 d 時達到最高值(2.34),這與Simp?son 指數反映的結果一致。這些趨勢與特有OTU 的分布相似,因為一個OTU 即代表一個分類學信息,特有OTU 越多則菌落的分類信息也越多,多樣性就越豐富。Chao1 指數代表了菌群的豐度,其數值越大,說明群落豐富度越高。Chao1 指數在實驗第21 d 時最高,說明此時底泥中微生物的多樣性最高,隨后多樣性呈逐漸下降趨勢,與其他兩個指數的變化趨勢基本一致。在臨近實驗結束的第140 d 和168 d 的Chao1 指數減小,與養殖池塘的環境溫度下降關系密切。而在對照組各項Alpha 多樣性數據中大部分均低于實驗組,表明實驗組中底泥微生物有更高的豐度和群落多樣性。同時,對照組中的各項數據均呈下降趨勢,說明隨著現場實驗的進行,對照組中底泥微生物的豐度和多樣性逐漸降低,且在實驗臨近結束時達到最低,這也是由于環境溫度的降低造成的。綜合而言,底泥中添加小麥秸稈生物炭可增加細菌群落的多樣性,這與EL?NAGGAR 等[30]添加三種不同生物炭到底泥中,均增加了微生物群落的多樣性的結論一致。
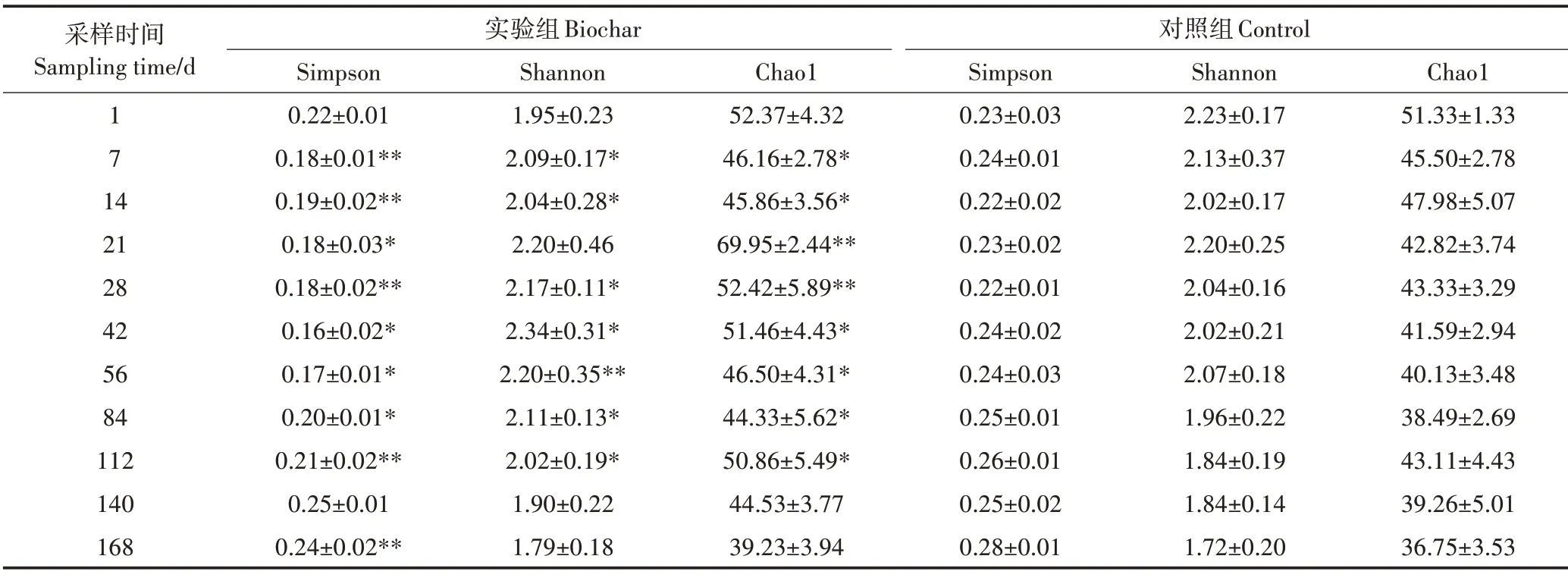
表4 底泥微生物群落的Alpha多樣性Table 4 The Alpha diversity of microbial communities in sediment
2.3 生物炭添加對底泥中微生物群落結構的影響
細菌通常以群落的形式存在,細菌群落結構主要指群落中細菌種群的種類和豐度。生物炭具有發達的多孔結構和較大的表面積,可以為細菌提供合適的生長環境[31?32]。選取每個樣本組在門水平下相對豐度大于0.01 的菌群,菌群組成的豐度分布如圖3 所示。主要涉及到的菌群包括變形菌門(Proteobacte?ria)、綠彎菌門(Chloroflexi)、放線菌門(Actinobacte?ria)、酸桿菌門(Acidobacteria)、厚壁菌門(Fir?micutes)、擬桿菌門(Bacteroidetes)、棒狀桿菌門(Rokubacteria)、硝化螺旋菌門(Nitrospirae)、芽單胞菌門(Gemmatimonadetes)、藍細菌(Cyanobacteria)、髕骨細菌門(Patescibacteria)、疣微菌門(Verrucomicro?bia)、浮霉菌門(Planctomycetes)、匿桿菌門(Latesci?bacteria)、達達菌門(Dadabacteria)和其他菌群。
隨著修復時間的增加,底泥中細菌群落的豐度也在發生緩慢的變化(圖3)。從門水平優勢細菌相對豐度來看,實驗組中變形菌門和放線菌門的相對豐度顯著提升,成為優勢菌種,而在對照組中并未觀測到這一現象。這與ZHANG 等[33]和SONG 等[34]的研究結果一致,即生物炭的添加可導致變形菌門的相對豐度提高。放線菌門則可以有效降解底泥中復雜的芳香類化合物,從而獲取更多能量用于生長繁殖,這使得修復實驗期間其在整個細菌群落中的相對豐度逐漸增加[35]。有研究也表明,變形菌門、放線菌門以及厚壁菌門在土壤的有機物降解和碳循環中起到關鍵作用,能夠降解底泥中的部分PAHs[36?38]。本課題組先前的研究表明,我國東部地區的養殖池塘底泥普遍存在PAHs 污染[3]。而本研究也同時對實驗組以及對照組底泥中的PAHs 濃度進行了分析,結果表明經小麥秸稈生物炭修復后,底泥PAHs 的含量顯著降低(圖4a),這可能是由于微生物的降解作用。生物炭對PAHs 的影響通常體現在其吸附固定能力上,其能夠減少底泥中自由溶解態PAHs 的濃度(Cfree)[20],但對底泥PAHs 的總含量并無明顯影響。而微生物可利用其自身優勢降解PAHs,使PAHs 濃度降低,這與PENG等[39]的研究結果一致。
此外,在實驗組中綠彎菌門和酸桿菌門的相對豐度顯著降低。這可能是由于不同菌落對生物炭的利用能力以及環境因素造成的,酸桿菌是嗜酸性細菌,酸性土壤環境有利于酸桿菌門的代謝活動,而生物炭作為堿性物質施入底泥可以提高底泥pH(圖4b),從而抑制了酸桿菌的生長,減少其在門水平優勢細菌中的相對豐度[40]。綜合而言,向底泥添加小麥秸稈生物炭,不僅能夠改善底泥中微生物群落結構,固定底泥中的PAHs,而且微生物可以將PAHs部分降解,從而有利于養殖池塘底泥的修復。
2.4 生物炭添加后底泥微生物相對豐度的變化和聚類分析
為進一步揭示底泥微生物的群落結構,本文選擇在屬水平上制作Heatmap圖。Heatmap圖是以顏色梯度來表征二維矩陣或表格中的數據大小,通過顏色變化來反映不同分組在各分類學水平上群落組成的相似性和差異性[41]。本文選擇相對豐度排名前20 的菌屬進行聚類分析。
生物炭的添加明顯改變了細菌屬水平上的相對豐度(圖5),其中,一些未分類的優勢菌屬在整個實驗過程中并沒有發生變化,仍為優勢菌屬,如norank_f_Steroidobacteraceae和厭氧繩菌屬(Anaerolin?eaceae)。但也有一些菌屬初始的相對豐度較低,而后逐漸變成優勢菌屬,例如大理石雕菌屬(Marmoricola)和鞘氨醇單胞菌(Sphingomonas),這可能是因為它們能夠降解土壤中的PAHs,且分解化合物產生的養分有利于自身生長[42]。其他未分類的菌屬,如Ardenticate?nales、芽單胞菌科屬(Gemmatimonadaceae)、bacteri?ap25和棒狀桿菌屬(Rokubacteriales)的相對豐度出現了先增加后降低的趨勢,原因可能是生物炭添加為這些菌屬提供了有利的生存環境,故菌種大量繁殖,但在實驗后期又受到氣溫影響,繁殖速度減弱,相對豐度降低。綜合而言,生物炭的添加能為底泥微生物提供更多生長發育空間,從而增加底泥微生物的Alpha 多樣性,改善原有的微生物群落結構,在實現底泥中有機污染物吸附固定的同時,促進底泥中部分污染物的降解。
3 結論
(1)添加小麥秸稈生物炭的修復期間,實驗組中Simpson 多樣性指數先降低后逐漸升高,說明該底泥中微生物多樣性先增多后減少,Shannon 指數與Chao1 指數以及OTU 數也表現出微生物多樣性先增后降的趨勢。對照組中的各項Alpha 多樣性指數均低于實驗組,這是由于生物炭的添加有利于微生物的生長發育,造成實驗組中底泥微生物擁有更高的豐度和多樣性。
(2)小麥秸稈生物炭處理條件下,實驗組養殖底泥細菌中變形菌門(Proteobacteria)和放線菌門(Acti?nobacteria)的相對豐度顯著提高,而酸桿菌門(Acido?bacteria)和綠彎菌門(Chloroflexi)的相對豐度降低,這表明生物炭的添加可改變底泥微生物的群落結構,且有利于修復受PAHs 污染的養殖底泥,因為這些細菌能夠降解部分的PAHs化合物。
(3)Heatmap 圖顯示,生物炭的添加使菌屬豐度增加,有助于降解養殖底泥中的有機污染物。