貝萊斯芽孢桿菌對甜櫻桃軟腐病生防效果的研究
郗良卿,吳 澎*,李睿琪
(1.山東農業大學食品科學與工程學院,山東泰安 271000;2.山東農業大學動物科學與技術學院,山東泰安 271000)
甜櫻桃為薔薇科李屬木本植物,原產歐洲[1],在我國引種食用已有100 多年的歷史。櫻桃品種繁多[2],在我國種植廣泛,分布于山東、新疆、河北等地[3],且產量居世界第一位[4]。甜櫻桃果實呈球形[5],皮薄光澤[6],肉質柔軟,多汁味酸甜,可直接食用[7],具有抗癌、預防心腦血管疾病等功效,被譽為“生命之果”[8]。甜櫻桃富含多種營養素[9],有益于人體健康[10],且有抗氧化和保健功效,大量研究發現它們具有顯著的藥理作用[11]。
在甜櫻桃種植過程中,病害是影響其產量和品質的主要原因[12],包括非侵染性病害和侵染性病害[13]。非侵染性病害主要由凍害及缺素[14]所致;侵染性病害主要包括病毒性病害,穿孔病、根癌病等細菌性病害[15]以及軟腐病、根腐病、褐腐病、青霉病、灰霉病等真菌性病害[16]。導致甜櫻桃發生真菌性病害的病原菌[17]主要有擴展青霉菌(Penicillium expansum)[18]、美澳型核果褐腐病菌(Monilinia fructicola)[19]、葡萄孢霉菌(Botrytis cinerea)[20]、根霉菌(Rhizopussp.)[21]、毛霉菌(Mucorsp.)[22]、鏈格孢霉(Alternaria alternata)[23]及炭疽菌(Colletotrichumsp.)[24]、黑曲霉(Aspergillus niger)[25]等。軟腐病為櫻桃的常見病,主要發生在運輸、銷售及在樹上成熟過度的果實上,匍枝根霉(Rhizopus stolonifer)[26]是導致軟腐病的病原菌之一,該病發病迅速,果實感染2~3 d 后,被感染的果實發生變軟和水樣[27],釋放出帶有發酵或酸性的氣味[28]。
生產上對甜櫻桃軟腐病等真菌性病害的防治大多采用化學藥劑,但其降解性差,易造成環境污染,不利于我國農業的綠色可持續發展[29];且長期單一的使用同類化學藥劑,易使抗體藥性問題凸顯[30],而通過微生物拮抗作用[31]來控制軟腐病,毒性低,藥物殘留少,是保障食品安全的有效措施。在甜櫻桃采后保鮮[32]的拮抗微生物中,國內已報道的主要有羅倫隱球酵母(Cryptococcus laurentii)[33]、芽孢桿菌屬(Bacillusspp.)[34]等外源拮抗菌株。芽孢桿菌是應用最為廣泛的生防菌,具有抗逆性強、生物安全性好等優點。通過櫻桃體內的貝萊斯芽孢桿菌(B.velezensis)[35],產生具有抗菌性的代謝物質,與匍枝根霉競爭生活空間和營養物質并大量繁殖,使匍枝根霉得不到充足的營養物質,抑制其生長,從而抑制軟腐病的發生[36];并且貝萊斯芽孢桿菌有一定的促生效果[37],有利于櫻桃果實的發育。目前對于櫻桃軟腐病具體生物防治措施的研究較少,且對貝萊斯芽孢桿菌拮抗作用的報道也不多,研究貝萊斯芽孢桿菌拮抗菌的拮抗作用,以便采取生物措施對甜櫻桃軟腐病進行防治,是一條安全、有效的防治途徑[38]。本文分析了貝萊斯芽孢桿菌對導致甜櫻桃軟腐病的匍枝根霉(Rhizopus stolonifer)的拮抗作用,并運用活體實驗驗證了貝萊斯芽孢桿菌對匍枝根霉的抑菌效果,為解決當前甜櫻桃的軟腐病問題,以及甜櫻桃的采后保鮮防腐技術提供理論依據。
1 材料與方法
1.1 材料與試劑
甜櫻桃:2019 年6 月自山東省果樹研究所天平湖基地(泰安)采集無病害、無畸形、個體大小均等的‘美早’甜櫻桃。
肉膏蛋白胨培養基(LB):蛋白胨10 g,酵母膏5 g,氯化鈉10 g,瓊脂20 g,水1 000 mL,pH=7,在大氣壓0.1~0.15 MPa 下,121 ℃滅菌20 min。NB 培養基:蛋白胨10.0 g、酵母膏5.0 g、氯化鈉10.0 g,蒸餾水1 000 mL,pH 調至7.0~7.3。
試劑:無水乙醇、乙酸異戊酯、氯化鈉,天津市凱通化學試劑有限公司,分析純;蛋白胨、酵母膏,生化試劑,北京奧博星生物有限公司。
1.2 儀器與設備
電熱恒溫恒濕生化培養箱,303-00A 型,天津賽得利斯實驗分儀器制造廠;高壓蒸汽滅菌鍋,XFC-100CA 型,浙江新豐醫療器械有限公司;熒光顯微鏡,XSP-63A 型,上海光學儀器一廠;電泳儀,HT-300,北京市六一儀器有限公司;PCR 儀,MA-6000 型,德國Biometra 公司;全自動凝膠成像分析系統,ChamlGel6000 型,北京賽智創業科技有限公司;掃描電鏡,JCM-7000 型,蘇州沃弗本精密機械有限責任公司;渦旋振蕩器,QL-901 型,海門市其林貝爾儀器制造有限公司。
1.3 試驗方法
1.3.1 拮抗菌發酵條件的優化
(1)生長曲線的繪制
將菌株的活化液分別接種在LB 液體培養基中,30℃、180 r/min 搖床培養。于接種后的第0、2、4、6、8、10、12、14、16、18、20、24、26 h 取菌液于1 cm 比色杯,利用分光光度計測定600 nm 處的吸光度,以未接種的LB 液體培養基為空白,3 個平行,繪制菌株的生長曲線。
(2)發酵液抑菌溫度的優化
取拮抗菌種子培養液,2%接種量接種,分別于25、30、37 ℃下180 r/min 振蕩培養72 h,以病原菌為指示菌,采用平板對峙法測定菌液的抑菌率。每個梯度設置3 個平行。
(3)發酵液抑菌時間的優化
取拮抗菌種子培養液,2%接種量接種,在37 ℃下180 r/min 振蕩培養,發酵時間分別為24、48、72、96、120 h,以病原菌為指示菌,采用平板對峙法測定菌液的抑菌率。每個梯度設置3 個平行。
(4)發酵液抑菌pH 的優化
取拮抗菌種子培養液,按2%接種量接種到pH 值分別為5、6、7、8、9 的菌液中,在37 ℃下180 r/min 振蕩培養,發酵96 h,以病原菌為指示菌,采用平板對峙法測定菌液的抑菌率。每個梯度設置3 個平行。
1.3.2 拮抗菌體內驗證試驗
(1)3 種拮抗菌處理液拮抗效果的篩選
大小一致、成熟度均一的甜櫻桃果實經100 mg/L 次氯酸鈉消毒2 min,自然晾干后,用接種針在赤道部位刺3 mm×3 mm×3 mm 傷口。用移液槍吸取20 μL 不同處理液接種至果實傷口部位,每個處理組30 顆果實,設3組平行。處理液如下:A 發酵液(拮抗菌在最佳發酵條件下獲得)、B 菌懸液(發酵液經12 000 r/min 離心10 min取菌體,加無菌水獲得)、C 上清液(發酵液經12 000 r/min 離心10 min 取上清液),4 h 后每個處理組接種10 μL 濃度為104CFU/mL 的病原孢子懸浮液,以無菌水為對照,然后將果實自然風干,并放入塑料托盤中,該托盤用高密度聚乙烯套筒包裹,以保持高濕度。28 ℃下每12 h觀察發病情況,并測量病斑直徑。
(2)拮抗菌處理液濃度的篩選
配置109、108、107、106CFU/mL 拮抗菌菌懸液,甜櫻桃果實經100 mg/L 次氯酸鈉消毒2 min,自然晾干后,用接種針在赤道部位刺3 mm×3 mm×3 mm 傷口,移液槍吸取20 μL 不同濃度菌懸液,4 h 后分別接種10 μL 濃度為104CFU/mL 的病原孢子懸浮液,以無菌水為對照,果實自然風干,并放入塑料托盤中,該托盤用高密度聚乙烯套筒包裹,以保持高濕度。28 ℃下每12 h 觀察發病情況,并測量病斑直徑。
(3)有傷接種
將果實用4×10-5mol/L 二氧化氯消毒2 min,用無菌水沖洗兩次,自然晾干,用滅菌的黃槍頭在果實赤道部位插3 mm×3 mm×3 mm 左右的傷口。
試驗共設5 個處理組,每個處理組100 顆果實。處理如下:
CK(果實+病原菌):接種10 μL 濃度為104CFU/mL的病原菌孢懸液。
處理1(果實+109CFU/mL 發酵液+病原菌):先接種20 μL、109CFU/mL 發酵液,在無菌環境下固定4 h 后,再接10 μL、104CFU/mL 的病原菌孢子懸浮液。
處理2(果實+稀釋5 倍的109CFU/mL 發酵液+病原菌):先接種20 μL 稀釋5 倍的108CFU/mL 發酵液,在無菌環境下固定4 h 后,再接10 μL、104CFU/mL 的病原菌孢子懸浮液。
處理3(果實+108CFU/mL 發酵液+病原菌):先接種20 μL、108CFU/mL 發酵液,在無菌環境下固定4 h 后,再接10 μL、104CFU/mL 的病原菌孢子懸浮液。
處理4(果實+納他霉素+病原菌):先接種10 μL、104CFU/mL 的病原菌孢子懸浮液,再接種20 μL 的納他霉素溶液。
每12 h 觀察記錄病斑直徑、腐敗率和病情指數。病斑直徑用游標卡尺測量。

表1 病情指數分級標準Table 1 Classification criteria of disease index
腐敗率和病情指數公式見式(1)(2)[38-39]。

1.3.3 貝萊斯芽孢桿菌與病原菌相互作用
(1)貝萊斯芽孢桿菌與病原菌體外相互作用
將拮抗菌和病原菌進行平板對峙,28 ℃恒溫培養60 h,用無菌牙簽挑取抑菌圈周圍的菌絲置于小玻璃瓶中,將其標號為處理組,正常生長培養的病原菌菌絲作為對照組,兩組均用2.5%戊二醛溶液4 ℃固定24 h,依次放入不同濃度(45%、55%、65%、75%、85%、95%、100%)的乙醇各脫水20 min,采用臨界點干燥法進行樣品干燥,噴金處理。在掃描電鏡下觀察并進行拍照。
(2)貝萊斯芽孢桿菌與病原菌體內相互作用
用滅過菌的接種針在櫻桃赤道部位上刺一個3 mm×3 mm×3 mm 的傷口。立即接種20 μL 濃度為104CFU/mL 的拮抗菌。4 h 以后再接種10 μL 濃度為104CFU/mL 的病原菌,裝入聚乙烯袋中以保持95%左右的濕度。
處理24 h 以后,切下1~2 mm2的傷口組織,立即轉移到FAA 固定液(50%乙醇89 mL,冰乙酸6 mL,甲醛5 mL),固定至少4 h。在固定液中的材料,依次經過95%無水乙醇、100%無水乙醇、75%無水乙醇+25%乙酸異戊酯、50%無水乙醇+50%乙酸異戊酯、25%無水乙醇+75%乙酸異戊酯、100%乙酸異戊酯系列脫水,每級15 min。干燥的材料在解剖鏡下用雙面膠帶粘在金屬臺上,用離子濺射儀上對金屬臺進行噴金鍍膜。采用掃描電鏡進行掃描。
1.4 數據處理
試驗數據用Excel 2013 與Origin 2021 軟件進行計算和作圖,SPSS 軟件進行方差分析和顯著性分析。試驗數據用“平均值±標準差”表示。
2 結果與分析
2.1 拮抗菌的生長曲線
圖1 顯示了貝萊斯芽孢桿菌的生長曲線,由圖知,貝萊斯芽孢桿菌在4 h 時進入對數生長期,此時菌體生長速率最快,代謝旺盛;12 h 時進入穩定生長期,此時總菌落數最大,代謝物質積累最多,重要的次級代謝產物產生較多;當生長到18 h 之后菌體濁度開始降低,細胞出現凋亡。
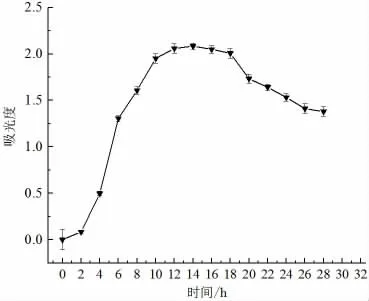
圖1 拮抗菌貝萊斯芽孢桿菌的生長曲線Fig.1 Antagonistic bacteria growth curve of B. velezensis
2.2 貝萊斯芽孢桿菌發酵條件的優化
2.2.1 貝萊斯芽孢桿菌的菌懸液、發酵液、發酵上清液對病原菌的抑制效果
通過對不同處理組病斑直徑的測定發現,拮抗菌貝萊斯芽孢桿菌的菌懸液、發酵液和發酵上清液對病原菌的抑制效果不同(見表2)。菌懸液與對照組無顯著性差異,對軟腐病病原菌抑菌效果不明顯,而發酵液和發酵上清液抑菌效果顯著(P<0.05),抑菌率達到(69.82±1.43)%和(59.14±0.85)%。
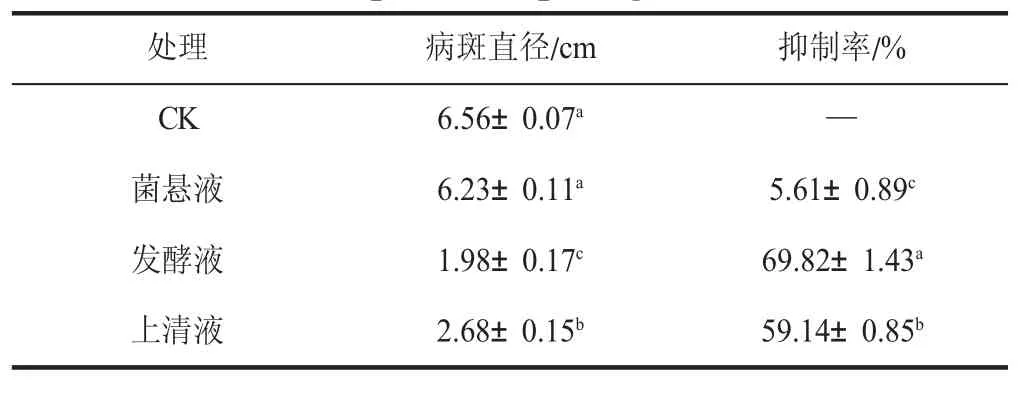
表2 貝萊斯芽孢桿菌的菌懸液、發酵液、發酵上清液對病原菌的抑制效果Table 2 The effect of B. velezensis strain of the bacterial suspension,the fermentation broth,the fermentation supernatant pathogen
2.2.2 貝萊斯芽孢桿菌發酵液抑菌溫度的優化
拮抗細菌培養溫度影響其代謝產物的積累和利用,溫度過低影響細菌生長,使發酵效率降低,溫度過高則會導致體內酶失活,細菌衰亡。因此適合的溫度可以使細菌快速增長,提升代謝產物的積累[1-2]。由圖2 可知,貝萊斯芽孢桿菌菌株在37 ℃下抑菌效果最好,抑菌率達到58.22%,30 ℃次之,25 ℃最低;且3 個處理組呈差異顯著(P<0.05),因此37 ℃是菌株貝萊斯芽孢桿菌產生抑菌物質的最佳發酵溫度。
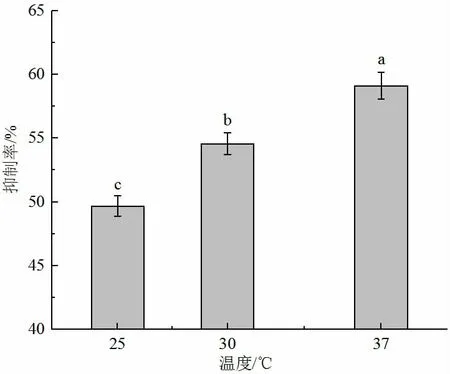
圖2 發酵液抑菌溫度的優化Fig.2 Optimization of fermentation temperature conditions
2.2.3 貝萊斯芽孢桿菌發酵液抑菌時間的優化
如圖3 所示,菌株貝萊斯芽孢桿菌在不同的發酵時間下抑菌效果不同,拮抗物質的產量總體呈現先上升后下降的趨勢,在0~96 h 抑菌物質逐漸積累,在96 h 抑菌效果最好,抑菌率為62.98%,且96 h 與其他處理時間成顯著性差異(P<0.05),在120 h 抑菌率下降,說明抑菌物質不能長時間保持活性,因此96 h 為菌株貝萊斯芽孢桿菌產生抑菌物質的最佳發酵時間。
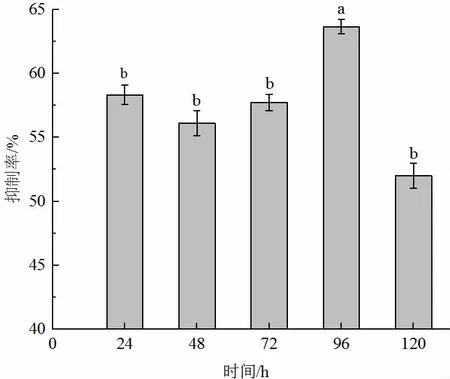
圖3 發酵時間的優化Fig.3 Optimization of fermentation time
2.2.4 貝萊斯芽孢桿菌發酵液抑菌pH 的優化
發酵培養基pH 對菌體的生長及代謝產物的產生有較大的影響[3-5]。如圖4 所示,菌株貝萊斯芽孢桿菌在酸性和堿性條件下的抑菌效果均不如中性條件下的,pH 6.5時菌株貝萊斯芽孢桿菌的抑制效果最佳,抑制率為63.33%,與其他處理組均呈顯著性差異(P<0.05),因此,pH 6.5 是菌株貝萊斯芽孢桿菌產生抑菌物質的最佳pH。綜上所述,在發酵溫度37 ℃、發酵pH 6.5 及發酵時間96 h 的條件下,貝萊斯芽孢桿菌對匍枝根霉的抑制效果最好,對甜櫻桃軟腐病有較好的抑制作用。
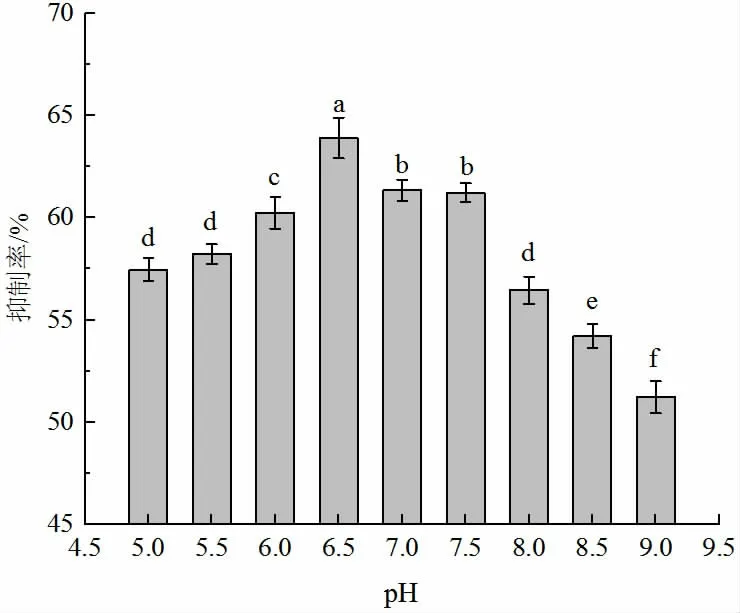
圖4 發酵pH 的優化Fig.4 Optimization of fermentation pH
2.3 貝萊斯芽孢桿菌體內驗證試驗
2.3.1 不同拮抗菌處理液的抑菌效果
如圖5(見下頁)所示,菌懸液、發酵液及上清液對軟腐病都有一定的抑制作用,其中發酵液處理組病斑直徑和腐敗率均較小,抑制效果較好,上清液效果較差。在28℃培養48 h 后,水處理組和NB 培養基處理組均已全部發病,病斑直徑分別為(23.54±1.56)mm 和(22.87±1.24)mm,而此時發酵液處理組的腐敗率僅20.58%,病斑直徑(6.77±1.41)mm,與其他處理組均呈顯著性差異(P<0.05)。菌懸液處理組和發酵上清液處理組對軟腐病的腐敗率和病斑直徑差異不顯著(P<0.05)。因此選用拮抗菌貝萊斯芽孢桿菌發酵液用于后續實驗。

圖5 不同處理對甜櫻桃腐敗率和病斑直徑的影響Fig.5 Effects of different treatments on the rot rate and lesion diameter of sweet cherry
2.3.2 拮抗菌發酵液濃度的篩選
由圖6 可以看出,不同濃度的貝萊斯芽孢桿菌發酵液對甜櫻桃軟腐病的抑制效果不同,隨著濃度的變化,抑制作用顯著變化。處理組A(果實+病原菌+1×109CFU/mL 發酵液)的抑制效果最好,軟腐病的腐敗率僅為20.58%,病斑直徑為(6.77±1.41)mm,且與其他處理組均成顯著性差異(P<0.05)。此時CK 處理組發病率已達100%。隨著發酵液濃度的降低,對軟腐病效果越弱。當菌懸液濃度為1×107CFU/mL,抑制效果不顯著。因此拮抗菌發酵液的最佳抑菌濃度為1×109CFU/mL。
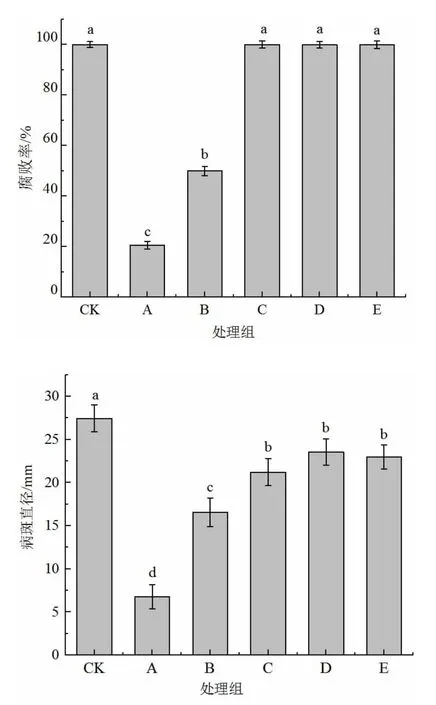
圖6 不同濃度的拮抗菌發酵液對甜櫻桃腐敗率和病斑直徑的影響Fig.6 Effects of different concentrations of antagonistic fermentation broth on the rot rate and lesion diameter of sweet cherry
2.3.3 拮抗菌發酵液對甜櫻桃果實的抑菌效果
由圖7 可以看出,圖7A、B 為甜櫻桃處理組在28 ℃放置24 h 和48 h 的結果。由圖可知,當24 h 時,各處理組均無腐敗現象。在48 h 時,對照組(果實+病原菌)完全腐敗,處理組1~3(果實+發酵液+病原菌)和處理4(果實+納他霉素+病原菌)腐敗不明顯。

圖7 甜櫻桃不同時間的腐敗情況Fig.7 Spoilage of sweet cherry at different time
圖8 是接種病原菌12、24、36、48 h 后調查的果實發病率和病斑直徑。結果發現,貝萊斯芽孢桿菌對采后甜櫻桃軟腐病具有一定的防治效果。在36 h 時,CK 組(果實+病原菌)開始發病,腐敗率達到88.75%,處理2(果實+稀釋5 倍的109CFU/mL 發酵液+病原菌)和處理3(果實+108CFU/mL 發酵液+病原菌)腐敗率達到6.25%和10%,處理1(果實+109CFU/mL 發酵液+病原菌)和處理4(果實+納他霉素+病原菌)均未發病。在48 h 時,所有處理組均有果實發病,CK 組腐敗率達到100%,處理2 和處理3 的腐敗率分別達到50%、55.07%。其中處理1 腐敗率最低,僅20.58%,防治效果能達到79.42%。在48 h 的貯藏期間,4 個處理組的病斑直徑均有所降低,其中處理1 效果更佳,差異顯著性均有所降低。
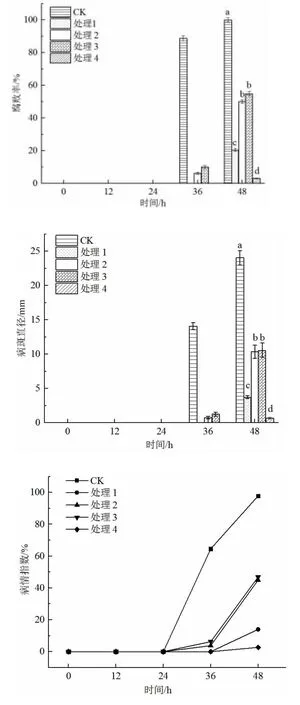
圖8 不同處理對甜櫻桃腐敗率、病斑直徑及病情指數的影響Fig.8 Effects of different treatments on the decay rate,lesion diameter and disease index of sweet cherry
從病情指數看,36 h 時CK 組病情指數較大,達到64.58%,處理2(果實+稀釋5 倍的109CFU/mL 發酵液+病原菌)和處理3(果實+108CFU/mL 發酵液+病原菌)病情指數為3.75%和6.25%,處理1 和處理4 的病情指數為0;在48 h 時,CK 組病情指數較大,達到97.82%,處理2 和處理3 的病情指數為44.93%和46.87%,處理1 和處理4 的病情指數為13.97%和2.69%。
2.4 貝萊斯芽孢桿菌與病原菌的相互作用
2.4.1 貝萊斯芽孢桿菌與病原菌體外相互作用
從圖9 可以看出,對照組和處理組菌絲微觀結構上有較大不同。由圖A 和D 可知,對照組(A)菌絲較長,孢子囊柄直立,不分枝;處理組(D)孢子囊柄斷裂;由圖B和E 可知,對照組(B)孢子囊健康飽滿,呈近球形,有疣狀突起;處理組(E)孢子囊呈畸形并伴有表面凹陷、褶皺、粗糙、不平整現象。由圖C 和F 可知,對照組(C)表面有黑色點狀物質,表面不光滑;處理組(F)有裂痕產生。由此可見,拮抗菌能夠破壞病原菌的菌絲結構,從而殺死病原菌。

圖9 病原菌菌絲受拮抗菌發酵液處理后的掃描電鏡Fig.9 Scanning electron microscope of pathogenic mycelium after treatment with antagonistic antibacterial fermentation broth
2.4.2 貝萊斯芽孢桿菌與病原菌體內相互作用
貝萊斯芽孢桿菌與病原菌RF 在甜櫻桃傷口處共同培養36 h 以后,采用掃描電鏡(SEM)觀察,如圖10 所示,由圖知,圖A 和圖B 顯示對照組病原菌在甜櫻桃傷口處大量繁殖,產生菌絲,造成果實腐敗;圖C 和圖D 顯示處理組拮貝萊斯芽孢桿菌在甜櫻桃果實傷口部位迅速繁殖,與病原菌進行營養和空間競爭,并且可以觀察出病原菌菌絲體聚集著很多拮抗菌,同時拮抗菌貝萊斯芽孢桿菌能夠緊密地吸附在病原菌RF 的菌絲體上。
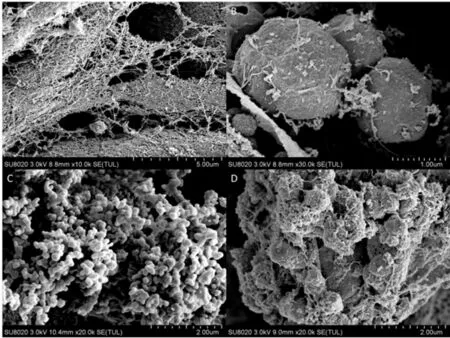
圖10 果實經拮抗菌處理后的掃描電鏡Fig.10 Scanning electron microscope of fruits after antagonistic treatment
3 結論與討論
軟腐病是一種在貯藏期危害最嚴重的病害,發病迅速且難于防治[40],因此對于此病的研究較少。雖然該病在多個國家被相繼報道,但是具體的防治措施以及引起該病的主要病原菌方面還存在爭議[41]。本實驗研究了拮抗菌貝萊斯芽孢桿菌對軟腐病病原菌的拮抗作用,結果發現其有一定的抑菌效果,對軟腐病也有較好的防治作用,為甜櫻桃的防腐保鮮研究提供了新方向。
生防菌株的研發與應用對防治果蔬微生物病害具有重要意義。用來抑制甜櫻桃軟腐病的生防菌株為貝萊斯芽孢桿菌(B.velezensis)[42]。貝萊斯芽孢桿菌用于生防抑制真菌腐敗已有較多研究,如楊勝清等[43]研究表明貝萊斯芽孢桿菌的粗蛋白提取液對番茄早疫病菌(Alternaria solani)具有明顯的抑制效果;王雨等[44]研究表明貝萊斯芽孢桿菌HN-2 的主要活性物質為脂肽類物質,其對植物病原真菌有較好的防治效果;孫旺旺等[45]發現貝萊斯芽孢桿菌是一株對生菜軟腐病和菌核病具有拮抗作用的潛在生防菌;譚崢等[46]發現萊斯芽胞桿菌HN-2正丁醇提取物具有開發成為生物源農藥的潛力。
貝萊斯芽孢桿菌具有生長快、易培養、抗逆、抑菌等特點,在自然界廣泛分布,絕大多數菌株對人畜無害且不會污染環境,是開發生防菌的主要來源之一[47]。在本實驗的貝萊斯芽孢桿菌發酵液抑菌條件的優化中,得出發酵溫度37 ℃、發酵pH 6.5 及發酵時間96 h 的條件下,對引起甜櫻桃軟腐病的匍枝根霉有較好的抑菌效果。目前對于櫻桃軟腐病的防治措施多為化學藥劑防治,如櫻桃樹發芽前噴3~5°Be 石硫合劑,初花期、落花后噴灑47%加瑞農可濕性粉劑700 倍液、53.8%可殺得干懸浮劑1 000 倍液、12%松酯酸銅乳油600 倍液、50%百菌清可濕性粉劑700 倍液或25%多菌靈可濕性粉劑800 倍液[48]等,這些方法不僅污染環境,有藥劑殘留,且防治效果也在逐年降低[49]。本實驗采用的貝萊斯芽孢桿菌抗逆性強,生物安全性好,比化學防治更安全,防治效果和抑菌效果更好,并且具有促生作用,比其他的拮抗菌更有利于甜櫻桃的生長[50]。
在研究貝萊斯芽孢桿菌與病原菌RF 的相互作用時,體外實驗中,通過掃描電鏡(SEM)得出拮抗菌處理會導致病原菌菌絲破裂,孢子囊發生畸形和凹陷;體內實驗中,通過掃描電鏡(SEM)得出拮抗菌會在傷口部位大量繁殖,緊緊依附病原菌菌絲,可能是營養與空間競爭作用,起到抑菌效果。
總之,拮抗菌貝萊斯芽孢桿菌,對匍枝根霉有較好的抑菌效果,對甜櫻桃軟腐病的防治效果能達到79.42%,有較明顯的拮抗作用,為甜櫻桃軟腐病的生物防治提供了理論依據。由相關實驗得知[51],拮抗菌貝萊斯芽孢桿菌產生的抑菌物質初步判斷為蛋白類,但是具體抑菌物質和作用機制仍未可知,后續本實驗室將繼續研究抑菌成分和作用機制,為貝萊斯芽孢桿菌的生防利用奠定基礎。

