可降解生物壓電復合材料在骨組織工程中的研究進展*
代香林,姚喜軍,張文鳳,商佳琪,鄧久鵬
( 華北理工大學口腔醫學院,唐山 063000)
1 引 言
生理電位在維持骨體積和骨質量方面起著重要作用[1]。近年來,多種骨組織工程生物材料的設計中強調了模擬內源性電勢予以細胞適當電刺激,從而促進骨再生這一概念。因此,學者們對恢復生理電位的骨組織再生材料進行了廣泛的研究。生物壓電材料的出現使此概念的應用變為可能。聚L—乳酸作為一種優良的可降解生物壓電材料,其與壓電陶瓷鈦酸鋇復合,以期制備出一種可降解生物壓電材料應用于組織工程的研究中。
2 電刺激對骨再生的意義
骨骼是較早研究的天然壓電材料,在骨的塑形過程中生物電現象起重要作用[1-3]。研究表明,在骨折處施加電壓后可以形成負電荷積累,而累積的負電荷有利于骨折的愈合[2,4]。也可以通過植入電極等方法來施加電壓從而使骨折處電荷累積,但該方法在臨床治療過程中不便于應用,且難以保證穩定有效的電刺激[2]。
電刺激(electrical stimulation,ES)在干細胞的遷移、增殖、分化和支架的粘附等方面均有積極的作用,可作為骨組織工程治療的輔助手段。Eischen-Loges等[5]用電刺激預處理間充質干細胞,觀察到電刺激產生持續的長效促成骨作用,并證實了電刺激帶來的積極的成骨效果,確定了促成骨效果的最佳電刺激方案。Fonseca Junior等[6]評估了低強度電流對顱骨缺損的牛骨移植物的影響,發現了電刺激對移植物的血管生成和膠原組織作用更明顯,證明了微電流有利于移植物的生長并可改善骨缺損移植的骨傳導性。
近年來,電刺激促進骨再生的能力已經在臨床研究中得到證實,但其作用機理仍在研究和探討中。Srirussamee等[7]探討了巨噬細胞和前成骨細胞對電刺激及電刺激產生的法拉第副產物的反應,結果證實了法拉第副產物可部分增強巨噬細胞Spp1的表達,從而得出了巨噬細胞可以對電刺激作出反應并可能與前成骨細胞一起參與骨形成。
3 生物壓電材料
生物壓電材料是一種電活性生物材料,其具備一定的生物相容性及良好的電刺激傳導能力,可以模擬骨組織的生理和微電環境,從而促進骨的再生和重建[8-10]。壓電類生物材料無需外加電源就能增強生理電環境刺激,在20世紀80年代就被用于修復骨組織缺損。近年來壓電材料的研究熱度逐漸上升,顯示出其在生物醫學研究中的應用潛力。
壓電材料能夠轉換機械能和電能,在外加應力電信號刺激下產生電刺激信號通路,促進成骨細胞的增殖和分化,從而促進受損部位的組織再生。此概念推動了壓電植入物用于骨再生領域的發展[1-13]。Wang等[14]制備了一種自供電的可調節電刺激系統來輔助前成骨細胞的增殖,并研究了靜電紡絲和不同后處理(退火和極化)對壓電納米纖維膜表面潤濕性、壓電β相、鐵電性能和傳感性能的影響。
壓電材料可分為無機壓電材料、有機壓電材料和復合壓電材料。在各種壓電生物材料中,壓電生物陶瓷(如鈦酸鋇、鈮酸鈉鉀、鋰鈮酸鉀鈉,氧化鋅等)與壓電生物聚合物類(包括聚偏氟乙烯及其共聚物、聚L—乳酸及其共聚物、聚羥基丁酸及其共聚物等)被證明有潛力成為未來的壓電人工植入物[10]。
3.1 無機壓電材料
無機壓電材料包括壓電晶體和壓電陶瓷。壓電晶體一般是單晶體,如石英晶體,其壓電性弱,介電常數低,故近年對無機生物壓電材料的研究多集中在多晶體的壓電陶瓷上。壓電陶瓷作為無機壓電材料中不可忽視的一部分,其在骨組織工程研究領域有極高的應用潛力[8]。由于含鉛類壓電陶瓷的自身毒性阻礙了其在生物材料方面的應用,故近年以鈦酸鋇、鈮酸鉀鈉為代表的無鉛壓電陶瓷材料及其復合材料廣泛應用于組織工程研究領域中。
3.1.1鈦酸鋇 鈦酸鋇(BaTiO3,BTO)作為一種性能優良的壓電陶瓷,在骨組織工程材料的應用方面具有廣闊的應用前景。Liu等[15]將壓電陶瓷材料鈦酸鋇涂覆于多孔鈦合金支架材料上,并發現該生物活性復合支架具有良好的力學性能和電微環境,實驗結果證明了該支架可促進間充質干細胞的增殖、遷移和成骨分化,并能顯著增強動物體內骨和血管生成,是一種很有前途的修復骨缺損的復合生物材料,特別是在承重部位,具有很大的臨床轉化潛力。
3.1.2鈮酸鉀鈉 陳威[16]通過三維打印技術制備了鈮酸鉀鈉壓電支架,高溫極化后得到壓電常數約為60 pC/N的壓電支架。通過體外細胞實驗和體內動物實驗,證明了該多孔鈮酸鉀鈉壓電支架具有良好生物相容性,其能促進骨髓間充質干細胞的增殖與黏附,可以顯著提高新骨生成。
3.2 有機壓電材料
有機壓電材料又稱壓電聚合物,其中以聚偏氟乙烯及其共聚物[17]、聚羥基丁酸酯及其共聚物[18-19]、聚L—乳酸[20]等聚合物在組織工程的研究最為廣泛。
3.2.1聚偏氟乙烯及其共聚物 聚偏氟乙烯(PVDF)和偏氟乙烯聚三氟乙烯(P(VDF-TrFE)具有良好的壓電性和生物相容性,是制備骨組織工程的理想材料[17]。Zhang等[21]建立了一種控制表面電位的有效方法,強調了優化電刺激在骨再生中的重要性,并得出在表面電位約為-53 mV的P(VDF-TrFE)膜上培養的骨髓間充質干細胞具有更好的成骨性能。唐柏林等[22]采用溶液澆鑄法制備了 P(VDF-TrFE)薄膜,探究了極化后該薄膜表面靜電電位對細胞成骨分化影響及其機制,結果表明隨薄膜表面電勢增大,細胞成骨分化能力先提高后降低,在表面電勢為391 mV的薄膜上細胞展現出最強的成骨能力。
3.2.2聚羥基丁酸酯及其共聚物 聚3—羥基丁酸酯及其共聚物(PHB/PHBV)是一種可降解和生物相容性好的壓電聚合物,適合于組織工程應用[18-19]。Gorodzha等[23]采用靜電紡絲法制備了聚己內酯(PCL)、聚3—羥基丁酸酯共聚物(PHBV)和含硅酸鹽羥基磷灰石的聚羥基丁酸酯(PHBV-SiHA)復合材料的三種骨支架。通過體外研究發現,與非壓電PCL相比,壓電PHBV支架具有更好的鈣沉積能力。結果表明了混合型PHBV-SiHA支架在骨組織工程中具有明顯的優勢。Chernozem等[24]將碳酸鈣粒子與聚羥基丁酸酯及其共聚物復合,制備了一種壓電生物降解支架,并通過細胞實驗證實了該支架良好的生物相容性,并能刺激骨組織的生長,有望應用于骨組織工程研究中。
3.2.3聚L—乳酸(PLLA) 除聚羥基丁酸酯及其共聚物外,聚L—乳酸也是一種優良的可降解的生物壓電材料。同樣,與鈦酸鋇等生物壓電陶瓷材料不同,聚L—乳酸不需燒結、不需極化即可產生壓電效應[8]。PLLA是一種具有螺旋聚合物鏈的α晶體,在正常情況下是無極性的,在拉伸或電極化作用下,α晶體可能轉化為β晶體,從而賦予PLLA壓電特性[23]。張鵬等[25]制備了一種生物相容性壓電多孔膜材料,解決了現有技術的壓電膜材料難降解、生物相容性差的的問題。Smith等[26]研究了聚L—乳酸納米管作為生物軟壓電界面的詳細納米尺度表征,展示了聚L—乳酸納米管的剛度、表面電位和壓電活性的差異如何導致細胞行為的差異。Curry等[27]制備了一種具有高度可控、高效和穩定壓電性能的生物可降解壓電PLLA納米纖維,其具有良好的生物相容性。研究結果表明,該納米纖維在藥物傳遞、組織工程等領域有極大的應用潛力。
4 壓電復合材料
近年來,相關研究人員通過物理或化學的方法將不同類型電活性生物材料之間進行復合,充分發揮電活性生物材料模擬生物體生理電微環境的潛力[8]。在聚合物基質中使用納米顆粒作為填料,開發出模擬骨組織力學、化學和電學性質的生物材料,正日益引起人們的興趣[28]。以鈦酸鋇為無機相粒子,加入聚合物基體中,探究其壓電性能及成骨性能,近年來已經得到了廣泛的研究,見表1。
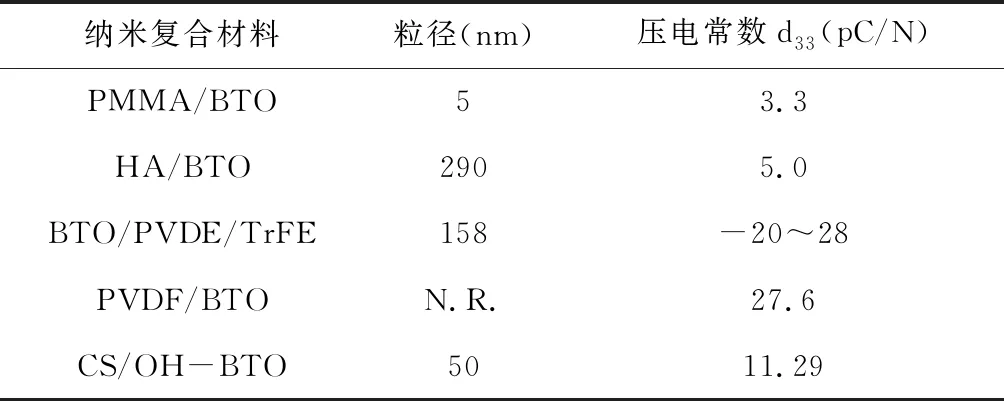
表1 鈦酸鋇壓電納米復合材料的d33值[29]
4.1 不可降解鈦酸鋇壓電復合材料
4.1.1鈦酸鋇-聚偏氟乙烯及其共聚物納米復合壓電材料 Zhang等[21]采用溶液共混法將改性納米鈦酸鋇(BaTiO3)和聚偏氟乙烯-三氟乙稀(P(VDF—TrFE))復合制備了一種可模擬內源性電位的納米復合膜,探討了其對骨缺損的修復效果。結果表明,含有5vol%鈦酸鋇顆粒的納米復合膜極化后表面電位可至-76.8mv且具有良好穩定性,符合內源性生物電位水平。Dai等[30]通過制備BaTiO3/P(VDF—TrFE)納米壓電復合膜,再現了天然骨組織的內源電微環境,并在體外實驗中發現極化的BaTiO3/P(VDF—TrFE))復合膜可增強2型糖尿病大鼠的骨再生。
4.1.2鈦酸鋇-聚甲基丙烯酸甲酯(PMMA)納米復合壓電材料 Tang等[31]制備了1-3型BaTiO3/PMMA生物壓電復合材料,該材料具有的層狀結構顯著提高了復合材料的壓電性能。通過極化處理后,該材料中片層BaTiO3可以誘導成骨細胞向BaTiO3層的方向生長,這對構建仿生骨單元具有重要價值。
4.2 可降解鈦酸鋇壓電復合材料
4.2.1鈦酸鋇-聚已內酯(PCL)復合壓電材料 楊一[2]以鈦酸鋇(BaTiO3)作為無機相通過兩步熱壓法制備了0-3型BTO/PCL復合材料,研究了該復合材料的壓電性能,為其在生物電活性材料領域的潛在應用提供了參考。Bagchi等[32]以鈦酸鈣(CT)、鈦酸鍶(ST)及鈦酸鋇(BT)三種鈣鈦礦型陶瓷納米粒子為原料,采用靜電紡絲法制備了PCL納米復合材料,結果顯示鈦酸鋇納米顆粒賦予支架壓電性能,并由體外研究證實了以上三種復合材料都支持成骨細胞增殖。Mystiridou等[33]首次使用單螺桿擠壓3D打印技術制備了力學性能和孔隙度良好的PCL/BTO仿生壓電復合支架,通過三維物體的壓電和介電測量表明,該支架具有接近人體骨骼的壓電系數(d33)和高介電常數值。體外實驗表明其生物活性表面可促進成骨細胞的黏附和增殖,在負重組織工程的應用中具有極大潛力。
4.2.2鈦酸鋇-聚L—乳酸(PLLA)及其相關共聚物復合壓電材料 Li等[34]采用靜電紡絲法制備了隨機定向排列的電活性BaTiO3/PLLA復合纖維支架,并發現鈦酸鋇納米粒子的加入改善了纖維支架在靜電紡絲過程中的表面粗糙度、親水性和介電性能,驗證了該復合纖維支架對骨髓間充質干細胞成骨分化有聯合作用,并證明了其在骨再生方面具有廣闊的應用前景。楊友文等[35]公開了一種鈦酸鋇和氧化石墨烯(GO)協同增強的左旋聚乳酸復合材料,GO作為導電顆粒可有效促進BaTiO3中偶極子的偏轉,進而增強支架的壓電性能并在電刺激作用下促進成骨細胞的增殖和分化,使復合支架具有良好的生物活性。
Wang等[36]采用水熱法合成釓摻雜鈦酸鋇納米粒子(Gd-BTO NPs),并與聚乳酸—羥基乙酸共聚物(PLGA)復合制備了納米復合材料,該復合材料具有與骨骼匹配的壓電和介電特性,并在高壓極化后產生負的表面電位,可調控小鼠前成骨細胞MC3T3-E1的成骨分化。Kemppi等[37]將鈦酸鋇納米粒子加入聚(L,D)乳酸共聚物(PL/DA)支架中制備了多孔蜂窩狀結構,該支架具有良好的生物相容性,其孔隙結構利于細胞向支架內遷移,并對細胞增殖有促進作用。
4.2.3鈦酸鋇-殼聚糖復合壓電材料 Evgen等[29]制備了一種殼聚糖(CS)/羥基化納米BaTiO3(OH-BTO)復合壓電材料,并發現該復合材料具有接近于骨組織的壓電系數(D33=11.29pC/N),通過體外實驗驗證了其具有良好的生物相容性且可促進細胞生長。
4.2.4鈦酸鋇-羥基磷灰石(HA)復合壓電材料 焦華等[38]制備了一種可控性BTO/羥基磷灰石納米復合材料陶瓷塊并進行了細胞毒性研究,證實了鈦酸鋇在陶瓷塊體中的分布和大小直接增強了材料的壓電性能和力學性能,且其對大鼠前成骨細胞有良好的生物相容性。Polley[39]等通過3D打印技術制備了BTO/HA復合多孔支架,該支架的孔隙結構與壓電性能與骨組織十分接近,且具有良好的生物活性。
4.3 生物可降解聚乳酸壓電復合材料的研究進展與展望
與不可降解材料相比,生物可降解材料在修復嚴重骨缺損方面發揮著越來越重要的作用,引起了研究者的廣泛關注[40]。目前廣泛研究的壓電聚合物聚偏氟乙烯及其復合材料,在極化處理后雖有良好的彈性及壓電性能,但其不可降解性使其在骨再生領域的應用受到了限制。而聚L—乳酸作為壓電聚合物之一,因其易加工、顯著的機械強度以及FDA批準的生物可降解性而被選為常用聚合物基質材料,憑借著其良好的生物相容性和可降解的能力,為可降解電活性植入物用于骨組織工程領域帶來可能。單純聚乳酸由于其性能單一,難以滿足組織工程材料的要求,針對此問題,將聚乳酸與其他壓電材料(如鈦酸鋇)復合后進行一些處理,使其表面達到一定電荷累積來滿足內源性生理電位,從而刺激骨的形成與再生,可在骨組織工程領域找到進一步的潛在應用。此外,可降解生物電活性材料作為仿生膜和骨支架的刺激響應能力也值得進一步研究。
5 總結
壓電復合材料在骨組織工程中的應用具有廣泛的前景。目前許多研究表明,壓電材料具有良好的生物相容性,且在一定程度上具有促進骨組織再生的能力。生物電活性植入物可以通過人體運動或應激在體內產生電荷和電位,進而促進細胞粘附、分化和遷移,從而達到刺激骨形成與再生的目的。未來的研究工作可能著重于在聚合物基質使用更高含量的鈦酸鋇顆粒來盡可能模擬骨組織特性,以及電刺激作用于骨細胞以獲得功能性骨組織單元等方面。
天然骨主要由膠原纖維和羥基磷灰石晶體組成,這也啟發了復合壓電材料在骨組織工程領域中的應用。由于鈦酸鋇/羥基磷灰石復合材料脆性大力學性能欠佳,其在組織工程領域的應用受到了一定限制,所以適合以上要求的典型復合生物材料是在壓電聚合物基體中(如聚偏氟乙烯及其相關共聚物、聚羥基丁酸酯及其共聚物、聚乳酸等)填充生物壓電陶瓷顆粒(其中以鈦酸鋇陶瓷為典型)。同時,因聚偏氟乙烯及其衍生物的共聚物,聚甲基丙烯酸甲酯等不具備體內可降解的特性,在植入后需二次取出,該缺點限制了其應用。因此,可以復制骨組織特性(如生物降解性、生物相容性、可加工性和機械性能)的聚合物(如聚己內酯、聚乳酸、殼聚糖等)在組織工程中的應用顯得十分重要。根據上述,聚L—乳酸兼備可降解性以及壓電性能兩個特性,所以其應得到更多研究和關注。目前只有有限的研究利用這種環境友好的策略來制備生物可降解壓電復合材料。現有證據表明,鈦酸鋇的壓電特性對自然骨形成途徑有積極的影響,并使其在負重組織工程應用中得到更廣泛的應用。所以,將鈦酸鋇與聚乳酸基高分子材料復合來制備一種生物可降解壓電材料應用于組織工程研究是非常必要的。

