控制性超促排卵對小鼠胎盤功能基因表達及胎鼠體質量的影響
馬 蓉,陳書強,雷 輝,金 妮,王曉紅
空軍軍醫大學唐都醫院 婦產科生殖醫學中心,陜西西安 710038
輔助生殖技術(assisted reproductive technology,ART)是現代醫學的重要組成部分,近10年得到了充分的發展和應用,以體外受精為基礎的輔助生殖技術已經成為治療不孕癥的主要手段。通過ART 出生的嬰兒數量在世界范圍內穩步增長,到目前為止已經超過800 萬[1]。輔助生殖技術存在多種不良的妊娠結局,包括胎盤和胎兒生長方面[2]。因此,對ART 中的每一種干預措施均應進行單獨研究。我們知道,自然妊娠每個月經周期中有1個優勢卵泡發育成熟,而在輔助生殖技術操作中,利用控制性超促排卵(controlled ovarian hyperstimulation,COH) 這一關鍵步驟,通過注射超生理濃度的促性腺激素(卵泡刺激素和黃體生成素),以覆蓋體內自然內分泌調節系統,使多個卵子同時成熟,進而獲得多個胚胎,增加妊娠成功的概率。研究顯示,COH 導致母體子宮內膜微環境顯著變化,且持續在著床期和胎盤早期。那么,COH 導致的異常母體子宮內膜微環境會對胚胎發育產生怎樣的影響呢?本研究中,我們利用小鼠模型,消除了COH 對卵母細胞、體外受精和體外胚胎培養等的影響[3],將未暴露于促性腺激素的體內受精囊胚移植入自然交配和超促排卵后的假孕雌鼠體內,單獨研究COH 這一關鍵操作步驟對小鼠胎盤功能基因表達及胎鼠體重的影響。
材料與方法
1 實驗動物 SPF 級8~ 10 周齡健康雌性ICR 小鼠70 只,體質量28~ 32 g;8~ 10 周齡雄性小鼠30 只,體質量34~ 40 g。購于北京華阜康生物科技公司。
2 主要試劑與儀器 馬絨毛膜促性腺激素(Pro Spec),人絨毛膜促性腺激素(Millipore),溶于PBS 緩沖液;MⅡ胚胎操作液(Millipore);反轉錄試劑盒(Taraka),熒光定量試劑盒(Taraka);RIPA 中蛋白裂解液(碧云天),BCA 定量試劑盒(Thermo),Luminex 液相懸浮芯片檢測試劑盒(R&D Systems),懸液微珠芯片平臺Bio-Plex MAGPIX System(上海華盈生物醫藥科技有限公司)。
3 小鼠胚胎移植動物模型的建立 取12 只正常雄性小鼠,麻醉后,輕壓腹腔,剪去腹部被毛,消毒后以腹部橫切法剪開腹壁,用眼科鑷斜向下方夾住一側脂肪墊將睪丸、附睪和輸精管拉出切口,鈍性分離輸精管,將其燒烙掉1 cm 左右,夾住脂肪墊將睪丸放入腹腔,同樣方法處理另一側,縫合手術切口。術后1 周,將自然發情雌性小鼠與其1∶1 合籠,次日上午8:00 檢查雌鼠,見陰道栓者記為假孕0.5 d 并于妊娠5.5 d 解剖子宮,檢查是否有胚胎植入,以確定雄鼠結扎成功。取3 只性成熟自然發情雌鼠作為自然交配代孕組(NC 組),取3 只性成熟雌鼠腹腔注射馬絨毛膜促性腺激素(5 IU/只),48 h 后腹腔注射人絨毛膜促性腺激素(5 IU/只),作為超促排交配代孕組(COH 組),兩組雌鼠與輸精管結扎雄性小鼠1∶1 合籠,次日上午8:00 檢查雌鼠,見陰道栓者記為假孕雌鼠妊娠0.5 d。取18 只性成熟自然發情雌鼠與18 只正常雄鼠1∶1 合籠,次日上午8:00檢查雌鼠,見陰道栓者記為供胚雌鼠妊娠0.5 d,于妊娠3.5 d 顯微鏡下使用MⅡ培養液從子宮內沖出囊胚,后移入NC 組代孕鼠及COH 組代孕鼠子宮角,每側各移植8 枚。每次移植實驗建立移植模型6 只(NC 組3 只,COH 組3 只),共進行3 次移植實驗,NC 組和COH 組移植后順利妊娠的雌鼠各8 只,于妊娠18.5 d 收取樣本。
4 胎鼠及胎盤稱重 NC 組與COH 組小鼠于妊娠18.5 d 解剖子宮,取胎鼠及胎盤稱重并記錄。
5 Real-time PCR RT-PCR 檢測胎盤生長相關印記基因Igf-2、Peg3、H19、Mest、Cdkn1c、Mash2、Cd81、Plagl1、Zim1 和Ube3a 的mRNA 表達。取妊娠18.5 d 胎盤組織,采用Trizol 法提取兩組胎盤樣本中的總RNA,用Takara 反轉錄試劑盒(Cat#RR820,Lot#AKE1145A) 進行擴增,按照產品說明書進行操作。擴增程序:37℃,15 min;85℃,5 s;4℃,∞。Real-time 反應體系:2×TB Green Premix,12.5 μL;上游引物(10 μmol/L),1 μL;下游引物(10 μmol/L),1 μL;模板,2 μL,加入滅菌蒸餾水至25 μL。反應體系以GAPDH 為內參,引物序列見表1。

表1 Real-time PCR 引物Tab.1 Primers used for real-time PCR
6 Luminex 液相懸浮芯片技術檢測胎盤生長相關細 胞 因 子VEGF、PIGF-2、PDGF-BB、MMP-2、MMP-9 和VEGFR2 的蛋白表達 胎盤組織樣本蛋白抽提(RIPA 中裂解液),BCA 法蛋白定量(Thermo),取200 μg 等質量上樣檢測,經過樣品孵育、檢測抗體、顯色等步驟,送入已校正的Bio-Plex 機器中讀值。根據標準品得到的熒光檢測值,使用多參數模式對標準曲線進行擬合,得到標準曲線及其方程,濃度單位為pg/mL。
7 統計學方法 采用SPSS22.0 統計分析軟件對數據進行錄入及分析。計量資料以表示,兩組間比較采用t檢驗;P<0.05 為差異有統計學意義。
結 果
1 兩組小鼠子代體質量、胎盤重量、胎盤效率比較 COH 組小鼠子代體質量、胎盤重量明顯低于NC 組(P<0.05);COH 組小鼠胎盤效率(胎兒體質量/胎盤重量)明顯低于NC 組(P<0.05)。見表2。

表2 兩組小鼠出生體質量、胎盤重量、胎盤效率比較Tab.2 Comparison of birth weight,placental weight and placental efficiency between the two groups
2 兩組小鼠胎盤生長相關印記基因表達水平比較 與NC 組相比,COH 組小鼠胎盤印記基因Igf-2、Peg3、H19、Mest、Cdkn1c、Mash2、Cd81、Plagl1、Zim1、Ube3a 表達水平顯著降低,差異均有統計學意義(P<0.05)。見表3。
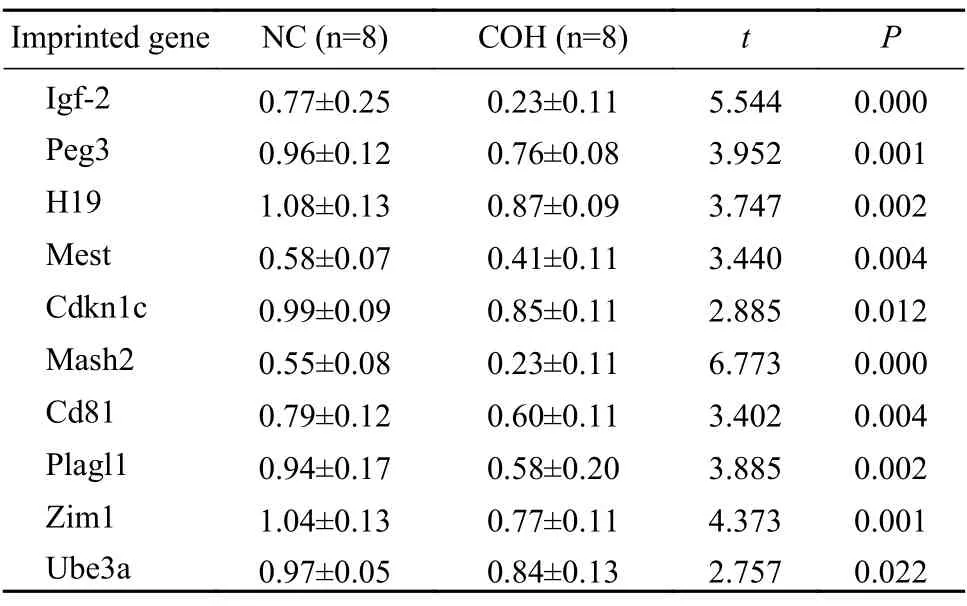
表3 Real-time PCR 檢測兩組小鼠胎盤mRNA表達水平比較Tab.3 Comparison of mRNA expression of placental tissue in mice by real-time PCR
3 兩組小鼠胎盤生長相關細胞因子比較 與NC 組相比,COH 組小鼠胎盤VEGF、PIGF-2、PDGF-BB、MMP-2、MMP-9、VEGFR2 表達水平降低,差異有統計學意義(P<0.05)。見表4。

表4 Luminex 液相懸浮芯片技術檢測兩組小鼠胎盤生長相關細胞因子蛋白表達水平比較Tab.4 Comparison of protein expression of placental tissue in mice by Luminex liquid suspension chip technology
討 論
研究表明,輔助生殖技術受孕分娩的新生兒低出生體質量的發生風險是自然受孕分娩新生兒的3 倍[4]。低出生體質量兒的患病率和死亡率較正常體質量新生兒顯著升高,并且低出生體質量兒成年后患慢性疾病的風險也顯著增加[5]。所以解析輔助生殖技術過程中導致試管嬰兒低出生體質量的風險因素,對臨床防治ART 低出生體質量兒的發生至關重要。我們知道新鮮周期移植是在超排卵后直接將新鮮胚胎移植到高劑量外源性激素刺激的子宮中,而在冷凍周期中,胚胎則被移植到更類似于自然周期的子宮環境中。研究表明,與冷凍周期相比,新鮮周期新生兒低出生體質量的風險顯著升高[6]。這提示我們,COH 可能對子宮內膜容受性、胚胎發育等產生多方面的影響。我們的研究通過建立小鼠模型,消除了COH 對卵母細胞、體外受精和體外胚胎培養等的影響[3],將未暴露于促性腺激素的體內受精囊胚移植入自然交配或超促排卵后的假孕雌鼠體內,單獨研究COH 這一關鍵步驟對小鼠子代體質量及胎盤的影響,通過對胎盤印記基因、胎盤生長相關細胞因子的檢測發現,COH 影響胎盤印記基因和胎盤生長相關細胞因子的表達。
印記基因在胎兒、胎盤的生長發育及胎兒出生后的生長等方面發揮著重要調節作用,大部分印記基因在胎盤組織高表達[7],且研究發現印記基因可以通過控制胎盤中氨基酸、葡萄糖的轉運調節母體與子代之間的營養物質傳輸,參與調控胎盤、胚胎之間的營養物質供需平衡[8]。研究表明,H19、Igf-2 和Cdkn1c 基因被印記并參與調節胎兒和胎盤的生長[9-11]。Mest 基因參與胎兒生長發育,敲除Mest 基因后出現胚胎和胎盤發育遲緩,且具有調節哺乳動物行為的功能[12]。本研究通過對這些重要印記基因的檢測,發現控制性超促排卵可能降低小鼠胎盤生長相關印記基因的表達,進而影響子代的生長發育潛能。
胎兒的發育是由胎盤支撐的,胎盤是胎兒與母親之間的界面,所有到達胎兒的營養和氧氣都必須通過這個器官,胎盤可以協調母體對懷孕的適應并調動資源供胎兒使用[13]。既往研究發現,血管生成因子VEGF、PIGF 等在正常胎盤發育過程中參與血管重構,保證了母胎界面豐富的血流及胎盤的順利形成[14-16]。PDGF 主要由單核巨噬細胞產生,其啟動一系列細胞內信號轉導,PDGFBB/PDGF-Rβ 相互作用在血管成熟中起關鍵作用[17]。MMPs 參與胚胎發育、傷口愈合、炎癥細胞遷移、動脈粥樣硬化及腫瘤浸潤轉移等多種生理和病理過程。研究發現,MMP-2 和MMP-9 在發情、月經周期和妊娠期間的子宮內膜組織重塑中發揮作用,在妊娠大鼠的主動脈和子宮中MMP-2和MMP-9 表達上調[18]。本研究中,我們采用Luminex 液相懸浮芯片技術對小鼠胎盤中胎盤生長及血管發生相關細胞因子進行了檢測,結果表明控制性超促排卵導致小鼠胎盤生長及血管發生相關細胞因子表達水平降低。妊娠時蛻膜NK 細胞的主要功能是分泌VEGF、PIGF 等血管生成相關的細胞因子[19-20]。根據本課題組前期的研究,控制性超促排卵可以減少妊娠時蛻膜NK 細胞的數量,可能是導致上述結果的重要原因,有待進一步驗證。
綜上,我們利用小鼠模型發現,控制性超促排卵致小鼠子代體質量降低,胎盤重量降低,胎盤效率降低,但控制性超促排卵導致子代低體質量的具體分子和細胞機制仍有待闡明。臨床中控制性超促排卵是否通過影響胎盤重量及效率而影響試管嬰兒出生體質量,有待進一步揭示。

