UDI合規賦碼企業在實施中的四個關鍵步驟
陳雷/文
2022年6月1日起,企業生產的第二批實施UDI的品種應當具有醫療器械UDI賦碼,很多三類器械企業已經在實施UDI項目。其中,UDI合規賦碼是UDI實施流程中的難點,對企業來說,產品標識的UDI信息不合規,就會面臨產品無法流通的困境。企業想要順利實現UDI賦碼,就需要做賦碼設備選型、標識設計及審核、抽檢留樣、打印記錄查詢等四個關鍵步驟。
UDI賦碼設備的選擇
作為UDI賦碼的載體,需要根據不同的包裝材質,選擇不同的賦碼設備,目前市場上的UDI賦碼設備有熱轉印打印機、UV噴碼機、熱發泡TIJ噴碼機、激光打印機等,基本能滿足不同客戶不同材質的賦碼要求。其中UDI常見的包材和賦碼方式,如圖1所示。
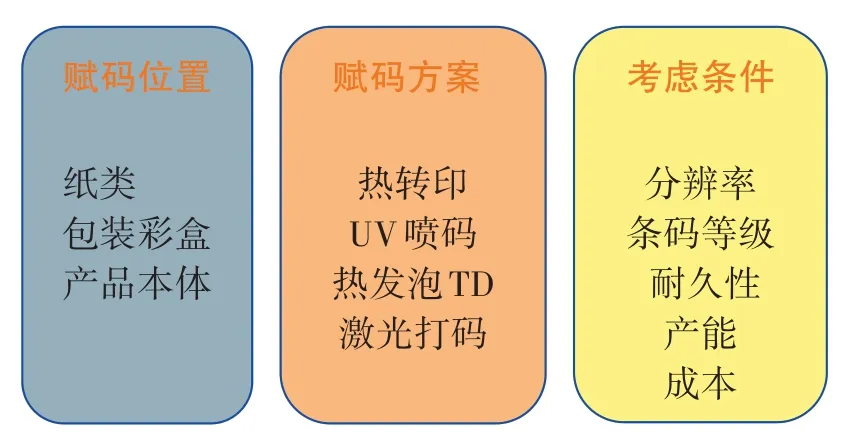
圖1 UDI常見包材和賦碼方式
標識設計及審核
對企業而言,UDI標識的設計需要根據不同的客戶要求及法規要求進行標識設計,原先的操作方式是通過人員對于模版的修改進行不同產品、不同批次的生產打印,容易出現選錯模版打錯標簽的情況,應該按照GMP藥品質量管理規范的要求,對標識的設計、審核進行流程上的細化并形成SOP標準操作文檔,如圖2所示。

圖2 UDI標識設計
標識設計時需要考慮以下幾個因素:
·UDI標簽上不但有條碼信息,還要有標識說明;
·UDI條碼質量要符合ISO/IEC15415《二維碼的打印質量測試規格》、ISO/IEC15416《一維條碼的打印質量測試規格》標準的C級以上;
·UDI條碼需要與掃碼結果內容保持一致;
·UDI條碼需要符合AIDC與和HRI原則,包含機器識讀及人工識讀部分。
UDI標識的抽檢留樣
企業器械生產質量部應當建立質量控制程序,規定產品檢驗部門、人員、操作等要求,并規定檢驗儀器和設備的使用、校準等要求。
產品標識的抽檢留樣是質量管理規范的基本內容,需要對生產過程中的產品標識進行首檢、抽檢和尾檢,并提供條碼等級檢測報告做為抽檢留樣的憑證保存下來。
UDI載體除應符合標簽相關質量要求外,還應按UDI標簽檢測標準進行檢測,條碼等級的檢測結果應在C級以上,見表1(下頁);
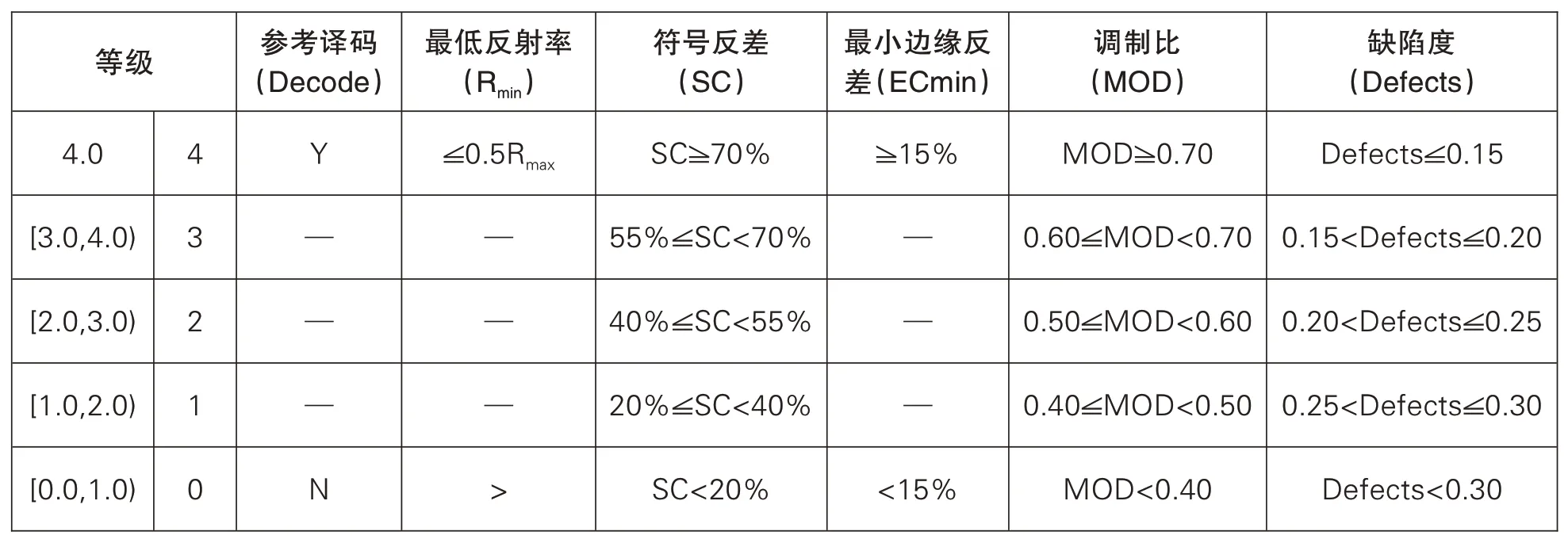
表1
一維條碼:采用GB/T 14258-2003《信息技術自動識別與數據采集技術條碼符號印制質量》的標準進行檢測;
二維碼:采用GB/T 23704-2017《二維條碼符號印制質量的檢驗》的標準進行檢測。
UDI打印記錄查詢
對于生產過程中的打印數據應當按照生產工藝規程組織注冊檢驗用產品、臨床試驗產品生產,并如實填寫批生產記錄。批生產記錄應當準確、完整且可追溯。
UDI軟件合規服務提供UDI標簽設計軟件,醫療器械唯一標識管理系統,打通藥監局申報、發碼機構編碼、追溯應用全流程。輕松實現注冊證管理、產品管理、生產管理、基礎管理、系統管理,可提供藥監、醫保接口。
UDI硬件合規服務提供在線等級檢測標簽機、條碼檢測儀、自動噴碼機、彩色標簽打印機等UDI硬件設備,為醫療器械產品提供切實可行的UDI賦碼及等級檢測方案。

UDI標簽合規服務提供適用一類、二類和三類醫療器械企業的各種醫療設備、IVD(體外診斷)、高值耗材、低值耗材標簽材料,提供UDI數據服務、招采前、招采后數據服務。Auto-ID

