間充質干細胞來源胞外囊泡在牙及頜面部組織再生中的研究與展望
廖立 田衛東
口腔疾病研究國家重點實驗室 國家口腔疾病臨床醫學研究中心 口腔轉化醫學教育部工程研究中心 口腔再生醫學國家地方聯合工程實驗室 四川大學華西口腔醫院創傷整形外科,成都610041
感染、炎癥、外傷、手術等多種因素均可導致口腔頜面部組織的缺損和缺失發生率高,嚴重損害患者身心健康。目前,牙髓壞死、牙周組織破壞、頜骨缺損和頜面部軟組織缺損等是采用非生理性修復或生物材料替代,無法實現組織再生和生理結構的重建。為突破口腔頜面部組織再生修復面臨的技術瓶頸,亟需尋求新的生物治療策略。
間充質干細胞(mesenchymal stem cells,MSCs)是廣泛分布于骨、脂肪、牙髓、牙周膜等結締組織中的一類重要的成體干細胞,具有強大的自我更新和多向分化潛能,在局部組織發育、穩態維持、修復和再生中發揮關鍵作用[1]。MSCs能從體內獲取并在體外進行擴增,目前已被應用于骨、軟骨、皮膚、肌肉等多種組織的再生修復[1-2]。雖然基于MSCs的細胞治療已在多種組織再生中取得顯著的療效,但制備困難、保存和運輸、細胞異質性、長期體內存活引起的潛在風險和倫理問題等限制了其臨床使用。目前干細胞治療仍局限于缺乏有效治療手段的危重病癥,難以廣泛推廣。
研究證實,MSCs主要通過三條途徑促進組織再生:1)直接分化為組織細胞;2)通過免疫調節功能改善局部再生微環境;3)通過釋放多種生物活性成分,促進組織再生[1,3-4]。其中,MSCs的旁分泌作用越來越受到關注。研究者逐漸聚焦于解析MSCs分泌的關鍵生物活性成分,探索無細胞的治療策略,以克服MSCs細胞治療中面臨的限制[5]。
最新研究[6]證實,胞外囊泡(extracellular vesi‐cles,EVs)是MSCs的重要分泌成分之一,在MSCs介導的多種組織修復再生中發揮關鍵作用。研究者們[6-7]廣泛探索了MSCs分泌的EVs(MSCEVs)在骨、脂肪、心肌、神經及多種口腔組織再生中的作用,證明MSC-EVs是一類具有臨床轉化潛力的重要生物活性物質。與MSCs細胞治療在應用上相比,MSC-EVs具有成分簡單、作用途徑明確、低免疫原性、致瘤風險低、易儲存、可避免倫理問題等多種優勢,且無需考慮細胞存活和異常分化等問題。據此,MSC-EVs可能成為一種全新的無細胞治療手段用于組織再生,從而有效規避MSCs在應用上的限制,推動再生醫學的進展。目前,全球已注冊的EVs臨床研究已超過200項,其中有2項應用EVs治療口腔疾病的研究已開始招募志愿者。隨著基礎科學研究和產品應用開發的推動,EVs有望在組織再生、藥物輸送、免疫治療和疾病診斷等領域得到廣泛應用。因此,本文對近年來MSC-EVs在口腔組織再生中的基礎研究及應用探索進行總結,并對MSC-EVs在轉化應用中面臨的問題展開討論和展望,以期推動相關研究及轉化應用。
1 MSC-EVs的定義、分類和基本成分
1.1 EVs的定義和分類
EVs是由細胞產生并分泌到細胞外的一類帶有脂質膜結構的小囊泡。細胞分泌的EVs具有明顯的異質性,根據產生機制的不同可分為外泌體(exosomes)、微囊泡(micro vesicles)和凋亡小體(apoptotic body)三類。其中,外泌體是通過膜內吞途徑產生,粒徑大小為40~200 nm,平均粒徑在100 nm,表達四次跨膜蛋白超家族、Alix、tumor susceptibility 101(TSG101)等特異性的標志物。微囊泡是通過細胞膜向胞外而突出形成小泡,并釋放入細胞外,粒徑大小為200~2 000 nm,表達整合素、選擇素、CD40等標志物。凋亡小體則是在細胞凋亡過程中通過胞膜皺縮內陷,分割包裹胞質而形成[8]。因為凋亡小體具有一定的特殊性,本文僅集中探討MSCs分泌的外泌體及微囊泡。
因為其特有的產生方式,EVs含有豐富的蛋白、脂質、核酸(miRNA、mRNA、DNA)等生物活性物質[9]。更重要的是,釋放入胞外的EVs可以通過表面特異的配體/受體結合或者非特異吸附的方式與靶細胞結合,通過胞吞作用、微胞飲作用、內吞作用等多種方式將其攜帶的物質運送入靶細胞內,調節靶細胞功能,從而發揮細胞間信息交流的作用[10]。
1.2 MSCs分泌豐富的EVs
研究證實,骨髓、脂肪、臍帶以及牙髓、牙周膜、頜骨等組織來源的MSCs,均能夠分泌數量豐富的外泌體和微囊泡。已有多項研究[11-12]對MSC-EVs的成分進行了系統性的檢測,發現MSCs-EVs中含有多種生物活性物質,主要包括蛋白(轉錄因子、生長因子、細胞因子和酶等)、RNA(mRNA、siRNNA、miRNA等)、DNA(ss‐DNA、dsDNA等)和脂類(花生四烯酸、二十二碳六烯酸、磷脂酸、溶血卵磷脂等)。
因為其產生方式,MSC-EVs攜帶的物質與MSCs有一定程度的相似性,含有多種MSCs的特有成分和活性物質。通過比較MSCs和MSCs來源EVs中的蛋白質表達,發現在MSCs表達的總共6 342種蛋白中,有1 927種也表達于EVs[12]。而功能學研究也證明EVs的生物學活性往往與其來源的MSCs是相似的,同樣具有促增殖、抗凋亡、促進血管形成和免疫調節等多種功能。
需要注意,不同組織來源和不同狀態下MSCs分泌的EVs中的成分存在差異,可能導致其具有完全不同的生物學活性[13]。如牙髓來源MSC-EVs與骨髓來源MSC-EVs具有不同的免疫調節功能[14];骨髓來源MSCs-EVs可促進干細胞向成骨方向分化,而脂肪來源的MSC-EVs更有利于干細胞向成脂方向分化[15]。也有研究[16]報告,骨質疏松患者來源的骨髓MSCs高表達miR-21,從而具有抑制骨再生的作用;而在腫瘤等疾病中,骨髓MSCs分泌的EVs成分會發生改變,并促進腫瘤形成[17]。因此,在本文中僅探討健康組織來源的MSC-EVs。
2 MSC-EVs具有促進組織再生的功能
MSC-EVs可以被組織細胞、免疫細胞、血管內皮細胞等多種細胞所攝取和吞噬,從多個途徑影響組織再生修復的進程。這種多因素的協同作用,可能是MSC-EVs具有強大促組織再生能力的關鍵。
2.1 MSC-EVs促進組織細胞再生
2.1.1 細胞增殖功能 MSCs可以通過釋放EVs調控局部組織細胞的增殖,從而維持組織穩態平衡和再生。研究[18]發現,在牙發育過程中,上皮與牙胚間充質細胞之間通過EVs相互傳遞重要的信號物質,調控細胞的有序擴增,從而實現牙的正常發育。體外研究[19]也發現,牙囊MSC-EVs可以促進炎癥狀態下牙周膜細胞的增殖,從而改善牙周炎狀態下的牙槽骨修復再生。
2.1.2 細胞分化 已有多項研究[15]證實了MSC-EVs具有促進干細胞分化的作用。總體而言,MSCEVs的促分化功能與其來源細胞的譜系具有緊密聯系。如骨髓來源MSCs-EVs可有效促進干細胞向成骨方向分化,脂肪來源MSCs-EVs可促進細胞向成脂方向分化。但也有研究[20]發現同種MSCs來源的EVs可以促進干細胞向不同的方向分化,可能與靶細胞的種類和細胞實驗所使用的誘導條件有關。
2.1.3 細胞存活 MSC-EVs具有維持細胞存活、減少細胞凋亡的功能。在缺氧、炎癥等病理條件下,MSC-EVs可通過維持組織細胞存活而促進組織再生。在心肌缺血、下肢缺血等動物模型中均觀察到,使用MSC-EVs可以有效地預防和減少局部組織細胞的凋亡,從而加速組織再生過程。其作用可能是通過減少細胞內氧化應激等途徑來實現[21]。
2.1.4 細胞遷移功能 多種組織來源的MSC-EVs均可以促進成纖維細胞的遷移,并且呈現出一定的劑量效應[22]。在皮膚創傷模型中,MSC-EVs通過加速局部細胞的遷移促進皮膚缺損愈合[23]。其作用途徑是通過轉運Wnt3α等細胞因子以及非編碼RNA等,提高組織細胞的遷移能力[23]。
2.2 血管及神經再生作用
血管和神經再生是組織再生的必需環節。快速的血管再生和重建可以為組織細胞提供足夠的氧氣和營養支持;而神經再生可以通過神經分泌因子促進組織改建,并恢復組織器官感覺和運動功能。研究證明,EVs除直接促進局部組織細胞的再生修復外,可同時促進血管和神經再生,從而加速組織修復。如脂肪MSC-EVs通過轉運miRNA(miR-125a等)促進血管內皮細胞介導的血管再生功能[24];牙周膜MSC-EVs通過傳遞血管內皮生長因子(vascular endothelial growth factor,VEGF)等因子促進血管再生[25]。骨髓MSC-EVs可以通過減輕氧化應激反應而保護神經元,減少神經系統損傷[26]。
2.3 免疫調節功能
局部的炎癥和免疫反應對組織再生具有重要影響。EVs可以通過與免疫細胞表面直接結合或將內容物運輸至免疫細胞內部的方式,調控T細胞、B細胞、巨噬細胞等多種免疫細胞功能[27]。已有研究[28]發現MSC-EVs可促進初始T細胞向Th17和Treg細胞分化,并調控巨噬細胞的極化,使損傷局部的炎癥細胞從發揮炎癥促進作用轉變為發揮炎癥抑制作用,從而改善組織再生的微環境。
3 MSC-EVs在口腔組織再生中的應用研究
EVs具有強大的生物活性和多種作用途徑,已被嘗試用于多種疾病治療[29]。此外,EVs可將多種活性分子攜帶入靶細胞內,轉運效率高于脂質體等常規的藥物載體,并且不易被免疫系統所清除,可作為理想的藥物遞送載體。目前,MSC-EVs已被用于口腔頜面部組織再生的臨床前研究,并取得了較為理想的療效,展現出廣闊的應用前景。
3.1 牙髓再生
MSC-EVs可以通過直接促進牙髓干細胞/前體細胞的增殖分化和促進牙髓血管再生兩條途徑來共同加快牙髓再生。研究[30]發現,人根尖牙乳頭MSC-EVs可促進牙髓局部的MSCs增殖和向成牙本質細胞分化,從而促進牙髓牙本質復合體的再生;同時,MSC-EVs可以促進牙髓中的內皮細胞的增殖、遷移以及促血管形成功能[31]。Huang等[32]研究發現,牙髓細胞來源的EVs通過激活絲裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)通路促進牙髓干細胞成骨分化;在體內異位移植試驗中,牙髓細胞來源EVs可促進牙髓干細胞介導的牙髓再生[32]。本團隊發現,除了MSC來源的EVs以外,人牙上皮細胞分泌的EVs也可調控人牙乳頭細胞功能,通過激活Wnt通路促進人牙乳頭細胞成牙分化而實現牙髓再生[19]。
3.2 牙周組織再生
牙周炎所致炎癥微環境是導致局部干細胞功能異常和再生缺陷的關鍵。多項研究發現MSCEVs可以提高牙周炎組織中干細胞的成骨分化能力,減輕炎癥對于局部干細胞的抑制作用。本團隊研究[19]證實,牙囊干細胞來源EVs可促進炎癥下牙周膜MSCs的增殖能力,并恢復其成骨分化和遷移能力。利用包載牙囊干細胞EVs的水凝膠,可有效治療牙周炎所致頜骨缺損。此外,本團隊還發現骨髓MSCs來源的EVs,可以通過調控骨保護素(osteoprotegerin,OPG)-核因子κB受體活化因子配體(receptor activator for nuclear factor-κB li‐gand,RANKL)-核因子κB受體活化因子(recep‐tor activator of nuclear factor-κB,RANK)信號通路抑制破骨細胞功能,并促進巨噬細胞由M1型向M2型的轉化,從而緩解牙周炎所致的牙槽骨吸收[33]。
3.3 頜骨及軟骨再生
MSC-EVs對于骨再生修復具有促進作用[34]。研究發現,骨髓間充質干細胞(bone marrow mes‐enchymal stem cells,BMSCs)來源的EVs與生物材料混合后移植可以促進骨缺損再生修復,其機制主要是通過上調骨誘導性miRNA(miR-22-3p、miR-381-3p、miR-146a-5p、miR-503-5p、Hsa-miR-483-3p和Hsa-miR-129-5p)和下調骨抑制性miRNA(Hsa-miR-32-5p、Hsa-miR-133a-3p和Hsa-miR-204-5p),從而激活PI3K/Akt和MAPK等信號通路而發揮作用[35]。MSCs-EVs也可以通過轉運長鏈非編碼RNA而下調骨抑制性miRNA,間接促進成骨分化[36]。因為MSC-EVs同時具有促新骨形成和血管再生功能,有望應用于頜骨缺損修復和頜骨壞死的治療[20]。
此外,MSC-EVs也具有促進軟骨修復再生的功能。MSCs在成軟骨分化過程中分泌的EVs,可以提高BMSCs的成軟骨分化能力,可能用于軟骨修復再生[37]。其機制可能是MSCs分化過程中產生的EVs攜帶有多種成軟骨分化相關miRNA,從而進入受體細胞后可調控其成軟骨分化[37]。有研究發現骨髓MSC-EVs可通過激活蛋白激酶B(pro‐tein kinase B,PKB),細胞外調節蛋白激酶(ex‐tracellular regulated protein kinases,ERK)及腺苷酸活化蛋白激酶(adenosine monophosphate-acti‐vated protein kinase,AMPK)信號,抑制白細胞介素-1β(interleukin-1 beta,IL-1β)造成的軟骨破壞,促進關節軟骨的修復和再生,從而可應用于顳下頜關節炎的治療[38]。
3.4 頜面部軟組織再生
頜面部皮膚、脂肪、黏膜等軟組織缺失缺損不僅影響正常生理功能,還嚴重影響面容、心理和生活。隨著人們對于生活品質的追求不斷提高,頜面部的醫美手術和治療需求也快速增長。臍帶等組織來源的MSC-EVs已被發現在皮膚創傷修復中具有較好效果,MSC-EVs可以激活Wnt通路并抑制轉化生長因子-β(transforming growth factorβ,TGF-β)通路,在促進傷口愈合的同時有效抑制局部成纖維細胞增生所致的瘢痕形成[39]。脂肪MSC-EVs能夠促進脂肪再生和維持脂肪移植物的存活,并應用于局部的軟組織缺損和移植充填[40]。也有研究[41]提示臍帶MSC-EVs具有一定的抗衰老作用,可通過傳遞增殖細胞核抗原(proliferating cell nuclear antigen,PCNA)進入衰老的骨髓MSCs中,從而逆轉干細胞的衰老。目前已有基于MSC-EVs的美容護膚產品上市,顯示出廣闊的應用前景[42]。
綜上,MSC-EVs富含生物活性物質,可在細胞間進行高效的物質遞送和信息交換。目前研究證實,多種MSCs來源的EVs不僅具有促進細胞增殖、遷移和多向分化的能力,還能夠調控血管形成、神經再生和改善局部微環境,通過多種途徑提高組織損傷修復和再生能力。目前MSC-EVs已被應用于牙髓、牙周組織、頜骨、顳下頜關節、頜面軟組織等多種口腔頜面部組織的修復再生及疾病治療中,展現出較大的應用潛力(圖1)。
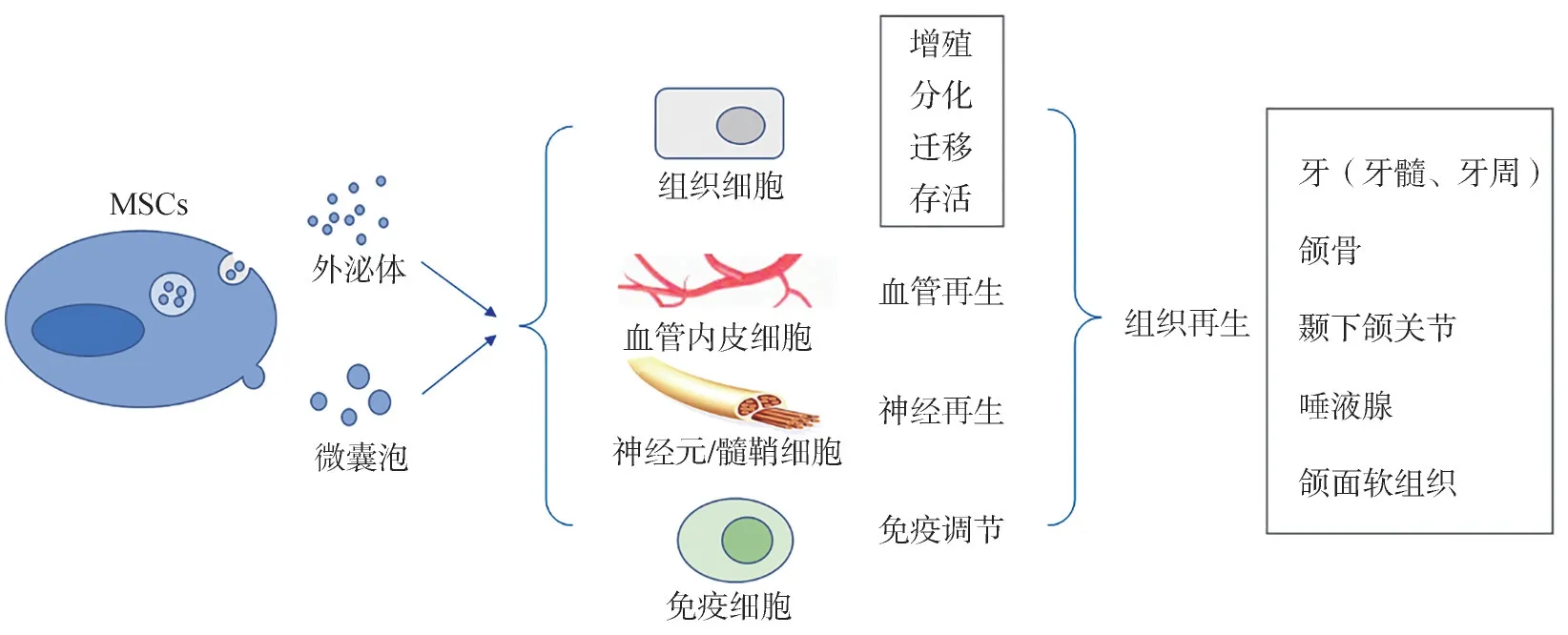
圖1 MSC-EVs通過多種途徑促進口腔頜面部組織再生Fig 1 MSC-EVs promote the regeneration of oral and maxillofacial tissue through multiple approaches
4 展望
雖然MSC-EVs在組織再生領域中的研究取得了快速進展,學界和產業界也清醒的認識到,MSC-EVs的大規模臨床應用仍面臨多個重大的問題,需要進一步的深入探索和科研攻堅。
在基礎研究方面:MSC-EVs發揮組織再生功能的機制復雜,其中的關鍵活性成分尚待明確;目前的研究主要采用體外培養的MSCs所分泌的EVs,而MSCs在體內原位分泌的EVs的作用仍需更先進和精確的研究手段來探索;已有研究仍處于臨床前研究階段,尚無嚴格的循證醫學證據比較其與現有臨床治療手段之間的優劣。在應用研究方向:臨床級EVs的大規模生產、EVs的標準化生產、純化、制備和保存、針對EVs異質性的精細制備和產品研發、EVs生產質量控制等諸多核心環節仍面臨瓶頸問題[43],需要進一步研發和優化MSC-EVs的提取和純化技術,改進EVs的保存體系并進行嚴格的驗證。同時相關監管機構和部門也需要組織專家進行深入研討,及時出臺相關的法規及管理要求。此外,在原生的MSC-EVs的基礎上,如何通過改性、人為設計和修飾使其具有更強的效果及更高的安全性也是未來研究的重點[44]。
利益沖突聲明:作者聲明本文無利益沖突。

