一體化18F-FDG PET/MRI用于診斷胰腺腫瘤
高 欣,馮 剛,孫明祥,袁 正,彭莉玲*
(1.上海全景醫學影像診斷中心,上海 200233;2.復旦大學附屬華東醫院放射科,上海 200040)
胰腺癌惡性程度高,常于晚期出現癥狀后才被診斷,故僅20%的患者具備手術切除指征,且局部可切除患者的存活率也僅23%[1-2]。早期發現并選擇適當手術方案對于預后至關重要。多項研究[3-6]表明,PET/CT有助于診斷和鑒別診斷胰腺癌。相比PET/CT,一體化18F-FDG PET/MRI具有許多優勢,包括輻射劑量更低而軟組織分辨率更高及支持多參數成像[7]。本研究觀察一體化18F-FDG PET/MRI鑒別診斷胰腺良、惡性病變及檢測胰腺癌淋巴結和/或遠處轉移的價值。
1 資料與方法
1.1 一般資料 收集2016年1月—2019年12月于上海全景醫學影像診斷中心接受一體化18F-FDG PET/MRI且未經治療的45例疑診胰腺腫瘤患者,男30例,女15例,年齡10~79歲,平均(59.1±12.6)歲;PET/MR檢查前1周內,7例接受腹部增強CT、10例接受腹部增強MR、18例接受腹部超聲檢查,30例接受糖類抗原19-9(carbohydrate antigen 19-9,CA19-9)檢查;其中21例經手術或穿刺病理證實,13例經影像學聯合腫瘤標志物診斷,11例經影像學聯合臨床隨訪診斷;均隨訪至少8個月,臨床診斷無改變。其中胰腺惡性腫瘤38例(84.44%,38/45),經術后病理證實為胰腺導管腺癌14例(圖1)、神經內分泌癌1例、胰腺神經內分泌腫瘤(pancreatic neuroendocrine neoplasms, pNEN)G1和G2級各1例,穿刺病理證實為胰腺導管腺癌2例,影像學聯合腫瘤標志物診斷13例,影像學聯合臨床隨訪診斷5例(就診至死亡時間8~10個月),腎透明細胞癌胰腺轉移瘤1例;7例(15.56%,7/45)胰腺良性病變,經手術證實導管內乳頭狀黏液瘤及黏液性囊腺瘤各1例,影像學聯合臨床隨訪診斷導管內乳頭狀黏液瘤2例、胰腺炎性病變2例及假性囊腫1例。檢查前患者均簽署知情同意書。
1.2 儀器與方法 采用Siemens Biograph mMR一體機,18F-FDG(江原安迪科/原子科興藥業)放射化學純度>95%。囑患者檢查前空腹至少6 h,控制其空腹血糖<7.80 mmol/L。經靜脈注射18F-FDG 5.55 MBq/kg體質量后,囑患者安靜等待60 min,并于排尿后接受檢查。基于MR Dixon序列衰減校正方法對PET數據進行校正。MR掃描序列包括軸位T1三維梯度回波容積內插屏氣檢查(three-dimensional T1 gradient-echo imaging volume tricinterpolated breath-hold examination, 3D-T1-VIBE)、軸位脂肪抑制(fat suppression, FS)T2加權快速自旋回波(turbo spin-echo T2-weighted, TSE-T2)序列及軸位雙b值(50和800 s/mm2)彌散加權成像(diffusion weighted imaging, DWI);采用全景成像矩陣(total imaging matrix, Tim)技術進行掃描,范圍自顱頂至雙大腿根部。對15例行MR胰膽管成像(MR cholangiopancreatography, MRCP),應用呼吸門控與膈肌導航技術采集上腹部圖像,PET采集每個床位5 min,PET/MRI采集5個床位,時間為35~40 min。
1.3 圖像分析 由多位高年資核醫學科與放射科醫師共同以盲法閱片,計算病灶最大標準攝取值(maximum standard uptake value, SUVmax);于Siemens Syngo.via工作站測量表現擴散系數(apparent diffusion coefficient, ADC)圖中胰腺病灶的平均ADC(mean ADC, ADCmean),根據腫瘤實性部分選取圓形或橢圓形ROI。
1.4 統計學分析 采用SPSS 26.0統計分析軟件。對胰腺良、惡性病變各參數行正態性檢驗及方差齊性分析,以獨立樣本t檢驗(正態分布且方差齊)或Mann-WhitneyU檢驗(非正態分布或方差不齊)比較組間年齡、病灶大小、SUVmax及ADCmean的差異。采用Spearman相關性分析觀察SUVmax與ADCmean的相關性。繪制受試者工作特征(receiver operating characteristic, ROC)曲線,評估各相關指標的診斷效能。P<0.05為差異有統計學意義。
2 結果
2.1 臨床資料比較 胰腺良、惡性病變患者年齡差異無統計學意義[(51.0±3.6)歲vs.(60.6±2.1)歲,t=-1.891、P=0.07]。良性病灶的最大徑小于惡性病灶[(5.83±1.77)cmvs.(8.35±0.70)cm,t=-1.384、P=0.17]。30例胰腺惡性病變中,16例CA19-9升高,最高者>2 000 U/ml,其中2例伴癌胚抗原(carcinoembryonic antigen, CEA)升高;5例良性病變患者均無CA19-9升高。
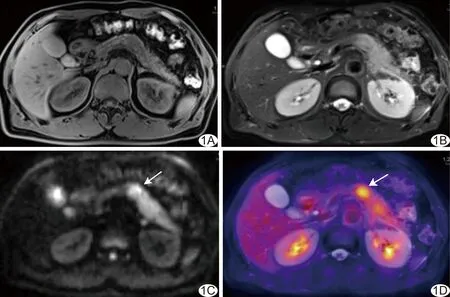
圖1 胰腺導管腺癌影像學表現 患者男,54歲,上腹部脹四、五天,夜間隱痛。CA19-9 41.93 kU/L,血淀粉酶170 U/L;胰體部占位,長徑約2.2 cm,T1WI脂肪抑制低信號(A),T2WI脂肪抑制呈高信號與胰尾分界不清,胰周脂肪間隙模糊為繼發性炎癥(B),DWI呈高信號(C),PET/MRI融合圖示病灶18F-FDG高攝取,SUVmax為4.73(D);手術病理為胰腺導管腺癌Ⅲ級,侵犯神經,浸潤胰周纖維脂肪組織,Ki-67(70%+) (箭示病灶)
2.2 影像學表現 38例單發胰腺惡性病灶的SUVmax為5.67±0.33,其中位于胰頭-鉤突部9例、體部10例、尾部12例、體尾部5例、頸體部2例;17例見胰管和/或肝內、外膽管不同程度擴張,12例見腫大的轉移淋巴結;25例病灶呈FS-T1低信號、FS-T2稍高信號,13例呈FS-T1稍低信號、FS-T2等高信號。
7例良性病變SUVmax為1.93±1.21,位于胰頭頸部3例、體尾部4例;其中3例合并胰管擴張(1例為胰管結石導致胰管梗阻性擴張,2例為胰腺導管內乳頭狀黏液性腫瘤的主胰管擴張),2例為囊性或囊性為主的囊實性病變,均未見腫大淋巴結。
2.3 診斷效能比較 根據ROC曲線(圖2),取3.20為SUVmax的截斷值時,18F-FDG PET/MRI診斷胰腺惡性病變的敏感度、特異度、準確率、陽性預測值和陰性預測值分別為89.47%(34/38)、85.71%(6/7)、88.89%(40/45)、97.14%(34/35)和60.00%(6/10);以1.78作為ADCmean的截斷值,上述各項分別為97.37%(37/38)、71.43%(5/7)、93.33%(42/45)、94.87%(37/39)和85.71%(6/7);聯合應用二者時,分別為100%(38/38)、71.43%(5/7)、95.56%(43/45)、95.00%(38/40)和100%(5/5)。SUVmax與ADCmean呈負相關(rs=-0.51,P<0.01)。
以SUVmax>3.20為標準時,1例胰頭部局灶性炎癥呈假陽性結果(圖3);4例假陰性均為糖尿病患者,其中G1級pNEN 1例(圖4)、肺腺癌術后胰腺轉移1例及胰頭癌2例。以ADCmean<1.78為標準時,2例呈假陽性,其中1例為胰腺炎后假性囊腫形成,1例為胰頭部局灶性炎癥;1例假陰性,為胰體癌繼發性胰腺炎。
15例PET/MR檢查前超聲、CT或MRI均未見肝、肺、骨及淋巴結轉移。PET/MRI顯示11例腹膜后或遠處淋巴結轉移伴肝轉移和/或其他部位轉移、2例腹膜轉移、1例雙側肺及胸膜多發轉移、1例多發骨轉移。根據18F-FDG PET/MRI結果,12例治療方案獲得修正,使其中6例存在廣泛遠處轉移和6例有明確腹膜后大血管侵犯者避免了不必要的外科手術。

圖2 SUVmax、ADCmean及二者聯合診斷胰腺惡性腫瘤的ROC曲線
3 討論
隗功華等[5]以2.95為SUVmax的截斷值判斷胰腺良、惡性病變,該組PET/CT檢測胰腺癌的敏感度為88.5%,特異度為85.0%;劉一等[6]以3.1為SUVmax的截斷值,其敏感度為89.2%,特異度為63.2%。TOFT等[8]的薈萃分析結果表明,PET和PET/CT診斷胰腺導管腺癌的敏感度、特異度和準確率分別為89%、70%和84%。本研究以3.20為SUVmax的截斷值時,一體化PET/MRI診斷胰腺惡性腫瘤的敏感度、特異度和準確率分別為89.47%、85.71%和88.89%,與上述研究相近。相比其他影像學表現,SUVmax的準確性較高,但存在一定假陽性和假陰性率。一些胰腺良性病變,如部分良性腫瘤、炎癥、肉芽腫或結核等也可表現為FDG高攝取,本組1例假陽性病灶為胰頭部局灶性炎癥,SUVmax為8.82。假陰性則可能與血糖水平、FDG攝取不明顯和葡萄糖-6-磷酸酶高表達等有關,本組4例假陰性均為糖尿病患者,其中3例病灶SUVmax降低、1例G1級pNEN無明顯攝取。薈萃分析[9-10]結果表明,癌癥患者標準攝取值與ADC之間存在負相關,且在胰腺癌中相關性較高。本研究結果顯示,一體化PET/MRI所示胰腺病變的SUVmax與ADCmean呈負相關,與上述研究相仿。鄭立春等[11]報道,PET/CT、MRI及二者聯合應用鑒別診斷胰腺良、惡性病變的準確率分別為83.58%、79.10%和88.06%;本組聯合SUVmax和ADCmean進行診斷時準確率達95.56%,高于單一SUVmax(88.89%)和ADCmean(93.33%)。

圖3 胰頭局灶性炎癥影像學表現 患者男,35歲,飲酒后腹痛、腹脹5日伴血淀粉酶升高。胰頭腹側見小片狀異常信號,T1WI FS呈稍低信號(A),T2WI FS呈稍高信號(B),DWI呈高信號(C),PET/MRI融合圖示18F-FDG明顯高攝取,SUVmax為8.82,高代謝區域較MR上顯示的信號異常范圍大,病灶邊界模糊,胰周脂肪間隙可見滲出(D) (箭示病灶)

圖4 pNEN影像學表現 患者男,48歲,無癥狀,CA724輕度升高。胰頸小結節,長徑約0.9 cm,邊界清楚,T2WI FS呈稍高信號(A),DWI呈高信號(B),PET/MRI融合圖未見明顯FDG攝取(C),增強掃描門脈期明顯強化(D)的特征可幫助定性診斷。手術病理為pNEN(G1),核分裂小于每10個高倍視野1個,Ki-67(<2%+) (箭示病灶)
除SUVmax或ADCmean外,鑒別診斷胰腺良、惡性腫瘤亦須綜合分析MRI表現。FDG-PET/CT+MRI融合圖像可顯著提高PET/CT診斷胰腺癌的準確性(96.6%vs.86.6%)[12]。融合圖像有助于鑒別胰腺癌與良性病變,特別是評估病變與其周圍組織的關系和檢出良性囊性病灶。DWI可更準確地判斷病變部位、范圍及侵襲程度[13-14]。本組1例G1級pNEN PET未見明顯FDG攝取,而DWI所見病變與周圍胰腺組織的對比更為顯著。
18F-FDG PET/MRI為全身掃描方式,對顯示胰周血管及臟器受侵也更有優勢,故用于判斷不可切除性胰腺癌的價值較高。JOO等[15]發現,術前評估胰腺癌時,PET/MRI與PET/CT+增強CT無明顯差異,而應用DWI可提高檢測淋巴結轉移的敏感度。本組18F-FDG PET/MRI后12例胰腺惡性病變患者的治療方案獲得修正,并避免了不必要的手術。
本研究的局限性:病例數有限,部分病例未獲得組織病理學結果,且良、惡性病例樣本量相差較大,均可能導致結果偏倚,有待擴大樣本量進一步分析。
綜上所述,一體化18F-FDG PET/MRI是檢測胰腺癌淋巴結和/或遠處轉移的較好方法;其參數SUVmax與ADCmean用于鑒別胰腺病變良、惡性腫瘤具有較高價值,聯合應用二者可提高診斷準確率。

