活性氧在腫瘤順鉑耐藥中的作用研究進展
岑鎧麗,陳 明,莢耘路,沈 朋
(浙江大學醫(yī)學院附屬第一醫(yī)院腫瘤內(nèi)科,浙江 杭州 310000)
順鉑是一種具有抗癌活性的金屬鉑類配合物。自1978年在美國批準上市后,被廣泛應(yīng)用于胃癌、卵巢癌和肺癌等多種實體腫瘤的治療[1]。但在治療過程中,大多數(shù)患者出現(xiàn)順鉑耐藥,不僅影響了順鉑的療效,還成為腫瘤復(fù)發(fā)的主要原因[2]。因此,明確順鉑耐藥的機制有助于研發(fā)新藥,改善臨床治療手段。
氧化應(yīng)激是順鉑發(fā)揮抗腫瘤效應(yīng)的主要機制之一。順鉑不僅能夠結(jié)合并消耗細胞內(nèi)的還原性物質(zhì),而且能與線粒體DNA形成絡(luò)合物,導(dǎo)致線粒體功能紊亂,活性氧(reactive oxygen species,ROS)產(chǎn)生增加,從而誘導(dǎo)氧化應(yīng)激,最終導(dǎo)致細胞死亡[2]。然而,腫瘤在不斷接受順鉑刺激并最終演變成耐藥細胞的過程中,ROS代謝異常與順鉑耐藥的發(fā)生密切相關(guān)。一方面,順鉑耐藥細胞通過促進順鉑外排、減少ROS產(chǎn)生、增加谷胱甘肽等還原物質(zhì)合成等降低順鉑誘導(dǎo)的氧化應(yīng)激,增強其對順鉑的抵抗。另一方面,細胞內(nèi)ROS還參與調(diào)控順鉑作用的多個環(huán)節(jié),包括順鉑的轉(zhuǎn)運、DNA損傷修復(fù)和信號通路等。本綜述將對順鉑耐藥腫瘤中的ROS代謝特點以及ROS對順鉑耐藥的調(diào)控機制進行闡述,并總結(jié)目前基于ROS代謝的治療策略,為提高順鉑的臨床療效提供參考。
1 順鉑耐藥腫瘤中的活性氧代謝
1.1 活性氧概述
ROS是氧分子衍生物的統(tǒng)稱,包括單線態(tài)氧、過氧化氫(H2O2)、羥自由基、超氧陰離子、一氧化氮和過氧亞硝基陰離子等[3]。在真核生物中,超氧陰離子往往是ROS的最初形式,但其性質(zhì)不穩(wěn)定,易轉(zhuǎn)化成相對較穩(wěn)定、長效的H2O2。因此,H2O2是細胞內(nèi)最主要的ROS形式[4]。正常情況下,細胞內(nèi)的ROS能夠維持在較低的生理水平,調(diào)控細胞增殖、遷移和血管生成等活動[5]。但當細胞內(nèi)ROS含量大幅度增加,遠超過細胞的生理水平以及代償范圍時,就會導(dǎo)致核酸和蛋白質(zhì)等發(fā)生氧化變性,導(dǎo)致細胞死亡[6]。
為維持氧化還原的動態(tài)平衡,細胞內(nèi)存在多種抗氧化系統(tǒng),主要包括:①谷胱甘肽(glutathione,GSH)系統(tǒng)。GSH由谷氨酸、半胱氨酸和甘氨酸合成,是細胞內(nèi)最豐富的還原性物質(zhì)[4],其與谷胱甘肽過氧化物酶(glutathione peroxidase,GPx)、谷胱甘肽還原酶(glutathione reductase,GR)以及NADPH共同組成了GSH還原系統(tǒng)。在GPx的作用下,還原型GSH提供電子轉(zhuǎn)化為氧化型谷胱甘肽(GSSG),同時,H2O2被還原生成水。而GSSG又能在GR的作用下,由NADPH提供電子,重新生成GSH[6]。② 硫氧還蛋白(thioredoxin,TRX)系統(tǒng)。TRX是小蛋白抗氧化劑,其與TRX還原酶(TRX reductase,TrxR)和NADPH組成硫氧還蛋白系統(tǒng),在生物中高度保守[7]。還原型TRX將H2O2還原成水,生成的氧化型TRX又能夠在TrxR作用下,由NADPH提供電子,重新還原成還原型TRX[8]。
1.2 順鉑作用下腫瘤細胞中ROS來源
1.2.1 線粒體電子傳遞鏈
目前研究認為,在多種類型的腫瘤細胞中,順鉑誘導(dǎo)的ROS主要來源于線粒體電子傳遞鏈。Marullo等[9]發(fā)現(xiàn),在線粒體DNA缺失的前列腺癌細胞中,順鉑誘導(dǎo)ROS生成的能力明顯下降,同時該類腫瘤對順鉑的敏感性也減弱。Kleih等[10]在卵巢腫瘤中發(fā)現(xiàn),順鉑能夠通過促進線粒體生成來提高線粒體ROS水平,而用寡霉素A(ATP合酶抑制劑)抑制線粒體氧化磷酸化,能夠有效降低線粒體ROS水平以及順鉑的細胞毒性。表明線粒體電子傳遞鏈在順鉑誘導(dǎo)的氧化應(yīng)激中發(fā)揮了重要作用。
1.2.2 NADPH氧化酶
NADPH氧化酶(NADPH oxidase,NOX)也是順鉑作用下細胞內(nèi)ROS的重要來源[11]。研究表明,NOX蛋白家族由NOX1~NOX5及雙氧化酶1和雙氧化酶2組成,它們能夠利用供體NADPH將其電子傳遞給分子氧,從而生成超氧陰離子[5]。然而,NOX表達具有組織特異性。如,NOX2在肺泡上皮組織中高表達,介導(dǎo)順鉑作用下肺癌細胞內(nèi)ROS產(chǎn)生[12]。而膠質(zhì)瘤組織中則高表達NOX4,通過提高細胞內(nèi)ROS促進腫瘤對順鉑的應(yīng)答[13-14]。
1.3 順鉑耐藥腫瘤中ROS的代謝異常
在順鉑治療過程中,腫瘤細胞會逐漸適應(yīng)并調(diào)整細胞內(nèi)的ROS代謝活動,最終導(dǎo)致順鉑耐藥。研究發(fā)現(xiàn),在順鉑耐藥的腫瘤中,順鉑誘導(dǎo)ROS的能力明顯下降[15]。可歸結(jié)于以下3個方面機制。
1.3.1 胞內(nèi)順鉑的累積減少
目前為止,多種順鉑轉(zhuǎn)運體被相繼報道,它們能夠參與順鉑的跨膜運輸。按功能可分為攝取型和外排型2類。
銅離子轉(zhuǎn)運體 1(copper transporter 1,Ctr1)是細胞攝取銅離子的主要轉(zhuǎn)運體,也是腫瘤細胞主動攝取順鉑的主要轉(zhuǎn)運體[16]。在順鉑耐藥的卵巢腫瘤中,Ctr1蛋白不僅表達下降,且易發(fā)生核心巖藻糖基化修飾,導(dǎo)致其對順鉑的攝取能力降低[17-19]。ATP7A和ATP7B是P-型銅外排ATP酶,被證明能夠分別介導(dǎo)早期和晚期順鉑外排活動[20-21]。在部分順鉑耐藥的腫瘤中存在ATP7A和ATP7B高表達,與其耐藥特性密切相關(guān)[22-23]。此外,ATP結(jié)合盒(ATP-binding cassette,ABC)轉(zhuǎn)運蛋白家族成員中的ABCB1、ABCC1和ABCG2等,亦被證明參與順鉑等化療藥物的外排,與腫瘤的多藥耐藥相關(guān)[24]。
攝取型轉(zhuǎn)運體減少,外排型轉(zhuǎn)運體增加,導(dǎo)致腫瘤細胞內(nèi)順鉑累積減少,氧化應(yīng)激誘導(dǎo)受限,是介導(dǎo)順鉑耐藥的重要機制之一[2]。
1.3.2 ROS生成減少
線粒體和NOX作為細胞內(nèi)ROS的主要來源,其含量以及功能異常會直接影響順鉑誘導(dǎo)下ROS的產(chǎn)生,調(diào)控腫瘤耐藥。Kleih等[10]發(fā)現(xiàn),相較于親本細胞,順鉑耐藥的卵巢腫瘤細胞線粒體含量明顯減少,同時在順鉑刺激下產(chǎn)生ROS的能力也明顯下降。在順鉑耐藥的骨肉瘤中,DNA脫嘌呤或嘧啶位點核酸內(nèi)切酶在線粒體中富集,它通過抑制小GTP結(jié)合蛋白RAC1磷酸化,從而減少線粒體ROS的產(chǎn)生[25]。此外,在順鉑耐藥的卵巢腫瘤和肺癌中,極性蛋白scribble表達減少,其能夠通過富含亮氨酸的重復(fù)片段結(jié)構(gòu)域與NOX2結(jié)合,防止NOX2被蛋白酶體降解[25]。Pan等[26]發(fā)現(xiàn),在多種腫瘤細胞系中,肌醇-三磷酸3-激酶B的蛋白表達水平與腫瘤對順鉑的耐受程度呈正相關(guān)。機制上,其代謝產(chǎn)物肌醇1,3,4,5-四磷酸鹽能夠競爭性結(jié)合并抑制NOX4的活性,從而減少ROS的產(chǎn)生。
1.3.3 還原性物質(zhì)增加
腫瘤細胞內(nèi)還原性物質(zhì)增加,也是導(dǎo)致ROS代謝異常的重要原因。核轉(zhuǎn)錄因子紅系2相關(guān)因子2(nuclear factor-erythroid 2-related factor 2,Nrf2)是細胞內(nèi)重要的抗氧化組分,其在腫瘤細胞中的高表達被證明與順鉑耐藥密切相關(guān)[27-28]。作為轉(zhuǎn)錄因子,Nrf2能夠促進多種抗氧化相關(guān)基因的轉(zhuǎn)錄,如過氧化氫酶和超氧化物歧化酶等,緩解細胞內(nèi)的氧化應(yīng)激,從而削弱順鉑的抗腫瘤效應(yīng)[29]。GPx是機體內(nèi)廣泛分布的過氧化物分解酶,能通過催化GSH,將有毒的過氧化物還原為無毒的羥基化合物[30]。研究表明,GPx1[31]和 GPx2[32]在順鉑耐藥的肺癌細胞系中高表達,通過降解細胞內(nèi)的ROS來介導(dǎo)腫瘤對順鉑耐藥。溶質(zhì)載體蛋白家族7成員A11(solute carrier family 7 member 11,SLC7A11)是細胞氨基酸轉(zhuǎn)運系統(tǒng)Xc-的功能性亞基,介導(dǎo)細胞對胱氨酸的攝取,參與胞內(nèi)GSH的合成。研究表明,順鉑耐藥的胃癌細胞高表達SLC7A11,采用柳氮磺吡啶(SLC7A11抑制劑)能夠明顯提高腫瘤細胞內(nèi)ROS水平,降低GSH水平,增加細胞對順鉑的敏感性[33]。谷胱甘肽 S 轉(zhuǎn)移酶(glutathione S-transferase,GST)是GSH合成的關(guān)鍵酶。在順鉑耐藥的腫瘤細胞中,GST活性明顯提高,敲減GST能夠降低腫瘤對順鉑的耐藥[34]。H-鐵蛋白亦是抗氧化系統(tǒng)的重要組成成分,它能夠包裹細胞內(nèi)鐵,從而抑制鐵離子介導(dǎo)ROS產(chǎn)生[35]。Salatino等[36]發(fā)現(xiàn),H-鐵蛋白在順鉑耐藥的OVCAR3卵巢癌細胞中表達增加,表明其參與了腫瘤順鉑耐藥的調(diào)控。
2 活性氧調(diào)控腫瘤順鉑耐藥的機制
目前研究認為,ROS是腫瘤進展過程中的一把雙刃劍。一方面,ROS是多種化療藥物發(fā)揮抗腫瘤效應(yīng)的主要機制之一[37],另一方面,ROS能夠調(diào)節(jié)順鉑作用的諸多環(huán)節(jié),如上調(diào)順鉑轉(zhuǎn)運體的表達、增強細胞DNA損傷修復(fù)能力、提高Nrf2和低氧誘導(dǎo)因子1α(hypoxia inducible factor-1α,HIF-1α)的蛋白水平和轉(zhuǎn)錄活性以及調(diào)控線粒體動態(tài)活動等,最終影響腫瘤的耐藥進程。
2.1 上調(diào)順鉑轉(zhuǎn)運體表達
研究表明,在非小細胞肺癌中,限糖[38]和表沒食子兒茶素沒食子酸酯[39]能夠通過增加細胞內(nèi)ROS上調(diào)Ctr1蛋白表達,從而促進順鉑在胞內(nèi)的累積,增加腫瘤對順鉑敏感性。然而,同樣也是在非小細胞肺癌,高表達的EF手域家族成員D2則通過上調(diào)NOX4/ROS/ABCC1通路來促進順鉑外排,從而介導(dǎo)順鉑耐藥[40]。低氧條件誘導(dǎo)的ROS則能通過提高HIF-1α水平,促進ABCB1和ABCC1轉(zhuǎn)錄,促進順鉑的外排[41]。此外,在頭頸部鱗癌中,跨膜蛋白16A(Ca2+激活的氯離子通道)能夠通過上調(diào)NOX2來促進提高細胞內(nèi)ROS,后者能夠上調(diào)ATP7B表達,減少順鉑的胞內(nèi)累積,介導(dǎo)順鉑耐藥[42]。以上研究表明,細胞內(nèi)ROS對順鉑轉(zhuǎn)運體的調(diào)控可能受多種因素影響,如刺激的種類、腫瘤細胞品系、細胞內(nèi)ROS升高幅度、持續(xù)時間及ROS產(chǎn)生的部位。
2.2 增強細胞DNA損傷修復(fù)能力
DNA損傷應(yīng)答包括細胞對損傷的感知、信號的轉(zhuǎn)導(dǎo)以及修復(fù)或者死亡程序的執(zhí)行等多個過程[43]。應(yīng)答初期,損傷信號能夠招募并激活共濟失調(diào)毛細血管擴張突變蛋白[44]、共濟失調(diào)毛細血管擴張突變和RAD3相關(guān)蛋白(ataxia telangiectasia-mutated and Rad3 related factor,ATR)等損傷識別蛋白[45],通過細胞周期檢測點激酶1(checkpoint kinase1,Chk1)和Chk2等轉(zhuǎn)導(dǎo)損傷信號,調(diào)控細胞周期檢查點蛋白活性,導(dǎo)致細胞周期阻滯[46]。與此同時,多種修復(fù)程序,包括核苷酸切除修復(fù)、同源或非同源重組修復(fù)等啟動,開始修復(fù)損傷的DNA。若DNA損傷被修復(fù),細胞則重新進入細胞周期;但當DNA損傷超過了自身的修復(fù)能力,損傷信號持續(xù)存在,Chk1/Chk2能夠通過激活p53等下游信號,啟動細胞死亡相關(guān)程序[47]。因此,ROS對細胞命運的調(diào)控也受細胞本身損傷修復(fù)能力的影響。一方面,ROS能夠介導(dǎo)多種理化因素,如電離輻射及蒽環(huán)類和順鉑等化療藥物對細胞DNA造成不可逆損傷,直接導(dǎo)致細胞死亡[48]。另一方面,ROS也能通過激活細胞內(nèi)DNA損傷應(yīng)答,啟動多種修復(fù)相關(guān)程序,從而維持基因組的完整性[49]。在卵巢腫瘤中,ROS能夠通過激活A(yù)TR/Chk1通路,促進DNA損傷修復(fù),從而介導(dǎo)對順鉑耐藥[50]。在結(jié)腸癌和肝癌中,ROS也能夠通過激活組蛋白去乙酰化酶,使尿嘧啶DNA糖苷酶2上第78位賴氨酸去乙酰化,減少其被泛素化降解,而后者則能夠切除DNA分子上錯誤形成的胞嘧啶堿基,是堿基切除修復(fù)的重要組分[51]。此外,ROS還能夠通過促進RNA去甲基化酶ALKB同源蛋白5類泛素化,從而抑制其功能,導(dǎo)致細胞整體mRNA m6A水平增加,促進DNA修復(fù)相關(guān)基因表達,以保持基因完整性[52]。
2.3 提高Nrf2蛋白水平和轉(zhuǎn)錄活性
Nrf2是細胞內(nèi)抗氧化系統(tǒng)的重要組成之一。正常情況下,Nrf2與Keap1-cullin3-E3泛素連接酶復(fù)合體結(jié)合,通過蛋白酶體系統(tǒng)降解,維持在低水平穩(wěn)態(tài)。但當細胞內(nèi)ROS水平提高時,Nrf2與復(fù)合體解離,入核并啟動下游基因的轉(zhuǎn)錄[37]。Nrf2異常表達與腫瘤順鉑耐藥密切相關(guān),抑制Nrf2也被認為是克服腫瘤順鉑耐藥的治療手段。在非小細胞肺癌中,高表達的孕激素和脂聯(lián)素分子受體家族4能夠通過抑制Nrf2與Keap1結(jié)合,從而促進Nrf2入核轉(zhuǎn)錄NADPH醌氧還原酶1、谷氨酸-半胱氨酸連接酶重鏈亞基及修飾亞基、GR和TrxR等抗氧化蛋白,增強腫瘤對順鉑的耐受[53]。此外,絲裂原活化蛋白激酶磷酸酶1能夠與Nrf2結(jié)合并抑制其被泛素化降解,從而促進細胞內(nèi)GSH合成,提高細胞糖酵解代謝,增加腫瘤細胞對順鉑的耐受[54]。在順鉑耐藥的胃癌細胞中,轉(zhuǎn)錄激活因子3低表達與腫瘤的不良預(yù)后相關(guān),而過表達轉(zhuǎn)錄激活因子3則能通過抑制Nrf2/Keap1/SLC7A11通路而增加腫瘤對順鉑的敏感性[55]。此外,Nrf2還能夠通過調(diào)控順鉑轉(zhuǎn)運蛋白 ABCG2[56]和 ABCB1[57]影響腫瘤對化療藥物的敏感性。
2.4 提高HlF-1α蛋白水平和轉(zhuǎn)錄活性
在血管平滑肌細胞中,ROS能夠降低細胞內(nèi)的抗壞血酸鹽,而后者能夠增加HIF-1α脯氨酰羥化酶活性,促進HIF-1α降解[58]。此外,在結(jié)腸癌中,溶質(zhì)載體蛋白家族34成員A2(solute carrier family 34 member 2,SLC34A2)對HIF-1α表達的調(diào)控也依賴于ROS,使用抗氧化劑丁基羥基茴香醚能夠下調(diào)SLC34A2過表達的結(jié)腸癌細胞中HIF-1α的蛋白水平[59]。而作為轉(zhuǎn)錄因子,HIF-1α能夠促進多種耐藥相關(guān)基因轉(zhuǎn)錄。在結(jié)腸癌中,HIF-1α能夠通過轉(zhuǎn)錄Zeste基因增強子人類同源物2來介導(dǎo)結(jié)腸癌對順鉑的耐藥[60]。此外,在膀胱癌中,HIF-1α被證明能夠通過促進miR-424轉(zhuǎn)錄來抑制UNC5同源家族B和去乙酰化酶4的表達,從而降低腫瘤細胞對順鉑的應(yīng)答[61]。免疫球蛋白樣和上皮生長因子樣域酪氨酸激酶1(tyrosine kinase with immunoglobulin-like and EGF-like domains 1,Tie1)曾被證明能夠通過增強細胞核苷酸切除修復(fù)能力來介導(dǎo)對順鉑等DNA 損傷藥物耐藥[62]。Li等[63]發(fā)現(xiàn),在非小細胞肺癌中,HIF-1α能夠通過直接結(jié)合Tie1基因上游的缺氧反應(yīng)元件,從而促進Tie1轉(zhuǎn)錄,介導(dǎo)腫瘤干細胞性以及順鉑耐藥。此外,HIF-1α還能通過促進自噬相關(guān)蛋白4B[64]、真核細胞翻譯起始因子5A2[65]等自噬相關(guān)基因的轉(zhuǎn)錄,啟動細胞保護性自噬,介導(dǎo)腫瘤對順鉑的耐受。
2.5 調(diào)控線粒體動態(tài)活動
線粒體是真核細胞的能量代謝中心,同時在細胞凋亡進程中發(fā)揮重要作用,其數(shù)量、形態(tài)和功能受到多種因素的精密調(diào)控[66]。其中,ROS能夠通過調(diào)控細胞線粒體的動態(tài)活動來影響細胞代謝以及凋亡等進程,從而影響腫瘤對順鉑敏感性。過氧化物酶體增殖物激活受體γ共激活物1α(peroxisome proliferator-activated receptor gamma coactivator-1α,PGC-1α)能夠通過促進核轉(zhuǎn)錄復(fù)合體以及線粒體DNA轉(zhuǎn)錄相關(guān)因子的形成,來調(diào)節(jié)線粒體關(guān)鍵蛋白的合成,因而是線粒體生成的重要蛋白[67]。在非小細胞肺癌[68]和卵巢腫瘤[69]中,ROS能夠通過提升PGC-1α的表達,增加線粒體數(shù)量,提高線粒體內(nèi)膜電位,同時促進細胞代謝向氧化磷酸化轉(zhuǎn)化,導(dǎo)致耐藥腫瘤的形成。此外,在卵巢腫瘤中,ROS還能夠促進動力相關(guān)蛋白1依賴的線粒體分裂,介導(dǎo)順鉑耐藥[70]。而在頭頸部鱗狀細胞癌中,ROS則能通過提高HIF-1α水平來促進線粒體分裂相關(guān)因子轉(zhuǎn)錄,從而介導(dǎo)線粒體分裂,增加腫瘤對順鉑的敏感性[71]。腫瘤壞死因子受體相關(guān)蛋白 1(tumor necrosis factor receptor-associated protein 1,TRAP1)是一種線粒體熱休克蛋白,能通過減少線粒體ROS的產(chǎn)生降低化療藥物對腫瘤細胞的殺傷[72]。順鉑耐藥肺癌細胞TRAP1高表達,抑制TRAP1后能夠有效提高順鉑作用下線粒體ROS的水平,降低線粒體膜電位,促進細胞色素c的釋放,導(dǎo)致細胞凋亡[73](圖1)。
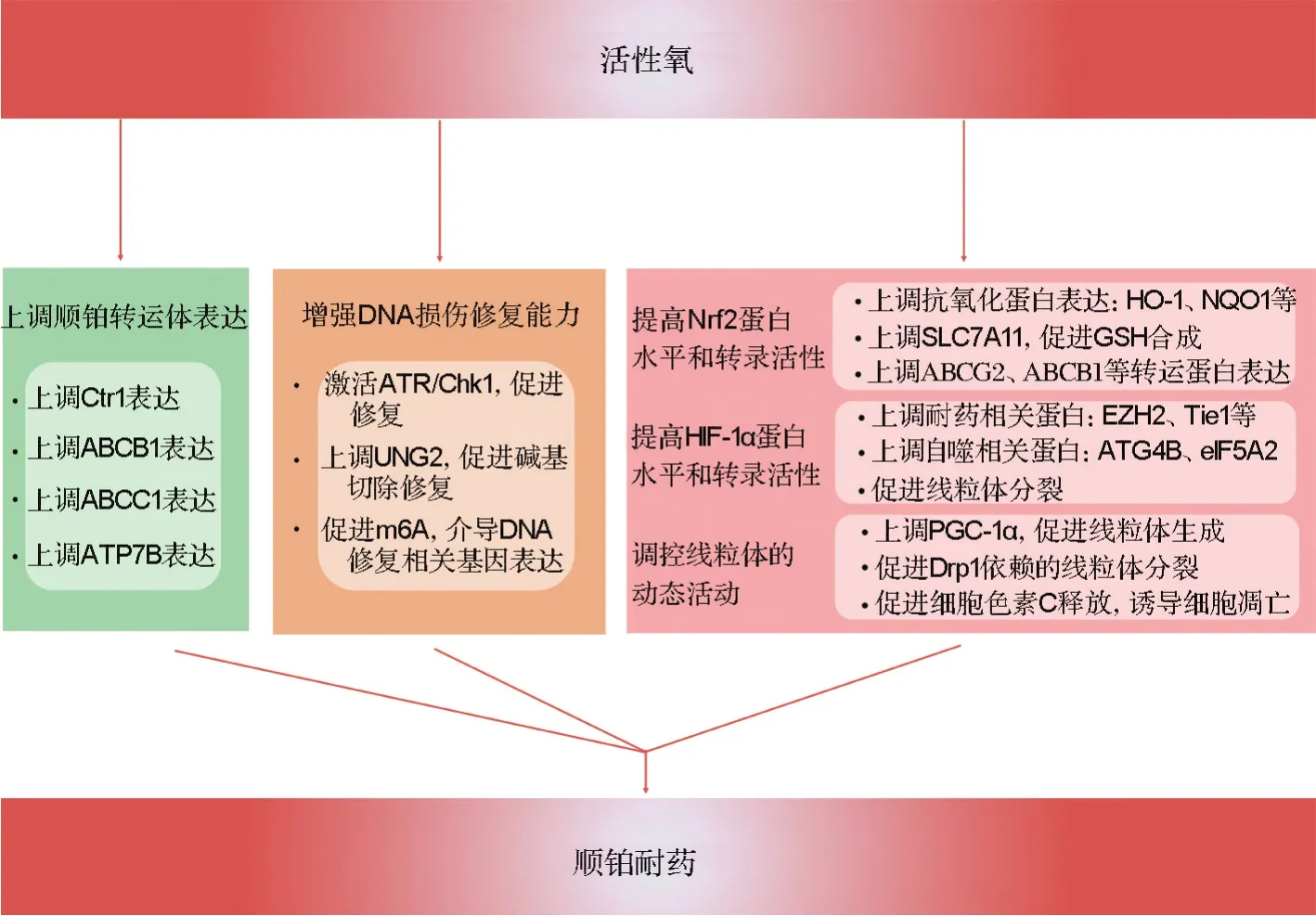
圖1 活性氧調(diào)控腫瘤順鉑耐藥的機制.Ctr1:銅離子轉(zhuǎn)運體1;ABCB1:ATP結(jié)合盒亞家族B成員1;ABCC1:ATP結(jié)合盒亞家族C成員1;ATR:共濟失調(diào)毛細血管擴張突變和RAD3相關(guān)蛋白;Chk1:細胞周期檢測點激酶1;UNG2:尿嘧啶DNA糖苷酶2;m6A:N6-腺苷酸甲基化;Nrf2:核轉(zhuǎn)錄相關(guān)因子紅系2;HO-1:血紅素氧合酶1;NQO1:NADPH醌氧還原酶1;SLC7A11:溶質(zhì)載體蛋白家族7成員A11;GSH:谷胱甘肽;ABCG2:ATP結(jié)合盒亞家族G成員2;HIF-1α:低氧誘導(dǎo)因子1α;EZH2:Zeste基因增強子人類同源物2;Tie1:免疫球蛋白樣和上皮生長因子樣域酪氨酸激酶1;ATG4B:自噬相關(guān)蛋白4B;eIF5A2:真核細胞翻譯起始因子5A2;PGC-1α:過氧化物酶體增殖物激活受體γ輔激活物1α;Drp1:動力相關(guān)蛋白1.
3 靶向ROS的腫瘤治療新策略
基于耐藥腫瘤中ROS的代謝特點以及ROS調(diào)控腫瘤順鉑耐藥的機制,目前已有大量的藥理學研究據(jù)此展開,按照其作用機制可分為ROS誘導(dǎo)劑和抗氧化系統(tǒng)抑制劑2類(表1)。

表1 通過調(diào)節(jié)細胞內(nèi)ROS促進順鉑增敏的藥物
3.1 ROS誘導(dǎo)劑
ROS誘導(dǎo)劑是指在聯(lián)合順鉑后,能夠大幅度提高腫瘤內(nèi)ROS水平,使其達到細胞毒性水平的藥物。在舌鱗癌中,褪黑素(melatonin)聯(lián)合順鉑能夠明顯提高細胞內(nèi)ROS水平,相較順鉑單用組,聯(lián)合用藥能夠誘導(dǎo)更多的腫瘤細胞發(fā)生凋亡[74]。在喉鱗癌中,姜黃素(curcumin)聯(lián)合順鉑能夠進一步提高腫瘤細胞和線粒體ROS水平,最終導(dǎo)致腫瘤細胞死亡[75]。此外,唑來膦酸(zoledronic acid)[76]、靈芝酸D(ganoderic acid D)[77]、白花丹素(plumbagin)[78]和蓽拔酰胺(piperlongumine)[79]等其他多種藥物亦有相似報道。
3.2 抗氧化系統(tǒng)抑制劑
抗氧化系統(tǒng)抑制劑是指能夠通過抑制細胞內(nèi)的抗氧化分子,間接提高細胞內(nèi)ROS的藥物。Nrf2作為細胞內(nèi)主要的抗氧化蛋白,曾被證明是多種順鉑增敏藥物的作用靶點。在胃癌中,猶素修飾系統(tǒng)關(guān)鍵蛋白是預(yù)后良好的標志。它能夠通過泛素化降解Nrf2,減少下游醛酮還原酶的轉(zhuǎn)錄,從而提高順鉑作用后細胞內(nèi)ROS水平,增加胃癌對順鉑的敏感性[80]。氟米松(flumethasone)[81]和葫蘆巴堿(trigonelline)[82]能夠分別通過降低細胞內(nèi) Nrf2 表達水平和功能,從而增加腫瘤對順鉑的敏感性。除Nrf2外,其他抗氧化蛋白也是作為順鉑增敏劑的潛在靶點。在結(jié)腸癌細胞中,異脫氧象皮素(isodeoxyelephantopin)能夠通過抑制TrxR1的活性,提高細胞內(nèi)ROS水平[83]。在肺癌中,敲除GPx4或者采用GPx4抑制劑RSL3能夠有效增加腫瘤細胞對順鉑的敏感性并促進細胞發(fā)生鐵死亡[84]。ent-貝殼杉烷類二萜(ent-kaurane diterpenoids)則能夠通過直接結(jié)合GSH并抑制其還原性,逆轉(zhuǎn)肺癌對順鉑的耐藥[85]。此外,Kawahara等[86]還設(shè)計了一種新型的一氧化碳搭載系統(tǒng),在可見光誘導(dǎo)下,該系統(tǒng)能夠在腫瘤局部釋放一氧化碳,后者能夠通過抑制胱硫醚β-合成酶,降低細胞內(nèi)GSH以及金屬硫蛋白的水平,從而逆轉(zhuǎn)卵巢腫瘤順鉑耐藥。Chen等[87]設(shè)計了一種包含順鉑和GST抑制劑的鉑(IV)前藥,它能夠在順鉑耐藥的肺癌細胞中造成更多的DNA損傷,介導(dǎo)腫瘤細胞死亡。
4 結(jié)語
順鉑是多種實體瘤臨床化療方案的基石,但是順鉑的耐藥問題極大地限制了它的臨床療效。因此,克服順鉑耐藥是亟待解決的一大臨床難題。目前為止,很多研究提示,ROS代謝異常是順鉑耐藥的重要機制,一方面腫瘤能夠通過多種機制降低細胞內(nèi)活性氧,增強對化療藥物的耐受,另一方面活性氧本身在腫瘤對順鉑耐藥形成過程中亦發(fā)揮了重要作用,然而相關(guān)的分子機制仍有待進一步完善和研究。此外,ROS水平作為衡量腫瘤對順鉑等化療藥物應(yīng)答能力的重要標志,如何在臨床中構(gòu)建基于ROS水平的評價體系,改進化療藥物療效預(yù)估和評價也仍需進一步探索。相信ROS相關(guān)分子機制的闡明以及新型藥物的研發(fā),定能為逆轉(zhuǎn)腫瘤順鉑耐藥提供更有效的治療策略和方案。

