2,4-二硝基氯苯誘導BALB/c小鼠特應性皮炎模型的建立
鄭心茹 張曉清 楊 洋 王吉魁 韓 雪
(1.中國醫科大學醫學基礎實驗教學中心,沈陽 110122)(2.遼寧電力中心醫院普外科,沈陽 110057)
特應性皮炎(atopic dermatitis,AD)是一種常見的瘙癢性炎癥性皮膚病,其主要臨床表現為皮膚紅斑、斑塊。在過去的幾十年中,特應性皮炎的發病率逐年增加,它已成為全球性的健康問題。AD發病原因復雜,涉及皮膚局部及全身的免疫系統失衡、皮膚屏障功能障礙、環境因素以及神經心理因素等。因此目前特應性皮炎的治療仍具有一定的難度和挑戰性。
小鼠特應性皮炎模型已經成為研究此疾病發病機制、評價研發藥物安全性與有效性等生物醫藥研究不可取代的模式動物。一個成功的動物模型應該具有盡可能多的與人體疾病相似的特點,迄今為止,小鼠的AD模型建立主要有以下幾種方法,科學家發現了一類能夠自然發展為AD樣皮損的近交系小鼠模型,如Nc/Nga小鼠及Flaky Tail小鼠等,這類模型主要與保障皮膚完整性的相關基因缺失或者突變相關;過表達或缺失目的基因的基因工程小鼠模型,這類模型僅是在單一通路上活化或抑制,在疾病表現上與人類AD臨床表現仍有一定的出入,并且仍需要特定抗原誘導,這使其在AD研究中的使用受到限制;最常見的一類小鼠模型是通過皮膚局部致敏物質誘導的AD模型,如DNCB、DNFB、TNCB及OXA等,這類半抗原更易穿透皮膚,相比較之下利用致敏物質誘導的方法顯得更為經濟及方便。
近些年來有文獻報道,以半抗原2,4-二硝基氯苯(2,4-dinitrochlorobenzene,DNCB)致敏激發小鼠可成功建立特應性皮炎模型。本研究利用DNCB作為致敏原,探討不同的給藥濃度以及給藥時間之間的差異,以尋求DNCB誘導AD模型的最適條件,為研究AD的發病機制及治療方法提供依據和幫助。
1 材料和方法
1.1 實驗動物
雌性SPF級BALB/c小鼠(8~10周),由遼寧長生實驗動物有限公司提供,實驗動物生產許可證號【SCXK(遼)2020-0001】,使用許可證號【SYXK(遼)2018-0008】。飼養于清潔級環境中,環境溫度為22 ℃~25 ℃,濕度為50%~65%,利用12 h∶12 h晝夜間斷照明,小鼠食用標準飼料,隨意飲水進食。小鼠進行一周適應性飼養后再進行實驗。
1.2 主要實驗試劑與儀器
2,4-二硝基氯苯(DNCB)(Sigma公司);細胞因子ELISA試劑盒(R&D公司);IgE ELISA試劑盒(Invitrogen公司);基質溶液為丙酮和橄欖油4∶1的比例配制而成;酶標儀iMark、RT PCR儀CFX96 TOUCH(伯樂公司)。
1.3 方法
1.3.1動物分組及模型建立:造模前一天對所有小鼠背部皮膚進行剃毛處理,范圍約2 cm×4 cm。將實驗組小鼠分為A~D 4組,每組6只。初期涂抹200 μL DNCB溶液致敏(基質液丙酮∶橄欖油=4∶1),間隔幾天后200 μL DNCB溶液激發,對照組小鼠涂抹相同劑量的基質溶液。末次激發給藥后24 h處死小鼠取材。完整摘取小鼠脾及體質量,用電子天平稱脾重量,并計算小鼠脾指數【脾指數=脾重量(mg)/體質量(g)】。各組給藥濃度及涂抹的時間見表1。

表1 各實驗組致敏階段、激發階段給藥濃度及給藥時間
1.3.2皮膚組織炎癥評分:小鼠末次給藥后,肉眼觀察每只小鼠皮膚炎癥程度,根據以下幾種癥狀進行判定:水腫、紅斑/出血、潰爛/表皮脫落、結痂/干燥。每種癥狀按照0分(無)、1分(輕度)、2分(中度)和3分(嚴重)進行評分,最終評分按照幾種癥狀評分相加之和進行統計。
1.3.3皮膚組織病理學檢查:取小鼠的背部皮膚組織,加入4%多聚甲醛固定,進行乙醇梯度脫水、二甲苯透明及石蠟包埋,制作4 μm厚切片,分別進行HE染色和甲苯胺藍染色。顯微鏡下觀察皮損處皮膚組織病理結構及上皮層厚度、細胞水腫、炎細胞以及肥大細胞浸潤水平。
1.3.4ELISA法檢測小鼠血清IgE水平:小鼠眼球取血,4 ℃放置2 h,10 000 r/min離心10 min。吸取上層血清放入-80 ℃冷凍備用。參照ELISA試劑盒說明書步驟檢測小鼠血清中IgE分泌水平。
1.3.5皮膚勻漿液細胞因子表達水平的檢測:取小鼠背部皮膚100 mg,加入1 mL PBS勻漿,1 500 r/min離心5 min。吸取勻漿上清液放入-80 ℃冷凍備用。參照ELISA試劑盒說明書檢測皮膚勻漿液中IL4、IL5及IL13分泌水平。
1.4 統計學分析

2 結果
2.1 各組小鼠皮膚表現
激發濃度最后一次給藥24 h后,選用最具代表性的病變進行評分。空白對照組小鼠背部皮膚外觀正常。與空白對照組相比A組可以發現小鼠背部皮膚水腫、有明顯紅斑、伴有少量潰爛。B組小鼠背部皮膚水腫,伴有部分表皮脫落。C組小鼠背部皮膚輕度水腫。D組小鼠背部皮膚明顯出現水腫、紅斑、粗糙、潰爛及結痂表現(圖1)。與空白對照組相比,A、B及D組皮炎評分顯著升高(P<0.01,P<0.001),與A、B及C組相比,D組小鼠皮膚改變嚴重程度明顯升高(P<0.001),C組與空白對照組相比P>0.05,無統計學差異(圖2)。

圖1 對照組和各模型組小鼠背部皮膚

注:與空白對照組相比,#P<0.01,##P<0.001;各模型組之間相互比較,*P<0.01, **P<0.001
2.2 各組小鼠脾指數比較
處死小鼠后測量小鼠脾及體質量,根據脾指數計算得出以下結果(圖3),在模型A組及D組小鼠中可見脾明顯增大,脾指數明顯升高(P<0.05,P<0.01),差異具有統計學意義。B組及C組脾指數無明顯增加(P>0.05),差異無統計學意義,與模型A組相比,模型D組脾指數升高明顯(P<0.05)。

注:與空白對照組相比,#P<0.05, ##P<0.01;各模型組之間相互比較,*P<0.05
2.3 各組小鼠皮膚病理學改變
組織病理結果(圖4)顯示:HE染色可見空白對照組背部皮膚結構完整,無細胞水腫及炎性細胞浸潤,模型A組小鼠皮膚棘層增厚,細胞內水腫,炎性細胞浸潤。B組小鼠皮膚棘層增厚,少量細胞水腫。C組小鼠皮層未見明顯增厚,僅可見少量細胞水腫及炎性細胞浸潤。D組小鼠皮膚棘層明顯增厚,細胞內水腫明顯,大量炎性細胞浸潤,皮膚結構不完整。甲苯胺藍(toluidine blue staining,TB染色)顯示肥大細胞浸潤水平,空白對照組背部皮膚未見明顯肥大細胞浸潤,模型組中均出現不同程度的肥大細胞浸潤,模型A及D組尤為明顯。
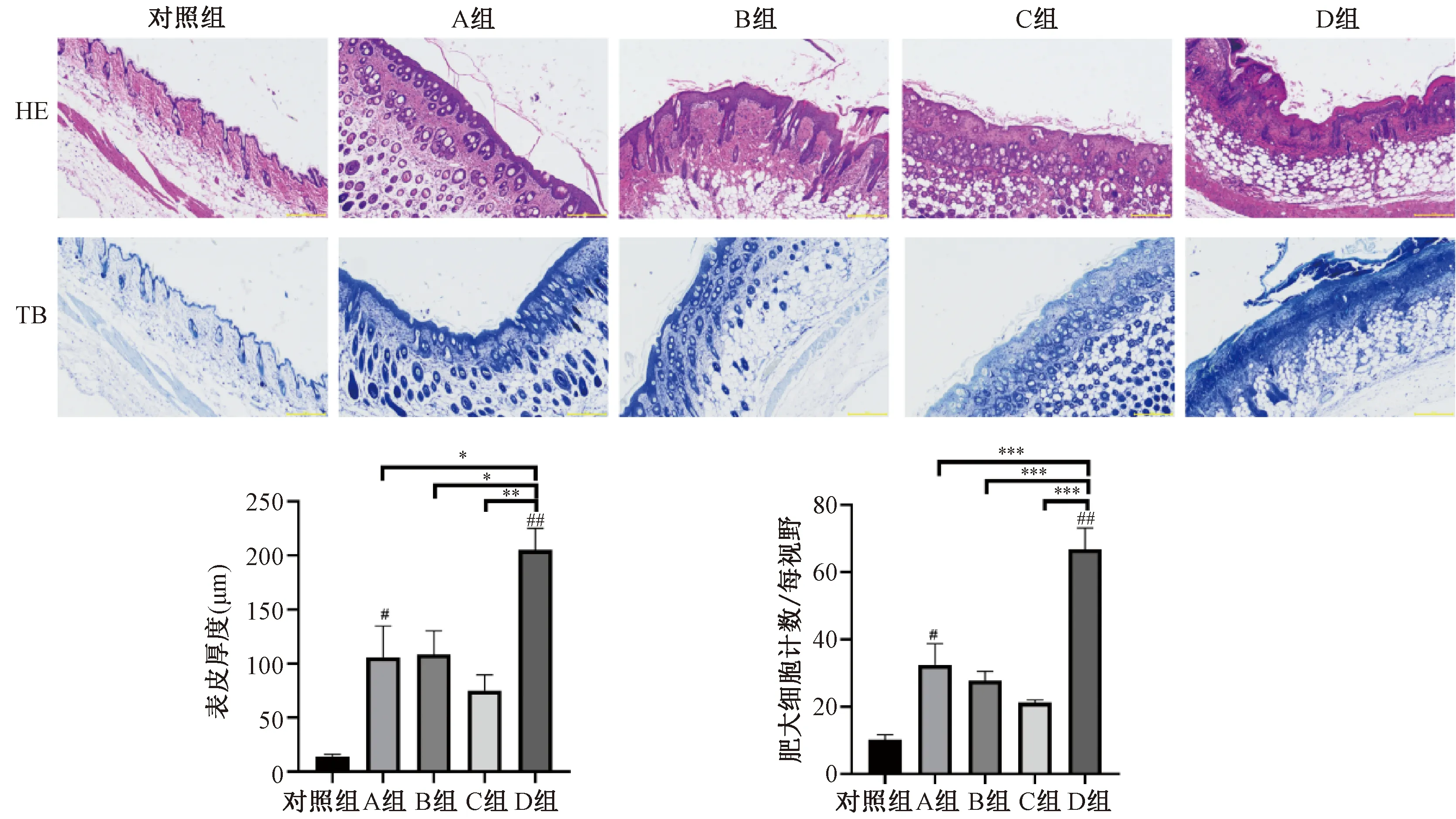
注:與空白對照組相比,#P<0.05, ##P<0.001;各模型組之間相互比較,*P<0.05,**P<0.01,***P<0.001
2.4 各組小鼠血清IgE水平比較
通過ELISA檢測了小鼠外周血中總IgE的水平。空白對照組小鼠血清IgE為(68.09±26.59)ng/mL,模型A組小鼠血清總IgE為(242.00±67.77)ng/mL,模型B小鼠血清總IgE為(227.26±26.13)ng/mL,模型C小鼠血清總IgE為(216.56±54.75)ng/mL,模型D小鼠血清總IgE為(337.53±70.19)ng/mL。4組模型組小鼠IgE水平均明顯高于空白對照組(P<0.05,P<0.01),模型D組與模型B組及C組相比IgE明顯升高(P<0.05,P<0.01),差異有統計學意義(圖5)。

注:與空白對照組相比,#P<0.05, ##P<0.01;各模型組之間相互比較,*P<0.05, **P<0.01
2.5 各組小鼠皮膚勻漿液細胞因子表達水平比較
由于AD是一個Th2型為主的免疫反應,在DNCB誘導的小鼠模型中,Th2型細胞因子也會出現明顯升高,通過ELISA檢測小鼠背部皮膚組織勻漿液中IL-4、IL-5、IL-13的水平,結果發現,IL-4在模型A、B、D組中濃度明顯高于空白對照組,IL-5、IL-13在4組模型組中濃度均明顯高于空白對照組(P<0.05,P<0.01,P<0.001)。對各模型組間的細胞因子也進行了統計分析(圖6)。

注:與空白對照組相比,#P<0.05, ##P<0.01, ###P<0.001;各模型組之間相互比較,*P<0.05, **P<0.01, ***P<0.001
3 討論
近年來,我國對于化學物質誘導形成特異性皮炎動物模型的已有較多研究報道。在動物模型的建立過程中,不同的動物品系、年齡、體質量和不同處理方式對建模成功與否以及指標檢測結果均有不同程度的影響[1]。為研究特異性皮炎的發病機制以及開發新的治療方法,迫切需要建立成功的AD動物模型,這對得出正確的實驗結論與服務更好的臨床治療具有重要意義。
特異性皮炎是一種以瘙癢為特征的慢性炎癥性疾病,其發病因素與遺傳、皮膚屏障功能障礙、免疫失調、皮膚微生態改變息息相關[2]。其臨床表現主要為皮膚出現明顯干燥,繼而出現紅斑、丘疹和水皰為表現,幾周后由于瘙癢引起搔抓反應進而皮膚出現糜爛或出現黃色痂皮,炎性反應色素減退現象。在外源性AD的急性期,由于外周血Th2水平增高[3],細胞因子IL-4、IL-5、IL-13表達水平增高,促使B細胞產生過量IgE,嗜酸粒細胞數量也增多,激活Toll樣受體,激發機體先天性免疫[4]。
在建立AD模型過程中,通常可使用卡泊三醇[5]、粉塵螨[6]和半抗原等物質進行誘導。本實驗中采用DNCB試劑,DNCB具有半抗原屬性,當其進入動物體內后,可與上皮蛋白的可溶部分進行共價結合,使其結合為完全抗原。完全抗原使機體產生致敏淋巴細胞。當DNCB再次進入體內時,致敏的淋巴細胞與其接觸便會產生過敏反應[7]。此過程在用于檢測細胞免疫功能的同時,也可以用來建立AD模型[8]。根據DNCB作用機制,本實驗中使用不同濃度的DNCB致敏及激發BALB/c小鼠背部,給藥天數也不同,根據小鼠致敏處皮膚炎癥程度及相關指標的檢測來判定小鼠特異性皮炎模型建立的最佳方法。
在末次激發濃度給藥24 h后,觀察可見致敏處皮膚出現不同程度的水腫、紅斑或出血、潰爛或表皮脫落、結痂或干燥。對比可見模型D組造模效果最好,其余A、B、C 3組效果依次較差。病理學檢測結果也與典型的特應性皮炎改變最為接近,相比與其他組改變也最為顯著。研究證實大多數AD患者血清IgE濃度高于健康人群,IgE濃度升高程度與AD皮損嚴重程度和廣度基本平行[9]。因此,血清IgE濃度常被作為AD動物模型評價的重要指標之一。本實驗通過ELISA法可測定小鼠血清IgE,通過對比可見,4組模型IgE濃度較空白對照組均有升高,模型D組的血清IgE濃度升高也最為明顯。由于細胞因子IL-4、IL-5、IL-13濃度也可呈現AD嚴重程度,本實驗也測定了這3項濃度,對比可見模型D組小鼠細胞因子IL-4、IL-5、IL-13表達水平最高[10-11]。
本實驗通過給予4組模型不同濃度及給藥時間,證實了初期涂抹0.5%DNCB溶液200 μL 3次,后期每次6 d間歇涂抹1%DNCB溶液200 μL,可實現較好的造模效果,與實際AD的疾病特點更為貼近。建立更加合適的動物模型可以幫助臨床更充分的認識AD對機體帶來的損害,更有利于分析及預測可出現的病理生理反應,對全面認識疾病的本質及對疾病的治療有重要意義。

