肝癌細胞低氧環境下分泌的外泌體對同源細胞活性的影響
李全富 夏天 石春薇 陳卓
(1武漢市第三醫院普外科,湖北 武漢 430000;2同濟醫學院病原微生物教研室)
原發性肝癌的全球發病率呈逐年增長趨勢,死亡率位居全部惡性腫瘤的第2位〔1〕。我國每年因肝癌死亡的患者數約占全球總死亡數的50%,高復發率和轉移率是不良預后的主要原因〔2〕。外泌體是直徑在30~150 nm之間的雙層膜性囊泡,含有mRNA、蛋白質等多種生物活性物質,其在腫瘤微環境中的作用是目前醫學領域的研究熱點之一〔3〕。相關研究顯示,外泌體在細胞與細胞信號傳遞中發揮重要作用,也是腫瘤細胞與腫瘤微環境信息交流的載體,在腫瘤發生、發展、耐藥產生中發揮重要作用〔4〕。但外泌體在低氧環境下對肝癌細胞的影響仍未明確。本研究旨在探討肝癌細胞低氧環境下分泌的外泌體對同源細胞活性的影響。
1 材料與方法
1.1主要材料與試劑 人肝癌細胞(HHCC)購于上海北諾生物科技有限公司;胎牛血清、RPMI1640培養基、胰蛋白酶購于維森特生物技術(南京)有限公司;CCK-8試劑盒購于上海宇淳生物有限公司;單克隆抗體CD9、CD63、CD81購于北京啟研生物有限公司;Transwell小室購于中科瑞泰(北京)生物科技有限公司。
1.2HHCC培養 胎牛血清在4℃、1×106r/min條件下恒溫離心2 h,室溫下靜置過夜,次日去除沉淀,得到無外泌體的胎牛血清。使用含10%無外泌體胎牛血清的RPMI1640培養基,在37℃、5%CO2、93%N2、5%O2的細胞培養箱中進行低氧培養。常氧HHCC用含10%胎牛血清的RPMI1640培養基,在37℃、5%CO2培養箱中培養。
1.3低氧環境下HHCC細胞上清液外泌體提取 將對數生長期HHCC接種于培養皿中,先使用含10%胎牛血清的RPMI1640培養基常規培養過夜,光學顯微鏡下觀察HHCC貼壁生長后,更換為含10%無外泌體胎牛血清的RPMI1640培養基,繼續培養48 h,從培養上清液中提取外泌體。提取方法:4℃、依次500 r/min 離心20 min,2 000 r/min離心10 min,12 000 r/min離心20 min,收集上清,過濾器(0.22 μm)處理后,4℃、1×106r/min離心2 h,棄去上清,使用磷酸鹽緩沖液(PBS)溶液重懸沉淀,再次4℃、1×106r/min離心2 h,沉淀物即為外泌體,使用PBS重懸后-80℃保存待用。
1.4低氧環境下HHCC外泌體投射電子顯微鏡鑒定 取HHCC細胞外泌體混懸液20 μl,加入5%多聚甲醛20 μl,混合均勻,取10 μl滴于TEM電鏡銅網,室溫條件下靜置30 min;使用PBS洗滌銅網,在網格上滴加5%戊二醛50 μl固定10 min,蒸餾水洗滌,2%醋酸雙氧鈾做負染色10 min,包被并晾干后在投射電子顯微鏡下觀察并拍照。
1.5Western印跡檢測外泌體特異性蛋白表達 取HHCC細胞外泌體混懸液50 μl,RIPA裂解液提取蛋白,進行十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE)分離,將目標蛋白轉至硝酸纖維素印跡膜,5%BSA封閉液處理1 h,滴加小鼠抗人CD9、CD63、CD81單克隆抗體,均為1∶500稀釋;小鼠抗人GAPDH單克隆抗體,1∶1 000稀釋;4℃過夜。雜交膜清洗液洗滌40 min,滴加辣根過氧化物酶標記的二抗,1∶2 000稀釋,室溫下孵育1 h,電化學發光(ECL)顯色,凝膠成像系統檢測各條帶灰度值。
1.6CCK-8檢測細胞增殖能力 將對數生長期HHCC接種于96孔板中,密度為1×104個/孔,常規孵育過夜,棄去培養液,外泌體組每孔加入含低氧環境下HHCC外泌體的RPMI1640完全培養基,空白對照組每孔僅加入RPMI1640完全培養基,每組設置5個復孔,分別培養24、48、72 h,棄去培養液,加入100 μl CCK-8工作液,孵育40 min,上酶標儀讀取450 nm處吸光度(OD)值。
1.7細胞遷移能力檢測 將對數生長期HHCC接種于6孔板中,密度為3×105個/孔,37℃、5%CO2培養箱中孵育,觀察細胞覆蓋培養孔90%以上時,用無菌移液槍頭進行劃痕實驗,PBS洗滌3次。外泌體組加入含低氧環境下HHCC外泌體的RPMI1640完全培養基,空白對照組每孔僅加入RPMI1640完全培養基,繼續培養12、24、48 h進行拍照測量。
1.8細胞侵襲能力檢測 基質膠與培養基按1∶3的比例混合,取50 μl包被Transwell小室底部膜。將對數生長期HHCC接種至Transwell小室,密度為3×104個/孔,外泌體組加入100 μl 含低氧環境下HHCC外泌體的RPMI1640培養基,空白對照組每孔僅加入等體積的RPMI1640培養基;Transwell小室下層加入500 μl 含10%胎牛血清的RPMI1640培養基。繼續培養48 h,多聚甲醛固定、結晶紫染色,光學顯微鏡下隨機選取8個視野,記錄細胞數并取平均值,每組設置5個復孔。
1.9統計學分析 使用SPSS23.0軟件進行t檢驗。
2 結 果
2.1低氧環境下HHCC外泌體的獲得與鑒定 電子顯微鏡觀察顯示,低氧環境下HHCC分泌的外泌體直徑為80~130 nm,外觀呈橢圓形或圓形,是雙層膜包被的囊泡小體。提取HHCC和外泌體中的總蛋白,進行Western印跡分析顯示,HHCC中外泌體相關標志蛋白CD9、CD63、CD81的相對表達量分別為0.82±0.08、0.80±0.05、0.74±0.06,符合HHCC自身分泌的外泌體表達特點。提示成功提取了低氧環境下HHCC分泌的外泌體。見圖1,圖2。

圖1 低氧環境下HHCC外泌體電子顯微鏡下觀察(×200)
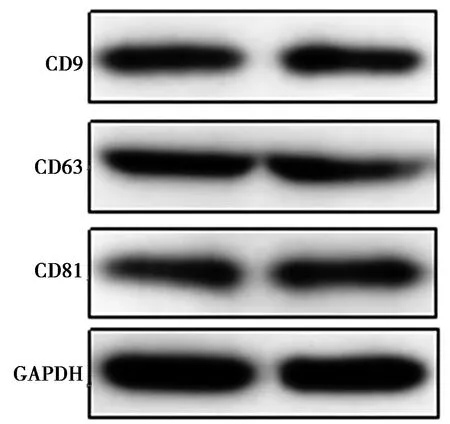
圖2 低氧環境下HHCC外泌體特異性蛋白Western印跡電泳
2.2低氧環境下HHCC外泌體對HHCC細胞增殖能力的影響 培養24 h內,外泌體組與空白對照組OD值差異無統計學意義(P>0.05);培養48、72 h,外泌體組HHCC OD值明顯高于空白對照組(P<0.05)。見表1。
表1 低氧環境下HHCC外泌體對HHCC細胞增殖能力的影響值)
2.3低氧環境下HHCC外泌體對HHCC遷移能力的影響 細胞劃痕實驗12 h,外泌體組與空白對照組細胞遷移距離差異無統計學意義(P>0.05);細胞劃痕實驗24、48 h,外泌體組細胞遷移距離明顯長于空白對照組(P<0.05)。見圖3,表2。

圖3 細胞劃痕實驗檢測兩組HHCC的遷移能力(×200)
表2 兩組HHCC遷移距離比較
2.4低氧環境下HHCC外泌體對HHCC侵襲能力的影響 培養48 h,外泌體組侵襲至Transwell小室膜下的HHCC細胞數為(116±20)個/高倍鏡視野,明顯多于對照組的(39±8)個/高倍鏡視野,差異有統計學意義(t=27.619,P=0.000)。見圖4。
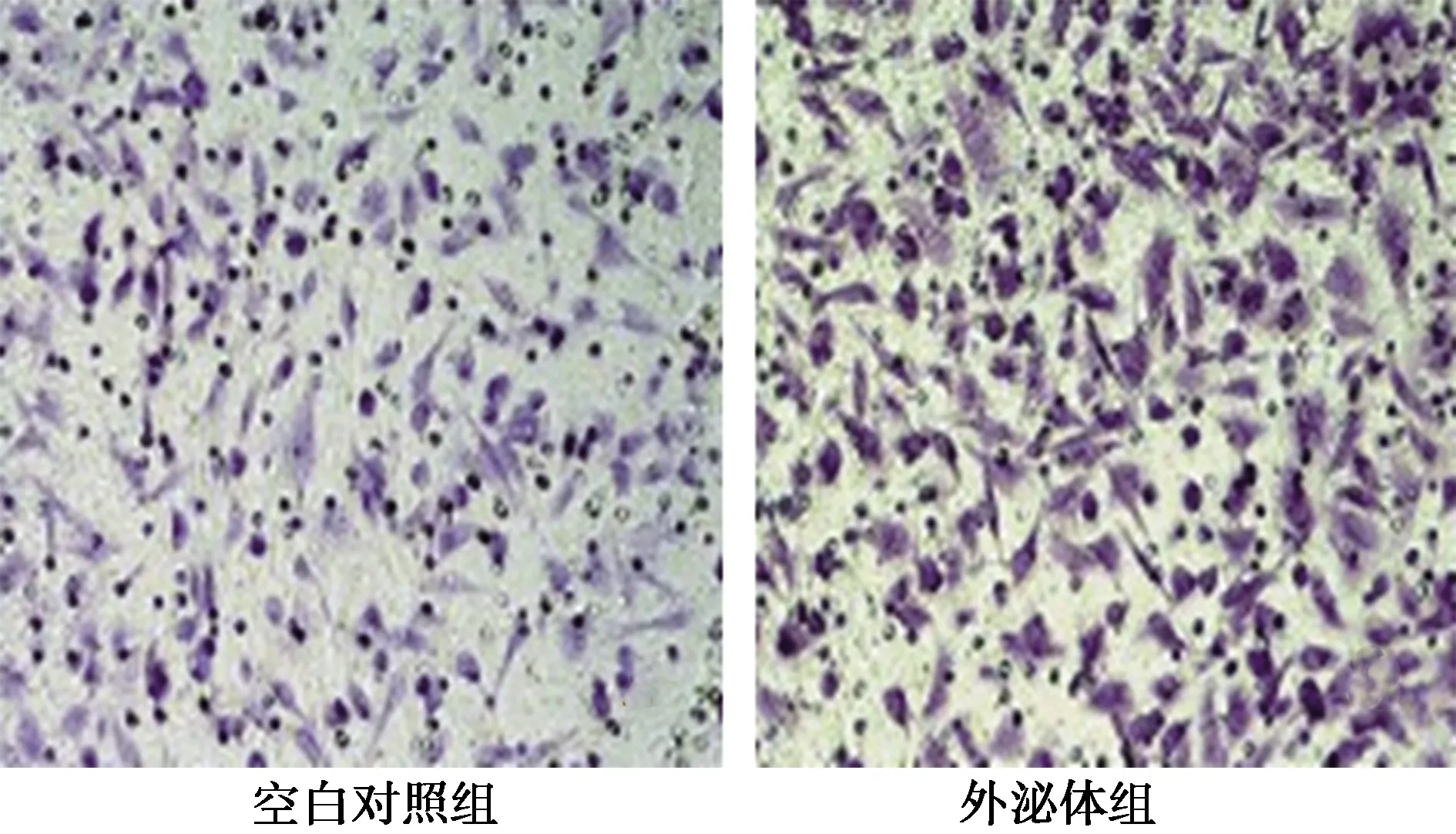
圖4 缺氧外泌體對HHCC細胞侵襲能力的Transwell小室實驗(×400)
3 討 論
原發性肝癌是我國發病率和死亡率逐年上升的消化系統惡性腫瘤,其中90%以上為肝細胞癌,增殖、遷移和侵襲能力均較強,且發病早期癥狀不明顯,臨床確診時多數患者已處于中晚期,無法行根治術治療,5年生存率處于較低水平〔5〕。探究原發性肝癌發生與進展的分子機制,對研發新的治療方案和預后評估指標具有重要意義。低氧環境是惡性腫瘤增殖過程中的一個典型特點〔6〕。惡性腫瘤細胞增殖速率要快于腫瘤新生血管生成的速率,因此位于腫瘤組織中心位置,距離腫瘤微血管較遠的癌細胞長期處于低氧狀態,上述癌細胞通過自身的適應能力,重新塑造腫瘤微環境,具備了更強的生長、轉移和放化療抵抗能力〔7〕。相關研究顯示,腫瘤細胞外泌體具有免疫抑制,誘發腫瘤增殖、轉移、侵襲及耐藥性產生的作用〔8〕。亦有研究顯示,來源于上皮間質的非小細胞肺癌腫瘤細胞的外泌體能夠誘發對化療藥物的抵抗〔9〕;來源于黑色素瘤細胞的外泌體能夠通過自分泌和旁分泌信號通路來增加黑色素瘤細胞的轉移風險〔10〕;來源于乳腺癌的外泌體能夠通過IL-6/GP130/Stat3信號通路來影響巨噬細胞極化〔11〕。但針對于原發性肝癌發生、發展過程中低氧環境和外泌體的研究仍十分少見。
本研究使用差速離心法和超速離心法,分離提取低氧環境下HHCC細胞外泌體。通過電子顯微鏡觀察和外泌體特異性蛋白Western印跡檢測證實低氧環境下HHCC細胞外泌體提取成功。進一步將低氧環境下HHCC細胞外泌體與HHCC細胞共培養后檢測顯示,HHCC細胞的增殖、遷移和侵襲能力均明顯高于單獨培養的HHCC細胞。提示低氧環境下HHCC細胞外泌體能夠明顯增強HHCC細胞的增殖、遷移和侵襲能力。本次研究結果和以往研究報道均表明,作為細胞間信號傳遞載體的外泌體是腫瘤微環境中的重要組成成分;處于低氧環境中的肝癌細胞能夠通過外泌體來增強常氧環境中肝癌細胞的增殖和侵襲能力。低氧環境中原發性肝癌細胞分泌的外泌體作為缺氧癌細胞和常氧癌細胞之間溝通的橋梁,介導了原發性肝癌腫瘤微環境中細胞惡性表型的傳遞。
綜上所述,本研究證實了低氧環境下HHCC細胞外泌體能夠促進常氧HHCC細胞的增殖、遷移和侵襲,闡釋了外泌體在肝癌缺氧微環境中的重要作用。但未對相關分子機制進行深入探究,今后研究中可結合體內動物實驗和長鏈非編碼RNA測序,進一步探究缺氧外泌體對原發性肝癌細胞活性影響的分子機制。

