五味子油聯合莪術油防治肝纖維化的作用及機制研究
侯曉榮,趙 靖,趙 佳,丁凱欣,劉文龍,肖小河,湛小燕*,柏兆方*
? 藥理與臨床 ?
五味子油聯合莪術油防治肝纖維化的作用及機制研究
侯曉榮1, 2,趙 靖1, 3#,趙 佳1, 2,丁凱欣1, 4,劉文龍3,肖小河1, 4,湛小燕1, 4*,柏兆方1, 4*
1. 中國人民解放軍總醫院第五醫學中心 肝病醫學部,北京 100039 2. 成都中醫藥大學藥學院,四川 成都 611137 3. 湖南中醫藥大學藥學院,湖南 長沙 410208 4. 中國人民解放軍總醫院第五醫學中心 全軍中醫藥研究所,北京 100039
研究五味子油聯合莪術油防治肝纖維化的作用及機制。采用蛋氨酸和膽堿缺乏及鐵添加氨基酸飼料喂養小鼠構建非酒精脂肪肝炎伴肝纖維化模型,將112只C57BL/6小鼠分為對照組、模型組、扶正化瘀膠囊(585 mg/kg)組、五味子油單獨給藥組、莪術油單獨給藥組以及五味子油聯合莪術油給藥組;造模成功后,對照組和模型組ig 0.5%羧甲基纖維素鈉溶液,各給藥組ig相應藥物,連續6周;采用酶標儀測定小鼠血清中丙氨酸轉氨酶(alanine aminotransferase,ALT)和天冬氨酸轉氨酶(aspartate aminotransferase,AST)活性;采用蘇木素-伊紅(HE)染色法觀察各組小鼠肝組織病理變化;采用ELISA法檢測小鼠血清中轉化生長因子-β1(transforming growth factor-β1,TGF-β1)、腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)和肝組織中羥脯氨酸(hydroxyproline,Hyp)含量;采用qRT-PCR法檢測小鼠肝組織中I型膠原()、和的mRNA表達情況。人肝星形LX-2細胞給予藥物預處理,再加入TGF-β1因子,采用Western blotting法檢測細胞Collagen I和α-平滑肌肌動蛋白(α-smooth muscle actin,α-SMA)蛋白表達情況。體內實驗結果顯示,與模型組相比,各給藥組血清中ALT和AST活性均顯著降低(<0.05、0.01、0.001),其中五味子油與莪術油聯合給藥高劑量組抑制小鼠ALT活性更為顯著;肝臟顏色、光澤和質地都有明顯改善,肝組織中脂肪空泡化改善、炎性細胞浸潤減少;肝組織Hyp和血清TGF-β1、TNF-α含量均顯著降低(<0.05、0.01、0.001),其中聯合給藥高劑量組改善小鼠肝組織Hyp含量更為顯著;肝組織、和mRNA表達水平顯著降低(<0.05、0.01、0.001)。體外實驗結果顯示,五味子油與莪術油聯合給藥組能下調TGF-β1誘導的LX-2細胞Collagen I和α-SMA蛋白表達。五味子油和莪術油均具有抗肝纖維化作用,且五味子油與莪術油聯用的抗肝纖維化效應明顯強于各藥物的單獨使用。
五味子油;莪術油;肝纖維化;LX-2細胞;轉化生長因子-β/Smad3通路
肝纖維化是由多種原因引起的慢性肝病,包括乙型和丙型肝炎、自身免疫性肝炎、酒精性肝病和非酒精性脂肪性肝炎等[1-2]。肝臟損傷后會發生自我修復,此過程伴隨著纖維化的發生。肝纖維化是一個動態過程,其特征是細胞外基質或疤痕的凈積累和肝星狀細胞的活化,導致慢性肝損傷[3-4]。雖然纖維化可以在消除損傷原因后逆轉,但不加控制的慢性損傷會導致肝衰竭、肝硬化、肝癌,已成為一個日益嚴重的全球性健康問題[5-6]。近年來,逍遙散[7]、芍藥苷[8]、人參皂苷[9]等中藥在預防和治療肝纖維化方面取得顯著進展[10]。
五味子為木蘭科植物五味子(Turcz.) Baill.的干燥成熟果實,習稱“北五味子”,其味酸、甘,性溫,歸肺、心、腎經,有收斂固澀、益氣生津、補腎寧心的功效,用于治療久嗽虛喘、夢遺滑精、遺尿尿頻、久瀉不止、自汗盜汗、津傷口渴、內熱消渴、心悸失眠[11]。五味子油可以經壓榨和CO2超臨界萃取得到,研究表明木脂素類成分是五味子的主要活性成分,具有保護肝臟、改善認知障礙、抗炎、調節免疫和抗腫瘤等作用[12-15]。莪術的主要活性成分如姜黃素、欖香烯、莪術醇、吉馬酮治療肝臟疾病療效確切[16],莪術油是從莪術的根、莖中提取的揮發油,具有活血行氣、化瘀消癥之功效。已有文獻報道莪術油能夠減輕血瘀證肝纖維化小鼠的肝纖維化程度[17-18]。肝星狀細胞的活化是分泌基質蛋白的肌成纖維細胞的主要細胞來源,是肝纖維化的主要驅動力[2]。而轉化生長因子-β(transforming growth factor-β,TGF-β)信號通路被認為是驅動肝星狀細胞活化和誘導細胞外基質產生的關鍵纖維化通路[19-20]。本研究擬探討五味子油以及聯合莪術油能否通過TGF-β信號通路來實現抗肝纖維化的藥效作用,并闡明其作用機制,為治療肝纖維化提供一種有開發前景的天然活性藥物組合物。
1 材料
1.1 動物
SPF級雄性C57BL/6小鼠112只,8~10周齡,體質量18~20 g,購自北京斯貝福生物技術有限公司,動物許可證號SCXK(京)2019-0010。小鼠飼養于標準的SPF級房間(室溫21~25 ℃,12 h明暗交替照明)內分籠飼養,除禁食實驗外,可自由進食飲水,適應性喂養1周后進行后續實驗。動物實驗均按照中國人民解放軍總醫院第五醫學中心動物倫理委員會批準(批準號IACUC-2019-0013)的指導方針進行。
1.2 細胞
人肝星形LX-2細胞(批號YB-H3614)購自上海鈺博生物科技股份有限公司。
1.3 藥品與試劑
五味子油(批號20200407)、莪術油(批號190301)購自山東世博金都藥業有限公司,符合《中國藥典》2020年版標準;對照品五味子醇甲(批號JOT-10156)、五味子醇乙(批號JOT-10155)、五味子酯甲(批號JOT-10158)、五味子酯乙(批號JOT-10157)、五味子甲素(批號JOT-10160)、五味子乙素(批號JOT-10159)、五味子丙素(批號JOT-10307)購自成都普菲德生物技術有限公司,質量分數≥98%;蛋氨酸和膽堿缺乏及鐵添加氨基酸飼料(MCD飼料)、對照飼料(MCS飼料)購自戴茨生物科技有限公司;扶正化瘀膠囊(批號201107)購自上海黃海制藥有限責任公司;TGF-β1(批號AF-100-21C)購自美國PeproTech公司;DMEM培養基、1%青霉素(100 U/mL)、鏈霉素(100 μg/mL)購自北京中科邁晨公司;胎牛血清購自以色列BI公司;人源I型膠原(Collagen I)抗體(批號AF6220)購自美國R&D公司;人源α-平滑肌肌動蛋白(α-smooth muscle actin,α-SMA)抗體(批號19245)購自美國CST公司;甘油醛-3-磷酸脫氫酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗體(批號GTX100118)購自美國GeneTex公司;丙氨酸轉氨酶(alanine aminotransferase,ALT)、天冬氨酸轉氨酶(aspartate aminotransferase,AST)試劑盒購自南京建成生物工程研究所;羥脯氨酸(hydroxyproline,Hyp)試劑盒購自武漢云克隆;小鼠TGF-β1、腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)ELISA試劑盒購自北京達科為生物技術有限公司;、、和引物由北京天一輝遠生物公司合成;Trizol購自美國Ambion公司;蟛蜞菊內酯(批號HY-N0551)、SYBR Green qPCR Master Mix(Low Rox)、RT Master Mix for qPCR購自美國MCE公司;RIPA裂解液購自北京索萊寶科技有限公司。
1.4 儀器
Acquity超高效液相色譜儀(UPLC,美國Waters公司);CO2細胞培養箱、?80 ℃超低溫冰箱(美國Thermo Fisher Scientific公司);控溫離心機(美國Sigma公司);XS-205DU型萬分之一天平(瑞士Mettler Toledo公司);Synergy H1多功能酶標儀(美國Bio-Tek公司);DMIL HC型倒置顯微鏡(德國Leica公司);轉印電泳槽(美國Bio-Rad公司)。
2 方法
2.1 五味子油色譜分析
參照文獻方法[21]采用UPLC測定五味子油中木脂素成分的含量。色譜條件為:Acquity BE1 C18色譜柱(100 mm×2.1 mm,1.7 μm),流動相為乙腈(A)-0.1%磷酸水溶液(B),梯度系統:0~2 min,5%~55% A;2~15 min,55%~67% A;15~20 min,67%~78% A;20~23 min,78%~95% A;23~30 min,95%~5% A;體積流量為0.2 mL/min;柱溫為30 ℃;進樣量為1 μL;檢測波長為220 nm。
2.2 體內實驗
2.2.1 動物分組及給藥 將適應性喂養后的小鼠分為14組,每組8只,分別為對照組、模型組、扶正化瘀膠囊(585 mg/kg)組及五味子油低、中、高劑量(180、360、720 mg/kg)組及莪術油低、高劑量(4.5、9.0 mg/kg)組及莪術油低劑量(4.5 mg/kg)+五味子油低劑量(180 mg/kg)組、莪術油低劑量(4.5 mg/kg)+五味子油中劑量(360 mg/kg)組、莪術油低劑量(4.5 mg/kg)+五味子油高劑量(720 mg/kg)組、莪術油高劑量(9.0 mg/kg)+五味子油低劑量(180 mg/kg)組、莪術油高劑量(9.0 mg/kg)+五味子油中劑量(360 mg/kg)組和莪術油高劑量(9.0 mg/kg)+五味子油高劑量(720 mg/kg)組。模型組和各給藥組小鼠給予MCD飼料(膽堿和蛋氨酸缺乏飼料)造模,對照組小鼠給予MCS對照飼料,造模6周;造模成功后,對照組和模型組ig 0.5%羧甲基纖維素鈉溶液,各給藥組ig相應藥物,1次/d,連續6周。每周稱定體質量1次,末次給藥后禁食不禁水,24 h后眼球采血,頸椎脫臼法處死小鼠取肝臟,收集血清和肝臟標本,部分肝臟浸泡于10%福爾馬林中,部分凍存于?80 ℃冰箱備用。
2.2.2 肝組織病理檢測 肝臟組織經中性福爾馬林固定后,常規石蠟包埋,切片厚4 μm,蘇木素-伊紅(HE)染色后,于光學顯微鏡下觀察各組小鼠肝組織病理學改變。
2.2.3 血清ALT、AST活性和TGF-β1、TNF-α水平測定 取小鼠血清,按試劑盒說明書測定血清中ALT、AST活性和TGF-β1、TNF-α水平。
2.2.4 肝組織中Hyp水平測定 取50 mg小鼠肝組織于2 mL的無酶EP管中,加入1 mL的含蛋白酶抑制劑的RIPA試劑,用組織勻漿機制備肝勻漿液。采用BCA法進行蛋白定量后,按照試劑盒說明書測定組織勻漿液中Hyp水平。
2.2.5 肝組織總RNA提取以及qRT-PCR檢測 取50 mg小鼠肝組織于2 mL的無酶EP管中,按照試劑盒說明書提取總RNA并合成cDNA,進行qRT-PCR分析。、、和引物序列見表1。
表1 引物序列
Table 1 Primer sequences
引物長度/bp序列(5’-3’) Collagen Ⅰ1919F: CTGGCGGTTCAGGTCCAAT R: TTCCAGGCAATCCACGAGC Smad32021F: TCTCCCCGAATCCGATGTCC R: GCTGGTTCAGCTCGTAGTAGG TGF-β12322F: CTTCAATACGTCAGACATTCGGG R: GTAACGCCAGGAATTGTTGCTA β-actin2120F: ATTCGTTGCCGGTCCACACCC R: GCTTTGCACATGCCGGAGCC
2.3 體外實驗
2.3.1 細胞培養 LX-2細胞用含10%胎牛血清和100 U/L青霉素/鏈霉素的DMEM培養基,于37 ℃、5%的CO2培養箱中進行傳代培養。
2.3.2 CCK-8試驗 取對數生長期的LX-2細胞,以2×105/mL接種于96孔板,每孔100 μL,培養12~18 h后進行分組實驗,空白組不接種細胞。分別稱取五味子油或者莪術油溶解于二甲基亞砜(dimethyl sulfoxide,DMSO)中,配制質量濃度為50 mg/mL的母液。各組分別加入含等量DMSO的正常培養基(空白、對照)或不同質量濃度(1.25、2.50、5.00、10.00、20.00、40.00、60.00、80.00、100.00 μg/mL)的五味子油或莪術油,培養24 h后,棄去上清,加入CCK-8試劑,培養1 h,采用酶標儀測定450 nm處的吸光度()值,計算細胞存活率。
細胞存活率=(實驗-空白)/(對照-空白)
2.3.3 Western blotting法檢測細胞Collagen I和α-SMA蛋白表達情況 取對數生長期的LX-2細胞,加入0.05%胰酶,37 ℃消化1 min;將細胞以2.5×105/mL接種于24孔板,培養12~18 h至其貼壁,用無血清的DMEM培養基饑餓處理細胞6 h;采用換液的方式,加入用無血清DMEM培養基配制的不同質量濃度的五味子油(0、10、20、40 μg/mL)、莪術油(0、5、10、20 μg/mL)以及兩者聯合的藥物和蟛蜞菊內酯(12.57 μg/mL),同時在空白孔和對照孔加入含等量DMSO的稀釋液,每孔400 μL,藥物處理6 h;采用補液的方式,加入TGF-β1刺激因子(用含5%海藻糖的PBS溶液稀釋至20 μg/mL),終質量濃度為10 ng/mL,處理24 h;吸去上清后,每孔加入130 μL的RIPA細胞裂解液,迅速晃勻使裂解液充分裂解細胞,15 min后收集裂解液,提取蛋白,并用BCA法測定蛋白濃度,采用Western blotting法測定各組細胞Collagen I和α-SMA蛋白表達情況。
2.4 統計分析
實驗數據用Graphpad Prism 6.0進行統計分析,數據以表示,組間比較采用單因素方差分析(One-way ANOVA)。
3 結果
3.1 五味子油色譜分析
經UPLC檢測,五味子油中五味子醇甲、五味子醇乙、五味子酯甲、五味子酯乙、五味子甲素、五味子乙素、五味子丙素質量濃度分別為16.67、4.54、1.16、1.84、3.67、5.33、0.65 mg/mL。
3.2 各組小鼠肝臟形態學以及組織病理學變化
如圖1所示,對照組小鼠肝臟表面光滑紅潤,色澤鮮明,邊緣銳利,質地中等,有彈性,HE染色結果顯示對照組小鼠肝組織的肝細胞形態正常,結構完整。與對照組比較,模型組小鼠肝臟體積縮小且顏色泛黃,表面粗糙,邊緣較鈍,質地較硬,彈性差,肝組織中可見肝細胞體積增大,呈圓形,細胞質內有大量圓形空泡,將細胞核擠到一側,同時有大量炎性細胞浸潤。與模型組比較,各給藥組小鼠肝臟顏色、光澤和質地都有明顯的改善,肝組織中脂肪空泡化明顯改善、炎性細胞浸潤減少。
3.3 各組小鼠血清中ALT和AST活性
如圖2所示,與對照組相比,模型組小鼠血清ALT和AST活性明顯升高(<0.001);與模型組相比,除莪術油低劑量組外,各給藥組血清ALT活性明顯降低(<0.05、0.01、0.001);除莪術油各劑量組外,各給藥組血清AST活性明顯降低(<0.05、0.01、0.001)。
3.4 各組小鼠肝組織Hyp水平
如圖3所示,與對照組相比,模型組肝組織Hyp水平明顯升高(<0.001);與模型組相比,五味子油高劑量組、五味子油與莪術油聯合給藥組小鼠肝組織Hyp水平明顯降低(<0.05、0.01、0.001)。
3.5 各組小鼠血清TGF-β1和TNF-α水平
如圖4所示,與對照組相比,模型組血清TGF-β1和TNF-α水平明顯升高(<0.001);與模型組相比,除莪術油低劑量組外,各給藥組小鼠肝組織TGF-β1水平明顯降低(<0.01、0.001);除五味子油低劑量組外,各給藥組小鼠血清中TNF-α水平均顯著降低(<0.05、0.01、0.001)。
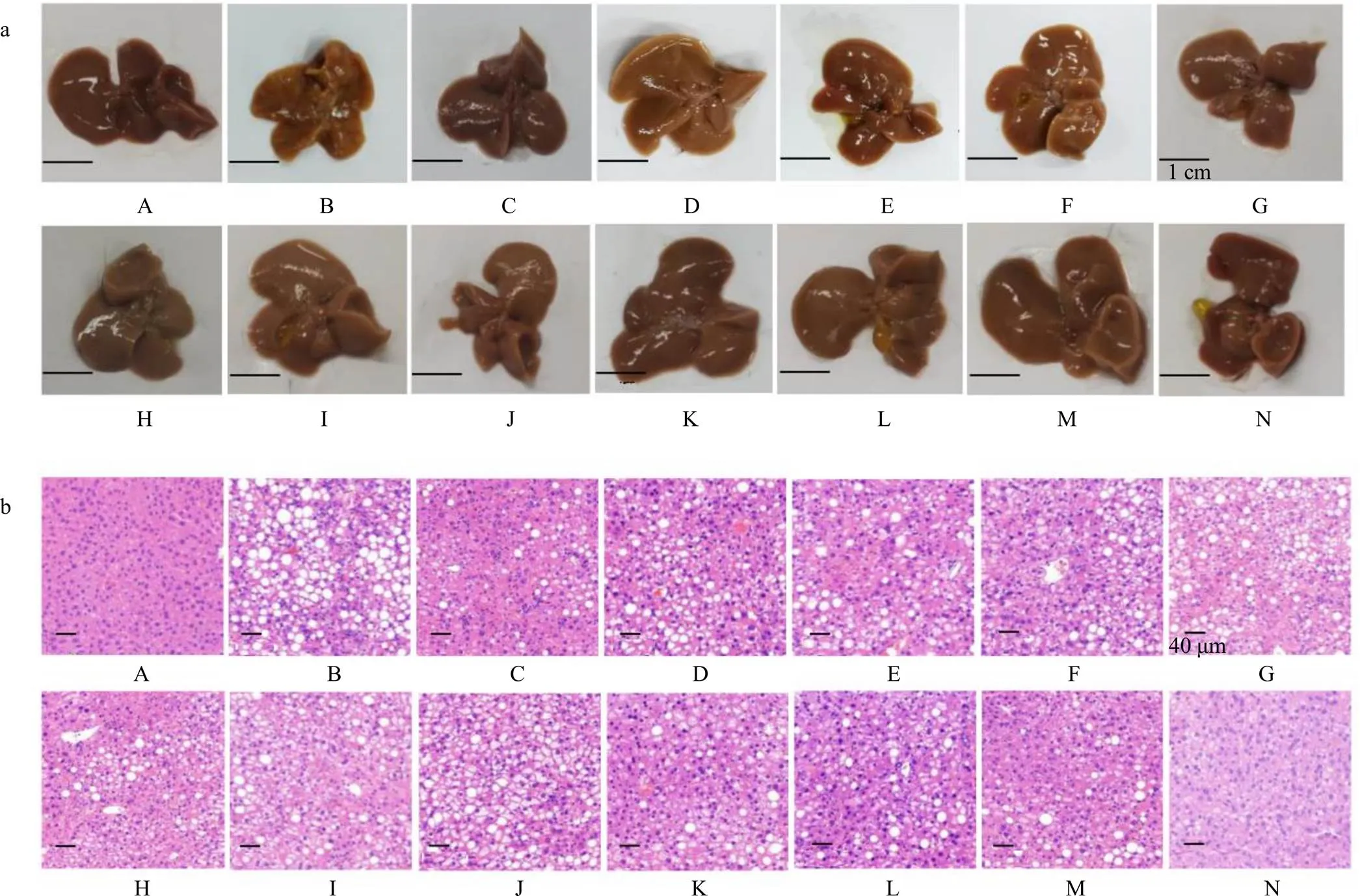
A-對照組 B-模型組 C-扶正化瘀組 D~F-五味子油低、中、高劑量(180、360、720 mg·kg?1)組 G、H-莪術油低、高劑量(4.5、9.0 mg·kg?1)組 I-莪術油低劑量(4.5 mg·kg?1)+五味子油低劑量(180 mg·kg?1)組 J-莪術油低劑量(4.5 mg·kg?1)+五味子油中劑量(360 mg·kg?1)組 K-莪術油低劑量(4.5 mg·kg?1)+五味子油高劑量(720 mg·kg?1)組 L-莪術油高劑量(9.0 mg·kg?1)+五味子油低劑量(180 mg·kg?1)組 M-莪術油高劑量(9.0 mg·kg?1)+五味子油中劑量(360 mg·kg?1)組 N-莪術油高劑量(9.0 mg·kg?1)+五味子油高劑量(720 mg·kg?1)組,圖3~6同

與對照組比較:###P<0.001;與模型組比較:*P<0.05 **P<0.01 ***P<0.001,下圖同

圖3 各組小鼠肝組織Hyp水平(, n = 8)
3.6 各組小鼠肝組織Collagen Ⅰ、TGF-β1和Smad3 mRNA表達
如圖5所示,與對照組相比,模型組小鼠肝組織、和mRNA表達水平明顯升高(<0.001);與模型組相比,各給藥組小鼠肝組織和mRNA表達水平明顯降低(<0.001);除五味子油低劑量組外,各給藥組小鼠肝組織mRNA表達水平明顯降低(<0.05、0.01、0.001)。
3.7 五味子油和莪術油對LX-2細胞存活率的影響
如圖6所示,與對照組相比,五味子油各劑量組細胞存活率均無顯著差異,表明五味子油(≤100μg/mL)對LX-2細胞毒性小;莪術油(≤40 μg/mL)組LX-2細胞存活率無顯著差異,莪術油(60.00、80.00、100.00 μg/mL)組LX-2細胞存活率顯著下降(<0.001)。結合細胞存活率,本研究各選擇3個不同質量濃度的五味子油(10.00、20.00、40.00 μg/mL)和莪術油(5.00、10.00、20.00 μg/mL)進行后續實驗。

圖4 各組小鼠血清中TGF-β1和TNF-α水平(, n = 8)

圖5 各組小鼠肝組織Collagen I、TGF-β1和Smad3mRNA表達情況(, n = 8)

圖6 五味子油和莪術油對LX-2細胞存活率的影響(, n = 3)
3.8 五味子油和莪術油對TGF-β1誘導的LX-2細胞Collagen I和α-SMA蛋白表達的影響
如圖7所示,與對照組相比,TGF-β1刺激后,LX-2細胞Collagen I、α-SMA蛋白表達增加;五味子油(20、40 μg/mL)能抑制Collagen I和α-SMA蛋白表達;莪術油(10、20 μg/mL)能抑制Collagen I和α-SMA蛋白表達;五味子油(10、20、40 μg/mL)聯合莪術油(10、20 μg/mL)能抑制Collagen I和α-SMA蛋白表達;與五味子油(10、20、40 μg/mL)、莪術油(10、20 μg/mL)的單獨給藥相比,聯合給藥后對LX-2細胞Collagen I和α-SMA蛋白表達的抑制作用更強。

A-對照組 B-模型組 C-蟛蜞菊內酯組 D~F-五味子油(10、20、40 μg·mL?1)組 G-莪術油(5 μg·mL?1)組 H~J-五味子油(10、20、40 μg·mL?1)+莪術油(5 μg·mL?1)組 K-莪術油(10 μg·mL?1)組 L~N-五味子油(10、20、40 μg·mL?1)+莪術油(10 μg·mL?1)組 O-莪術油(20 μg·mL?1)組 P~R-五味子油(10、20、40 μg·mL?1)+莪術油(20 μg·mL?1)組
4 討論
肝纖維化是肝組織損傷后修復的進行性疾病,其特征是肝星狀細胞活化、炎癥反應激活、細胞外基質過度沉積以及纖維疤痕的形成等[22]。TGF-β是一種主要的促纖維化細胞因子,并以Smad2或Smad3依賴的方式驅動肝星狀細胞激活[19,23-24]。活化的肝星狀細胞遷移到損傷部位并分泌細胞外基質,產生纖維瘢痕[23]。因此,通過靶向TGF-β相關分子或信號通路來抑制肝星狀細胞增殖與活化是防治肝纖維化的有效策略[25]。
MCD飲食誘導建立非酒精性脂肪性肝纖維化小鼠模型,已成為國內外建立肝纖維化動物模型的經典方法[26-28]。扶正化瘀膠囊被作為陽性藥物廣泛應用于抗肝纖維化研究中[29-31]。基于此,本研究采用MCD飲食誘導的肝纖維化模型,進一步探究五味子油聯合莪術油的抗肝纖維化作用及機制。藥效學結果表明,經五味子油、莪術油、五味子油與莪術油聯合給藥治療后,小鼠血清ALT、AST活性和TGF-β1水平以及肝組織Hyp水平不同程度地降低,表明五味子油聯合莪術油可抑制肝細胞損傷,具有明顯的抗肝纖維化作用,且聯合效果優于單藥,其中以聯合給藥高劑量改善肝纖維化效果最佳。
α-SMA是肝星狀細胞活化的標志物,Collagen I是肝星狀細胞活化后釋放的細胞外基質的主要成分,是纖維的重要來源。本研究進一步通過qRT-PCR法探究五味子油聯合莪術油對小鼠肝組織中、和mRNA表達的影響,并通過Western blotting法探究其對LX-2細胞活化后Collagen I和α-SMA蛋白表達的影響,結果顯示,給藥后小鼠肝組織中、和mRNA表達均顯著降低,LX-2細胞Collagen I和α-SMA蛋白表達也降低,提示五味子油聯合莪術油可通過下調TGF-β1、Smad3蛋白表達,調節膠原蛋白的合成與沉積,抑制肝星狀細胞的活化,從而實現抗肝纖維化的作用。
肝細胞損傷后會釋放大量炎癥介質,TNF-α是常見的炎癥因子,與非酒精性脂肪性肝纖維化小鼠疾病嚴重程度相關。本研究表明,給藥后小鼠血清中TNF-α水平顯著降低,表明五味子油聯合莪術油能夠抑制炎癥因子的釋放來改善肝纖維化。
綜上所述,五味子油聯合莪術油對MCD飲食誘導的小鼠肝纖維化具有一定的改善作用,能減輕肝損傷、肝纖維化程度及炎癥反應,其機制為通過抑制TGF-β1/Smad信號通路,抑制肝星狀細胞活化,下調α-SMA表達,減輕膠原合成與沉積。本研究明確了五味子油與莪術油作為一種聯合用藥物組合物通過抑制TGF-β1肝纖維化信號通路來發揮顯著的抗肝纖維化作用,為肝纖維化疾病預防和治療提供一種有開發前景的天然活性藥物組合物,也為組分中藥五味子油與莪術油的開發和利用提供新的科學依據。
利益沖突 所有作者均聲明不存在利益沖突
[1] Bataller R, Brenner D A. Liver fibrosis [J]., 2005, 115(2): 209-218.
[2] Higashi T, Friedman S L, Hoshida Y. Hepatic stellate cells as key target in liver fibrosis [J]., 2017, 121: 27-42.
[3] Roderfeld M. Matrix metalloproteinase functions in hepatic injury and fibrosis [J]., 2018, 68/69: 452-462.
[4] Parola M, Pinzani M. Liver fibrosis: Pathophysiology, pathogenetic targets and clinical issues [J]., 2019, 65: 37-55.
[5] Kong Z Y, Liu R, Cheng Y R. Artesunate alleviates liver fibrosis by regulating ferroptosis signaling pathway [J]., 2019, 109: 2043-2053.
[6] Chang J L, Lan T, Li C Z,. Activation of Slit2-Robo1 signaling promotes liver fibrosis [J]., 2015, 63(6): 1413-1420.
[7] Zhou Y, Wu R, Cai F F,. Xiaoyaosan Decoction alleviated rat liver fibrosis via the TGFβ/Smad and Akt/FoxO3 signaling pathways based on network pharmacology analysis [J]., 2021, 264: 113021.
[8] Li X Y, Shen J L, Zhong Z R,. Paeoniflorin: A monomer from traditional Chinese medical herb amelioratesegg-induced hepatic fibrosis in mice [J]., 2009, 95(6): 1520-1524.
[9] Li X B, Mo N, Li Z Z. Ginsenosides: Potential therapeutic source for fibrosis-associated human diseases [J]., 2020, 44(3): 386-398.
[10] Zhang L J, Schuppan D. Traditional Chinese medicine (TCM) for fibrotic liver disease: Hope and hype [J]., 2014, 61(1): 166-168.
[11] 中國藥典 [S]. 一部. 2020: 68.
[12] Zhou Y, Men L H, Sun Y X,. Pharmacodynamic effects and molecular mechanisms of lignans fromTurcz. (Baill.), a current review [J]., 2021, 892: 173796.
[13] Szopa A, Ekiert R, Ekiert H. Current knowledge of(Turcz.) Baill. (Chinesevine) as a medicinal plant species: A review on the bioactive components, pharmacological properties, analytical and biotechnological studies [J]., 2017, 16(2): 195-218.
[14] Nowak A, Zak?os-Szyda M, B?asiak J,. Potential of(Turcz.) Baill. in human health and nutrition: A review of current knowledge and therapeutic perspectives [J]., 2019, 11(2): 333.
[15] 王銳, 李婭蘭, 李建月, 等. 共載HBx-siRNA與五味子油陽離子脂質體納米粒的制備及其對乙型肝炎體外藥效學研究[J]. 中草藥, 2021, 52(15): 4519-4527.
[16] 趙鐵建, 傅品悅, 劉露露, 等. 中藥莪術幾種活性成分對肝臟疾病防治作用的機制 [J]. 世界華人消化雜志, 2017, 25(27): 2433-2440.
[17] 劉露露, 呂貝貝, 彭岳, 等. 莪術油對血瘀證肝纖維化小鼠TGF-β1、Smad 2、Smad 3表達的影響 [J]. 時珍國醫國藥, 2019, 30(6): 1284-1287.
[18] 劉露露. 廣西莪術油對血瘀證肝纖維化小鼠TGF-β1/Smads信號通路的影響 [D]. 南寧: 廣西中醫藥大學, 2019.
[19] Dewidar B, Meyer C, Dooley S,. TGF-β in hepatic stellate cell activation and liver fibrogenesis-updated 2019 [J]., 2019, 8(11): 1419.
[20] Fagone P, Mangano K, Pesce A,. Emerging therapeutic targets for the treatment of hepatic fibrosis [J]., 2016, 21(2): 369-375.
[21] 翟欣然, 曲佳萌, 許華容, 等. UHPLC-DAD法同時測定五味子標準湯劑中4種木脂素類成分的含量 [J]. 沈陽藥科大學學報, 2019, 36(10): 882-886.
[22] Kisseleva T, Brenner D. Molecular and cellular mechanisms of liver fibrosis and its regression [J]., 2021, 18(3): 151-166.
[23] Tsuchida T, Friedman S L. Mechanisms of hepatic stellate cell activation [J]., 2017, 14(7): 397-411.
[24] Xu F Y, Liu C W, Zhou D D,. TGF-β/SMAD pathway and its regulation in hepatic fibrosis [J]., 2016, 64(3): 157-167.
[25] 閻仕豪, 苗蕙, 黃鎮林, 等. 金銀花-連翹提取物組合對CCl4誘導小鼠肝纖維化的改善作用研究 [J]. 上海中醫藥大學學報, 2021, 35(2): 50-56.
[26] 覃碧艷, 刁娜, 白嵐. 甲狀旁腺激素相關蛋白加重蛋氨酸膽堿缺乏飼料誘導的小鼠非酒精性脂肪性肝病進展 [J]. 南方醫科大學學報, 2021, 41(7): 1037-1043.
[27] Xiong F, Zheng Z, Xiao L Y,. Soyasaponin A2 alleviates steatohepatitis possibly through regulating bile acids and gut microbiota in the methionine and choline-deficient (MCD) diet-induced nonalcoholic steatohepatitis (NASH) mice [J]., 2021, 65(14): e2100067.
[28] Wang X J, de Carvalho Ribeiro M, Iracheta-Vellve A,. Macrophage-specific hypoxia-inducible factor-1α contributes to impaired autophagic flux in nonalcoholic steatohepatitis [J]., 2019, 69(2): 545-563.
[29] 肖準, 付亞東, 胡永紅, 等. 扶正化瘀方抗肝纖維化主要成分的配伍研究 [J]. 世界科學技術—中醫藥現代化, 2021, 23(5): 1567-1578.
[30] 胡會芬, 劉雯, 譚林. 富馬酸替諾福韋聯合扶正化瘀治療對乙肝肝硬化患者肝纖維化程度及免疫狀態的影響 [J]. 河北醫學, 2021, 27(4): 686-692.
[31] 林揚, 林翠英, 王艷嬌, 等. 扶正化瘀膠囊聯合恩替卡韋分散片治療慢性乙型肝炎肝纖維化臨床研究 [J]. 新中醫, 2021, 53(6): 51-54.
Effect and mechanism ofoil combined with Zedoary Turmeric oil on liver fibrosis
HOU Xiao-rong1, 2, ZHAO Jing1, 3, ZHAO Jia1, 2, DING Kai-xin1, 4, LIU Wen-long3, XIAO Xiao-he1, 4, ZHAN Xiao-yan1, 4, BAI Zhao-fang1, 4
1. Department of Hepatology, The Fifth Medical Center of Chinese PLA General Hospital, Beijing 100039, China 2. School of Pharmacy, Chengdu University of Traditional Chinese Medicine, Chengdu 611137, China 3. School of Pharmacy, Hunan University of Traditional Chinese Medicine, Changsha 410208, China 4. China Military Institute of Chinese Materia, The Fifth Medical Centre of Chinese PLA General Hospital, Beijing 100039, China
To explore the effect and mechanism ofoil combined with Zedoary Turmeric oil on prevention and treatment of liver fibrosis.A mice model of nonalcoholic steatohepatitis (NASH) with liver fibrosis was constructed by methionine and choline deficiency and iron-supplemented amino acid diet. Totally 112 C57BL/6 mice were randomly divided into control group, model group, Fuzheng Huayu Capsules (585 mg/kg) group,oil group, Zedoary Turmeric oil group andoil combined with Zedoary Turmeric oil group. After successful modeling, mice in control and model group were ig 0.5% CMCNa, and other groups were ig corresponding drug for six weeks. The activities of alanine aminotransferase (ALT) and aspartate aminotransferase (AST) in serum were analyzed by microplate analyzer. The pathological changes of liver tissue were observed by HE staining. The contents of transforming growth factor-β1 (TGF-β1), tumor necrosis factor-α (TNF-α) in serum and hydroxyproline (Hyp) in liver tissue were determined by ELISA. The mRNA expressions of,andin liver tissue were determined by qRT-PCR. LX-2 cells were pretreated with drugs, and then TGF-β1 factor was added, protein expressions of Collagen I and α-smooth muscle actin (α-SMA) were detected by Western blotting.The results ofexperiments showed that compared with model group, ALT and AST activities in serum of mice in each administration group were significantly reduced (< 0.05, 0.01, 0.001), in which high-doseoil combined with Zedoary Turmeric oil group decreased ALT activity more significantly. The liver color, luster, texture and fat vacuolization of liver tissue in each treatment group were significantly improved, accompanied with the reduction of inflammatory cell infiltration. The contents of Hyp in liver tissue and TGF-β1, TNF-α in serum in each administration groups were decreased (< 0.05, 0.01, 0.001), among which the combination of high dose group improved Hyp content in liver tissues of mice more significantly. The mRNA expressions of,andin liver tissue were significantly down-regulated in different drug groups (< 0.05, 0.01, 0.001). The results ofexperiments showed thatoil combined with Zedoary Turmeric oil group could reduce the protein expressions of Collagen I and α-SMA in TGF-β1 induced LX-2 cells.Bothoil and Zedoary Turmeric oil have anti-hepatic fibrosis effect, and the anti-hepatic fibrosis effect ofoil combined with Zedoary Turmeric oil is significantly stronger than that of each drug alone.
oil; Zedoary Turmeric oil; liver fibrosis; LX-2 cells; transforming growth factor-β/Smad3 pathway
R285.5
A
0253 - 2670(2022)04 - 1059 - 09
10.7501/j.issn.0253-2670.2022.04.012
2021-10-27
國家“重大新藥創制”科技重大專項(2017ZX09301022);國家自然科學基金重點項目(81930110)
侯曉榮,碩士研究生,研究方向為中藥藥理與毒理學。E-mail: houzhongyao184@163.com
柏兆方,副研究員,碩士生導師,從事中藥藥理與毒理研究。E-mail: baizf2008@hotmail.com
湛小燕,博士,助理研究員,從事細胞生物學研究。E-mail: xyzhan123@163.com
#共同第一作者:趙 靖,碩士研究生,研究方向為中藥質量控制。E-mail: misteryman@163.com
[責任編輯 李亞楠]

