鐵蛋白納米籠分子裝載途徑及食品活性物質遞送的研究進展
陳海,馬良,戴宏杰,付余,王洪霞,張宇昊
(西南大學 食品科學學院,重慶,400715)
鐵蛋白(ferritin)是一個古老而龐大的蛋白家族,普遍存在于各種動物、植物以及微生物體內。它是一種分子質量為450 kDa左右的大分子蛋白,由24個亞基自組裝形成中空籠形結構[1]。鐵蛋白在生物體內主要是參與機體鐵元素的代謝平衡以及保護細胞免受因各種環境脅迫而導致的細胞氧化損傷[2]。20世紀80年代以來,隨著納米技術的飛速發展和鐵蛋白結構特性認識的加深,鐵蛋白作為一種新型的蛋白質納米材料已經被廣泛用于無機納米顆粒合成[3]、生物傳感器[4]、生物成像[5]、藥物遞送[6]等領域。基于鐵蛋白獨特的納米籠形結構,其內部的納米空間結構可裝載各種食品功能活性物質。由于鐵蛋白外殼的穩定性良好,一旦外源性分子被裝載到鐵蛋白空腔內部,籠形結構外殼可將其與復雜的外界環境隔絕開來,避免與外界的大分子物質、氧化劑、酸堿物質等接觸,以適應各種復雜的加工條件,有助于保護包埋物的生物活性;蛋白質外殼結構還可以有效降低環境中的光照和熱量等因素的不良影響,穩定包埋物的理化特性[7]。因此,鐵蛋白納米籠在生物活性物質遞送的研究中已經展現出良好的應用效果和發展前景。本文將對鐵蛋白的分布、結構及其制備方法進行介紹,總結鐵蛋白納米顆粒裝載外源性小分子的途徑,即基于可逆組裝特性的分子裝載途徑和基于環境響應的通道“門控”特性的分子裝載途徑,并綜述了鐵蛋白納米顆粒在食品功能活性物質包埋中的應用。
1 鐵蛋白納米籠的分子結構
鐵蛋白是生物體內一種十分重要的富含鐵元素的鐵貯存及去毒蛋白質,在生物體內具有調節鐵代謝平衡的功能;還可以清除鐵介導的自由基反應,保護機體免受環境脅迫而導致的細胞氧化性損傷[8]。鐵蛋白廣泛存在于各種動物、植物以及微生物中[9-11]。生物體內的鐵蛋白主要由蛋白質外殼和鐵核2部分構成。鐵核是由磷酸鹽和氫氧化鐵組成的非均勻無機納米顆粒[10];蛋白質外殼是由24個亞基組裝而成的高度對稱的中空籠形結構(圖1)。該結構的內徑約為7~8 nm,外徑約為12~13 nm,厚度約為2~2.5 nm。一般情況下,鐵蛋白的籠形結構是按照F432對稱方式組裝形成的近似正八面體結構[1]。高度對稱的組裝方式使得鐵蛋白納米籠具有8個相同的三重軸通道和6個相同的四重軸通道,這些通道的直徑大小約為0.3~0.5 nm,是離子或者分子等物質進出鐵蛋白的主要路徑,在鐵蛋白內部空腔與外界環境的物質和能量交換中扮演著十分重要的角色[11]。鐵蛋白的每個亞基呈近似圓柱狀,長約5 nm,直徑約為2.5 nm,主要由4個長α-螺旋(A,B,C,D)和C端第5個較短α-螺旋結構組成。與動物鐵蛋白相比,植物鐵蛋白除了具有保守的螺旋結構之外,其亞基結構還包含一個N端的EP(extension peptide)結構,延伸于鐵蛋白的外殼表面,參與鐵蛋白的氧化沉淀[12]。
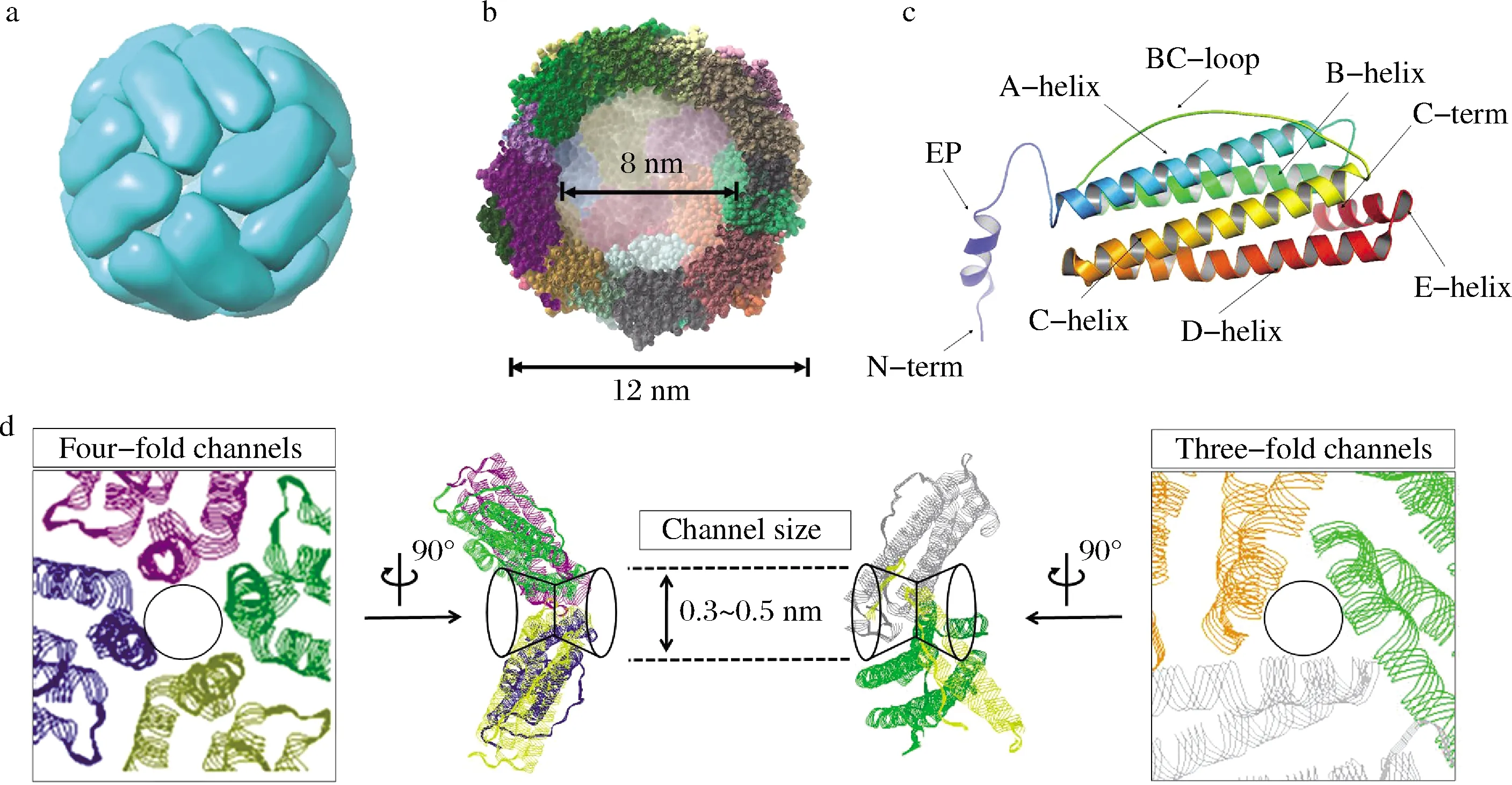
a-鐵蛋白的籠形結構;b-鐵蛋白的內外直徑;c-植物鐵蛋白的亞基結構;d-鐵蛋白的三重軸和四重軸通道圖1 鐵蛋白結構及其離子通道Fig.1 The structure of ferritin protein and its ions channels
2 鐵蛋白納米籠的制備及表征方法
2.1 生物材料提取天然鐵蛋白
鐵蛋白的來源非常廣泛,幾乎在所有的生物體內都有發現。目前,科研工作者相繼從各種動植物組織中如豬脾、鱘魚肝臟、大豆、紅小豆、鷹嘴豆、花蕓豆等分離出鐵蛋白,并建立了動植物鐵蛋白的分離純化方法[2,7,13-14]。從動植物組織中提取鐵蛋白的基本流程主要包括:組織細胞破碎、粗料液熱處理、中性鹽沉淀以及色譜分離。其中,提取溫度、緩沖液pH值、料液比、中性鹽的種類、鹽濃度等是提取鐵蛋白的主要影響因素,對鐵蛋白產率的影響較大。例如,辛敏等[13]在單因素試驗的基礎上,采用L9(34)正交試驗方法優化了鷹嘴豆鐵蛋白的提取工藝。各種實驗因素對鷹嘴豆鐵蛋白提取率的影響順序依次為:料液比>鹽濃度>溫度>pH。在天然鐵蛋白的提取工藝過程中,料液的加熱處理可以有效地去除熱敏感雜蛋白,提高鐵蛋白的提取率。基于鐵蛋白較高的熱穩定性,粗料液熱處理一般于60~75 ℃水浴加熱20 min。
2.2 基因工程制備
利用基因工程的方法,使鐵蛋白基因在宿主細胞中高效表達,可以為鐵蛋白工業化生產奠定基礎。大腸桿菌表達系統遺傳背景清楚,培養周期短并且表達水平高,是目前基因工程制備鐵蛋白的主要表達系統。研究發現多種來源的鐵蛋白基因可以在大腸桿菌表達系統中高效地表達并折疊形成正確的蛋白質三維構象[15-19],如縊蟶蛋白[16]、牡蠣鐵蛋白[17]、大豆鐵蛋白[18]等。相比于生物組織的提取方法,利用DNA重組技術制備鐵蛋白具有產量高、周期短、利于分離純化等特點。基因工程技術制備鐵蛋白的產量會受到外源鐵蛋白基因本身的特性、表達系統、培養條件如溫度、誘導劑以及誘導時間等因素的影響。通過控制宿主細胞的培養溫度、誘導劑濃度及誘導時間可以提升鐵蛋白的產率。夏小雨等[19]探究了中式發酵罐制備人源重鏈鐵蛋白的生產工藝,對攪拌轉速、空氣量以及誘導時間3個關鍵的工藝參數進行了優化,實驗結果表明在中式發酵罐中表達鐵蛋白的最佳攪拌轉速為200 r/min,空氣通量1.6 L/min,表達時間9 h。該研究的開展為工業化制備鐵蛋白納米遞送系統奠定了研究基礎。
2.3 鐵蛋白的鑒定及表征
目前,基于對不同來源鐵蛋白的廣泛研究,系統的鑒定和表征方法得以建立,電泳技術、電鏡技術等是鑒定和表征鐵蛋白最常用的方法。由于鐵蛋白是24個蛋白亞基組成的中空籠形結構蛋白,因此,采用變性電泳、非變性電泳及透射電子顯微鏡技術可以有效地對鐵蛋白的結構進行鑒定和表征。另外,隨著科學技術的快速發展,肽指紋圖譜和X射線晶體衍射技術也逐步被用于鐵蛋白的結構表征。
3 鐵蛋白納米籠包埋外源性小分子的途徑
鐵蛋白具有特殊的籠狀結構,其天然的內部空腔為外源性營養素、藥物等小分子的裝載提供了良好的空間基礎。目前,將食品生物活性物質裝載至鐵蛋白內部空腔的途徑主要依賴于可逆組裝特性的調控和環境響應通道門控特性的調控。
3.1 基于可逆組裝特性的分子裝載途徑
鐵蛋白的亞基以自組裝的方式形成中空的籠形24聚體,維系亞基與亞基之間的相互作用力主要是氫鍵、鹽橋、疏水作用力等弱相互作用力。在一定的物理和化學條件下,鐵蛋白籠形結構可以發生解聚并重新組裝。多數鐵蛋白具有獨特的pH值響應的可逆組裝特性(圖2),即在pH≤2.0或pH≥11.0的條件下,鐵蛋白能夠解離成單亞基狀態,當環境恢復至中性條件時,鐵蛋白亞基又自發的重新組裝,形成中空球狀結構[20]。因此,在鐵蛋白復性的過程中,外源性小分子物質可以通過物理截留以及化學結合的方式有效地包埋于鐵蛋白的內部空腔[21-22]。利用這一可逆組裝特性,已經成功地實現了姜黃素[22]、花青素[23]、胡蘿卜素[24]等多種生物活性物質的裝載。

圖2 鐵蛋白的可逆組裝特性示意圖Fig.2 Schematic diagram of the reversible assembly and disassembly characteristics of ferritin nanocage
鐵蛋白亞基與亞基之間的界面相互作用直接影響著鐵蛋白結構的穩定性。合理修飾或改造界面間的相互作用可以有效地調控鐵蛋白對pH值的敏感程度,進而改善鐵蛋白可逆組裝的條件。CHEN等[25]采用分子裁剪的方法減弱C4界面亞基與亞基之間的相互作用力。研究結果表明該新型蛋白納米籠在pH 4.0條件下解離成亞基,當環境恢復至中性時,解離的亞基可以自發組裝形成籠形結構。同時,復性的過程可以實現姜黃素小分子的裝載。WANG等[26]報道了基于AB loop結構修飾的制備策略,修飾后的鐵蛋白能夠在pH 4.0的條件下自發解離成蛋白亞基,為小分子包埋物的進入提供了結構基礎。相比于動物鐵蛋白,植物鐵蛋白的N端包含EP肽段結構,以交互的方式結合在相鄰亞基的表面[27]。研究發現堿性蛋白酶可以水解紅小豆鐵蛋白的EP肽段結構,進而降低鐵蛋白的穩定性,促使鐵蛋白在pH 4.0的條件下發生解離[28]。相對溫和的可逆組裝特性不僅降低了極端pH環境對包埋物生物活性的影響,同時還可以極大地拓展鐵蛋白納米載體的應用范圍。
脈沖電場、超高壓、輻照、超聲處理等新型物理加工方式能夠影響蛋白質結構內的疏水相互作用、鹽橋、氫鍵以及二硫鍵等分子內相互作用,從而實現蛋白質的物理改性[29]。YANG等[30]采用大氣壓冷等離子體(atmospheric cold plasma,ACP)技術預處理紅小豆鐵蛋白(ted bean seed ferritin,RBF)。研究發現ACP處理RBF之后,RBF結構中的部分α-螺旋結構轉變為無規則卷曲結構,蛋白質結構的穩定性明顯降低。但是鐵蛋白局部結構的轉變并未對RBF四級結構產生較大的破壞。更值得關注的是,穩定性的降低使得RBF可以在pH 4.0的條件下解離成單亞基,當溶液pH值恢復至中性時,解離的亞基又可以重組裝成中空球狀結構。基于這一特性,ACP處理后的RBF能夠在溫和條件下裝載姜黃素小分子。MENG等[31]研究了脈沖電場(pulsed electric fields,PEF)對RBF結構的影響,PEF預處理BRF使得部分α-螺旋結構被破壞,RBF穩定性降低。進一步研究發現,PEF處理后的RBF具有溫和的可逆組裝特性(pH 3.6)。而且,在該實驗條件下,蘆丁的包埋率可以達到13.7 %。最近,MENG等[32]報道了一種基于壓熱聲處理(manothermosonication,MTS)技術改善RBF可逆組裝特性的研究,實驗結果表明,MTS技術將RBF解離成亞基所需要的臨界pH值提升至3.6,并且在該條件下實現了表沒食子兒茶素沒食子酸酯(epigallocatechin gallate,EGCG)的高效裝載。因此,采用物理加工方式對鐵蛋白進行改性,可以改善鐵蛋白的可逆組裝條件,進而實現鐵蛋白在溫和的條件下裝載小分子。
3.2 基于環境響應的通道“門控”特性的分子裝載途徑
鐵蛋白封閉的殼狀結構表面分布著8個三重軸通道和6個四重軸通道,這些通道的尺寸大小為0.3~0.5 nm,是連接內部空腔與外環境的主要橋梁。金屬離子、水分子等尺寸較小的離子或者分子可以自由擴散進出鐵蛋白。相反,分子質量較大的生物活性物質由于通道尺寸的限制并不能自由地進出鐵蛋白[1]。植物源鐵蛋白的這些通道在特殊環境下并不是完全的剛性結構,而是表現出一定的柔性特質,即環境響應的通道“門控”特性(圖3)。這一發現為生物活性小分子進入鐵蛋白內部空腔提供了新的裝載途徑[33-36]。低濃度尿素、鹽酸胍、熱處理等均可誘發鐵蛋白的通道尺寸(Dchannel)發生變化,進而為小分子進入鐵蛋白內部空腔敞開“大門”;當改變誘發條件時,變大的通道可逆性的恢復至原始的剛性結構,進而完成“大門”關閉及小分子的封裝。
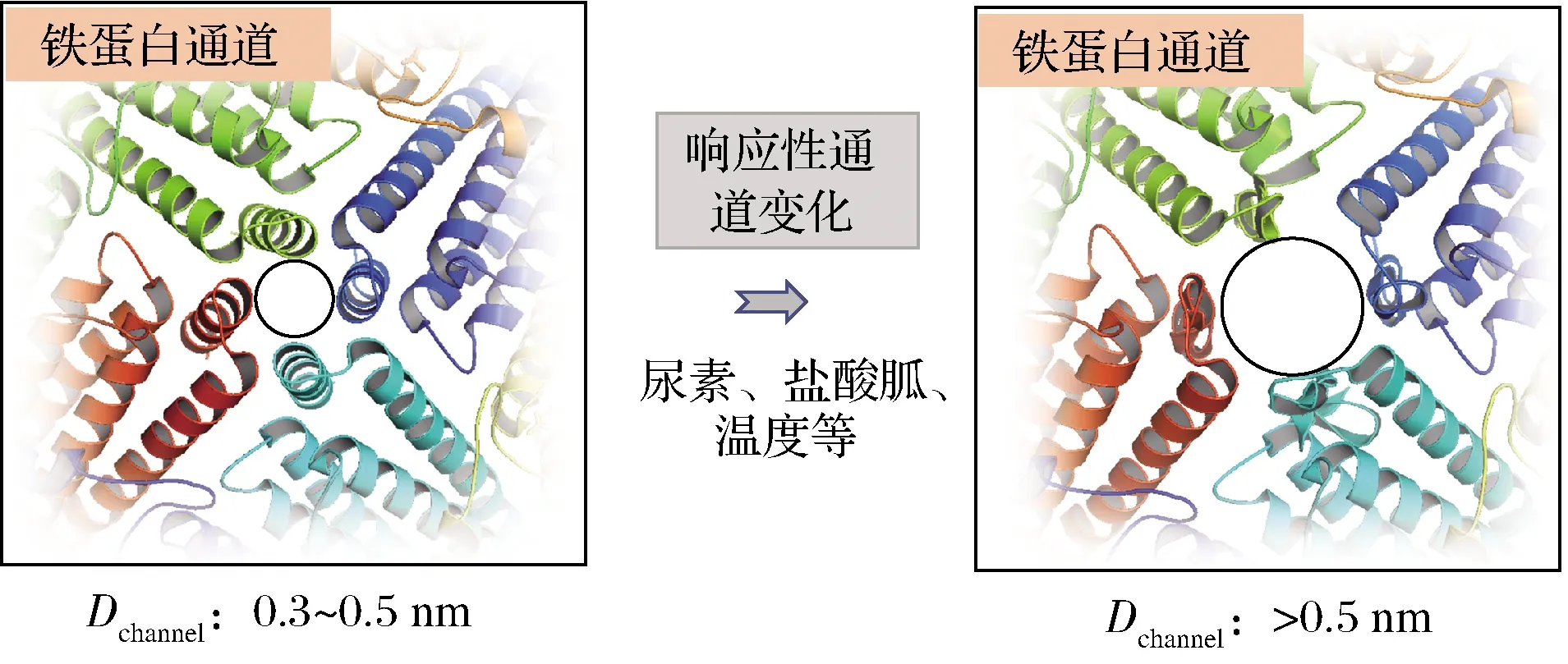
圖3 響應性的鐵蛋白通道變化Fig.3 Stimulus-responsive channel of ferritin
尿素分子會破壞蛋白質內部的弱相互作用力,進而導致蛋白質發生不同程度的變性,并且蛋白質的變性程度依賴于尿素的工作濃度。YANG等[33]研究發現,低濃度的尿素(20 mmol/L)處理紅小豆鐵蛋白不會破壞鐵蛋白的球狀結構,但會誘導鐵蛋白四重軸通道尺寸變大;圓二色譜結果顯示,這種響應性的通道尺寸變化可能與鐵蛋白亞基C端的E螺旋結構的變性密切相關。低濃度誘發的E螺旋結構變性是可逆的,透析去除尿素之后,變大的通道恢復至變性前的剛性結構。基于尿素響應性的通道“門控”特性,紅小豆鐵蛋白可以成功封裝EGCG、綠原酸和花青素等小分子物質;相比于pH誘導鐵蛋白可逆組裝的裝載途徑,鐵蛋白裝載小分子的包埋率相差無幾。鹽酸胍(GuHCl)與尿素分子具有類似的功能,均能夠影響蛋白質結構;研究表明2 mmol/L鹽酸胍處理大豆鐵蛋白(soybean seed ferritin,SSF)也可達到類似的“門控”特性[34]。蛋白質受到加熱處理時,結構內部的次級鍵發生不同程度的破壞,導致局部構象變化甚至不可逆的徹底變性。YANG等[35]評估了不同溫度對鐵蛋白整體結構以及局部構象的影響,發現大豆鐵蛋白在60 ℃加熱30 min后,鐵蛋白局部構象發生變化,通道尺寸變大;當溫度降低至20 ℃時,局部構象的變化得以恢復。基于溫度響應的通道“門控”特性,鐵蛋白裝載蘆丁的包埋率為8.08 %。最近,張晨曦等[36]采用超聲輔助加熱的方法制備鐵蛋白-蝦青素包埋物,研究發現超聲(100 W)處理人H型鐵蛋白(HuHF)30 min,誘發鐵蛋白的通道發生變化的溫度降低至40 ℃。綜上所述,環境響應的通道“門控”特性為鐵蛋白裝載食品功能性活性分子提供了新途徑,并且可有效地避免因極端酸性或者堿性環境對包埋物造成的結構破壞和活性損失。值得注意的是,基于通道“門控”特性裝載活性物質的途徑極大地受限于被包埋物的分子大小,因為過度的通道尺寸變化會導致鐵蛋白整體結構的破壞。
4 鐵蛋白納米籠在食品生物活性物質裝載方 面的應用
4.1 改善脂溶性活性物質的水溶性
食品中含有許多對人體有益的脂溶性活性物質,如胡蘿卜素類、黃酮類化合物等,通常具有抗氧化、抗炎和抗癌等功能[37-38]。然而,這些活性成分具有較差的水溶性,極大地限制了其在食品工業中的應用。不同來源的鐵蛋白的外表面分布著較多的親水性氨基酸及負電荷氨基酸,因此,具有很好的水溶性和單分散性;另外,相比于植物來源的鐵蛋白,動物鐵蛋白通常表現出更高的水溶性,因此,被廣泛用于改善脂溶性活性成分的水溶性。CHEN等[24]利用pH誘導的可逆組裝特性將脂溶性的β-胡蘿卜素包埋于HuHF的內部空腔,使β-胡蘿卜素在水溶液中的溶解性發生了顯著的改變。而且,鐵蛋白-β-胡蘿卜素復合物的制備過程不會對鐵蛋白本身的溶解性產生負面影響。除此之外,多種植物鐵蛋白如大豆鐵蛋白、紅小豆鐵蛋白等也被用作載體材料負載脂溶性活性物質。目前,脂溶性生物活性物質如姜黃素[22]、蝦青素[36]、蘆丁[39]、葉黃素[40]等均可以借助于鐵蛋白納米顆粒改善其在水溶液中的溶解性。
4.2 增強活性物質的穩定性
4.3 提高活性物質的生物利用度
LV等[45]探究了植物鐵蛋白和動物鐵蛋白在人體腸胃中的穩定性及其細胞吸收機制,體外模擬消化實驗和小鼠體內消化實驗結果證實動物和植物鐵蛋白可以通過腸胃屏障抵達小腸;Caco-2細胞模型顯示動植物鐵蛋白以受體介導的內吞作用吸收進入細胞,并且吸收效率與鐵蛋白種類及亞基組成密切相關。因此,利用鐵蛋白納米顆粒負載生物活性物質可以有效地克服其生物利用度低的缺點。ZHANG等[23]利用SSFH-2包埋花色苷cyanidin-3-O-glucoside (C3G),經測定平均每個SSFH-2內部空腔裝載了37.5個C3G分子。通過分析游離C3G和SSFH-2-C3G復合物的單細胞吸收和粘附效果,結果表明SSFH-2-C3G復合物能夠以內吞的方式吸收進入細胞,相比于游離的C3G分子,包埋復合物具有較高的吸收效率,而且粘附并截留在Caco-2細胞表面的含量更低,更加有利于C3G分子的腸道吸收。而且,較高的細胞吸收效率可顯著提高生物活性物質在體內的功能特性[46]。
4.4 靶向運輸活性物質
研究發現轉鐵蛋白受體1(transferrin receptor 1,TfR1)是HuHF進入細胞的重要受體分子之一,它們之間較高親和力的結構基礎主要源于HuHF的AB loop及其周圍結構[47]。由于大多數癌細胞在生長增殖的過程中會過度地表達TfR1。因此,HuHF對多種癌細胞都表現出特異性的識別和靶向性[48]。生物活性物質具有抗炎、抗氧化、抗癌等功能,在癌癥治療方面發揮著積極的作用。PANDOLFI等[49]采用堿性條件解離HuHF的策略成功裝載姜黃素小分子,制備出了水溶性良好的鐵蛋白-姜黃素(Curcumin-HuHF,CFn)納米復合物;通過TfR1介導的內吞作用,CFn納米顆粒能夠有效地將姜黃素小分子靶向遞送到乳腺癌細胞,并通過抑制Akt 的磷酸化活性殺傷癌細胞。相比于游離的姜黃素分子,CFn納米復合物表現出更好的治療效果。
4.5 發揮生物活性物質的協同效應
2種或多種生物活性物質混合后,在抗炎、抗氧化、抗癌等方面往往能表現出生物協同效應。然而,由于不同生物活性物質在溶解度、細胞吸收途徑、細胞吸收效率等方面存在差異,使得它們在生物體內協同效應的發揮受到極大的影響。MANSOURIZADEH等[22]利用馬脾鐵蛋白(equine spleen apoferritin,HoS-Apo)的可逆組裝特性,將槲皮素和姜黃素裝載于其內部空腔,獲得了槲皮素-姜黃素-鐵蛋白三元納米復合物;相比于二者的簡單混合,三元復合物同時提高了槲皮素和姜黃素的生物利用度和癌細胞靶向性,對人乳腺癌細胞(human breast cancer cell,MCF7)表現出更高的協同殺傷效果,抑制和殺傷MCF7細胞所需的劑量顯著降低。封裝于鐵蛋白內部空腔后可顯著降低其對MCF10A細胞的毒副作用。另外,在不影響鐵蛋白內部空腔裝載能力的前提下,其外表面也可以用于負載某些特殊的生物活性小分子。MENG等[50]利用堿性條件誘發橙皮素共價結合于鐵蛋白外表面,制備了橙皮素-鐵蛋白納米復合物。研究發現橙皮素的共價結合對鐵蛋白的可逆組裝特性并未產生顯著影響,橙皮素-鐵蛋白二元納米復合物的內部空腔可進一步裝載多種生物活性物質,如槲皮素[50]。因此,該研究為充分發揮橙皮素和其他生物活性物質的協同作用提供了研究基礎。
5 結束語
食品中的許多生物活性物質容易受到光、熱、金屬離子等環境因素的作用而發生結構破壞和生物活性的降低,而且多數生物活性物質具有較差的水溶性,這些因素限制了其在功能食品開發以及臨床輔助治療上的應用。鐵蛋白是廣泛存在于生物體內的鐵貯藏蛋白,其獨特的納米籠形結構和裝載特性可以將外源性小分子包埋于內部空腔,以此隔絕外部環境的干擾。鐵蛋白具有良好的水溶性、單分散性、穩定性、細胞吸收效率以及細胞靶向性。因此,鐵蛋白作為一種新型的蛋白質納米載體,在穩定生物活性物質的結構、保護生物活性以及提升生物利用率等方面展現出巨大的應用前景。目前,鐵蛋白包埋生物活性物質的研究主要聚焦于鐵蛋白裝載率的提升、裝載途徑的工藝優化、以及生物活性成分的保護,而對于生物活性分子-鐵蛋白復合物在腸胃中的穩定研究以及體內緩釋研究相對較少[40]。由于受到腸胃酸性環境影響以及各種酶的作用,鐵蛋白載體在抵達小腸之前,部分鐵蛋白遭受結構性破壞,內容物易發生泄漏。因此,如何減少或者防止鐵蛋白納米載體在腸胃中的損失仍需要進一步的研究。另外,基于鐵蛋白納米復合物的可控釋放相關的研究仍然處于起步階段,鐵蛋白納米復合物對外界環境響應性的釋放內容物對生物活性分子功能的發揮具有重要意義,如何實現鐵蛋白納米復合物的可控釋放將是鐵蛋白納米載體在食品生物活性物質遞送以及醫藥領域的重要研究方向。

