電子穿梭體核黃素對菌株Clostridium sp. LQ25異化鐵還原性質的影響
袁 媛,劉洪艷
(天津科技大學海洋與環境學院,天津 300457)
微生物氧化分解釋放出電子,電子經呼吸鏈從有 機物傳遞到胞外電子受體,此過程稱為胞外電子傳遞(extracellular electron transfer,EET)[1].胞外電子傳遞過程經歷兩個階段[2]:第一階段是有機物被氧化后產生的電子,經由電子傳遞鏈上的組分傳遞至細胞內膜,再由細胞色素蛋白或其他功能蛋白傳遞至細胞外膜;第二階段是電子從細胞外膜到末端電子受體的傳遞,主要的4種方式為直接接觸、納米導線機制、應電運動和電子穿梭機制[3].
異化鐵還原是指微生物將有機物中的電子轉移到以Fe(Ⅲ)為末端的電子受體的過程,并在這一過程中將Fe(Ⅲ)還原為Fe(Ⅱ).希瓦氏菌和地桿菌作為呼吸型異化鐵還原菌中的模式菌,在其胞外電子傳遞過程中,細胞色素c作為不可缺少的一類蛋白質,不僅可以將電子從細胞內膜轉移到細胞外膜,而且可以分泌到細胞外,作為外膜蛋白參與細胞表面的電子傳遞[4].Breuer等[5]總結菌株Shewanella oneidensisMR-1存在16種細胞色素c,包括MtrC、MtrF、OmcA、MtrA、MtrD、CymA等.對于呼吸型異化鐵還原細菌,胞外電子傳遞機制的研究主要集中于直接接觸機制.而在研究發酵型異化鐵還原細菌Anoxybacter fermentansDY22613T的胞外電子傳遞機制時,Li等[6]未發現該菌株的全基因組序列中有編碼細胞色素c的基因.對于缺少細胞色素c的發酵型異化鐵還原細菌,利用電子穿梭體可能是胞外電子傳遞的一種策略[7].
電子穿梭體作為胞外電子傳遞的重要組成部分,可介導微生物間、微生物與電子受體間以及電子供體與電子受體間的電子轉移[8].電子穿梭體參與微生物胞外電子傳遞的基本過程:氧化態電子穿梭體接受電子變成還原態,還原態電子穿梭體將電子傳遞給胞外的電子受體完成一次電子傳遞,而自身因失去電子又變回氧化態進行新一輪的電子傳遞[9].電子穿梭體按照來源可分為內源電子穿梭體和外源電子穿梭體.內源電子穿梭體是依靠微生物自身分泌的氧化還原物質,實現電子從供體到受體的傳遞,而外源電子穿梭體是環境中原來就存在的或是人為添加物,在微生物胞外電子傳遞過程中起到呈遞電子的作用;按照化學組成可分為黑色素類、吩嗪類、腐殖質類、醌類和黃素類[10-14].
核黃素作為電子穿梭體是由Canstein等[7]發現并確定的,其研究結果表明菌株奧奈達希瓦氏菌(Shewanella oneidensis)MR-1分泌胞外電子穿梭體黃素單核苷酸(FMN)和核黃素,用于促進菌株MR-1生長和加速還原結晶度較差的Fe(Ⅲ)氧化物.除希瓦氏菌(Shewanellasp.)外,研究者發現在多株細菌中,核黃素具備增強電子傳遞的能力,例如硝酸鹽還原菌(Bacillus licheniformis)[15]可以利用希瓦氏菌分泌的核黃素加速不銹鋼的腐蝕,而鐵呼吸菌(Methylophilussp.)[16]和絲狀芽胞桿菌(Cystobasidium slooffiae)[17]均能自身分泌核黃素,前者用于異化鐵還原的胞外電子傳遞,后者用于提高其生物電產量.核黃素通常以游離的形態作為電子穿梭體發揮作用,即菌體分泌的核黃素在細胞內接受電子變為還原態,而后還原態的核黃素通過擴散將電子呈遞至電子受體,自身又變回氧化態,以此過程不斷循環[18].也有研究發現核黃素在促進菌株電子傳遞的過程中并非是單一的發揮作用,而是可以作為細胞色素c和MtrC的輔因子以促進電子傳遞[11,19-20].
本實驗以分離自海洋沉積物中的菌株Clostridiumsp. LQ25為研究對象,分析電子穿梭體核黃素對菌株異化鐵還原性質的影響及菌株分泌核黃素的規律,旨在為探究發酵型異化鐵還原細菌的胞外電子傳遞機制提供新的思路.
1 材料與方法
1.1 菌株來源
菌株Clostridiumsp. LQ25[21]由本課題組成員從海洋沉積物中分離得到,GenBank號為MK156151.
1.2 培養方法
培養基成分:葡萄糖20.0g/L,L-半胱氨酸0.5g/L,NaCl 4.0g/L,MgCl20.1g/L,K2HPO41.5g/L,酵母粉1.0g/L,胰蛋白胨4.0g/L,200mmol/L氫氧化鐵溶液25mL/L.
200mmol/L 氫氧化鐵溶液:稱取 16.23g FeCl3·6H2O溶于666mL去離子水中,待完全溶解后使用5mol/L NaOH溶液調節pH至7.0±0.5,最后用去離子水反復洗滌沉淀并定容至300mL,裝瓶備用.
培養條件:pH 7.0±0.5,溫度35℃,置于厭氧罐(英國Oxoid AnaeroJar公司)培養36h.
1.3 異化Fe(Ⅲ)還原性質
以氫氧化鐵為電子受體,厭氧培養菌株50h,間隔取樣,測定累積Fe(Ⅱ)濃度,并以此表示菌株LQ25鐵還原能力,分析菌株LQ25異化鐵還原性質.
1.4 電子穿梭體
外源核黃素:設置核黃素濃度梯度為0、20、40、80、100、120、140mg/L,菌株LQ25分別接種于上述含不同濃度電子穿梭體的培養液中,3組平行樣.厭氧培養24h后,測定累積Fe(Ⅱ)濃度,分析外源電子穿梭體對異化鐵還原細菌LQ25鐵還原性質的影響.
內源核黃素:核黃素避光取樣,7600g離心15min,用0.22μm濾膜過濾.間隔時間取樣,分別測定菌體密度A600和核黃素分泌量,分析菌體分泌核黃素的規律.
1.5 測定方法
菌株生長測定:分光光度計測定菌液A600,以此值表示菌株生長狀況.
Fe(Ⅱ)濃度測定:采用菲洛嗪(Ferrozine)分光光度法測定[22].取0.1mL培養后菌液的上清液,加入到5.0mL菲洛嗪溶液(0.4g菲洛嗪、4.766g 4-羥乙基哌嗪乙磺酸(HEPES)溶于400mL蒸餾水)中,振蕩15s,靜置30min使其顯色完全,分光光度計測定A562.
核黃素含量的測定:采用核黃素熒光分光光度法測定[23].使用日立F-7100型熒光分光光度計測定樣品中核黃素在發射波長處的相對熒光強度.首先配制2.5μg/mL的核黃素標準品,用0.22μm濾膜過濾后避光備用,然后掃描標準品的激發光譜,并從中找出吸收波長作為激發波長;設置儀器激發波長,掃描標準品的發射光譜,從中找出吸收最強時對應的波長作為發射波長;設置激發波長后,在460~600nm的范圍內測定樣品在發射波長處的熒光強度.利用相對熒光強度表示核黃素的含量.首先直接測定樣品在發射波長處的熒光強度,記為EM1;接著在樣品中添加0.1mL 20%連二亞硫酸鈉溶液,再次測定樣品在發射波長處的熒光強度,記為EM2;最終樣品發射波長的相對熒光強度為EM=EM1-EM2.
1.6 數據處理
所有實驗均設置3個平行樣,數據表示為“平均值±標準差”;使用t檢驗對實驗組與對照組之間差異進行顯著性分析,*表示有顯著差異(P<0.05),**表示有極顯著差異(P<0.01).
2 結果與討論
2.1 外源核黃素對菌株LQ25異化鐵還原的影響
不同質量濃度的外源核黃素(VB2)對菌株LQ25異化鐵還原的影響如圖1所示.在設置的質量濃度范圍內,核黃素的添加均能促進菌株LQ25的Fe(Ⅲ)還原能力.與對照組(無核黃素添加)相比,實驗組的核黃素質量濃度為20mg/L時,菌株LQ25的Fe(Ⅲ)還原能力無明顯提高(P>0.05);核黃素質量濃度為40mg/L時,菌株LQ25的Fe(Ⅲ)還原能力顯著提高(P<0.05);核黃素質量濃度在80~120mg/L的范圍內,菌株LQ25的Fe(Ⅲ)還原能力被極顯著提高(P<0.01);核黃素質量濃度為140mg/L時,菌株LQ25的Fe(Ⅲ)還原能力無明顯提高(P>0.05).其中當培養基中核黃素質量濃度為100mg/L時,菌株LQ25還原Fe(Ⅲ)的量達到最高,累積Fe(Ⅱ)濃度為(7.73±0.05)mmol/L,當培養基中的核黃素質量濃度高于100mg/L時,菌株LQ25還原Fe(Ⅲ)的量又會降低.
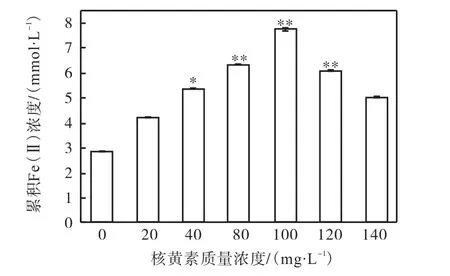
圖1 不同濃度的外源核黃素(VB2)對菌株LQ25異化鐵還原的影響Fig. 1 Effect of different concentrations of exogenous riboflavin(VB2)on dissimilation iron reduction of strain LQ25
Fuller等[24]研究發現鐵還原混合菌群在添加核黃素的培養條件下,其Fe(Ⅱ)濃度比空白組的有所增加,從而推測核黃素可能對胞外Fe(Ⅲ)還原作用較大.You等[25]在接種巨大芽胞桿菌(Bacillus megaterium)LLD-1的微生物燃料細胞中加入100nmol/L核黃素后,輸出電壓和輸出電流分別提高了2.8倍和3.7倍,從而證明菌株LLD-1培養液中的核黃素可以作為電子穿梭物,加強菌株LLD-1向電極的電子傳遞.Yang等[16]為了驗證核黃素對噬甲基菌屬(Methylophilussp.)培養過程中電子傳遞作用的影響,比較了添加核黃素組與不加核黃素組的Fe(Ⅲ)還原率,結果顯示前者的Fe(Ⅲ)還原率提高了33%,這表明Fe(Ⅱ)的增加是由于核黃素促進了胞外電子傳遞.Jin等[15]發現地衣芽胞桿菌(Bacillus licheniformis)和S. oneidensis的混合培養對于金屬腐蝕具有協同作用,后經研究證實是由于菌株S. oneidensis分泌的電子穿梭體核黃素提高了B. licheniformis的細胞外電子傳遞效率.Moradian等[17]在Cystobasidium slooffiaeJSUX1的培養過程中添加核黃素,其最高輸出電流約為不添加核黃素的3倍,表明核黃素能促進電子傳遞過程.
2.2 菌株LQ25分泌核黃素的含量
經測定,激發波長為425nm.核黃素在520nm處有熒光發射,但環境中的血紅素可將其猝滅.Miyuki等[23]通過監測此處的熒光發射強度的變化,探測核黃素與蛋白復合物OmcZ的結合情況,結果表明熒光分光光度法可以鑒定出微摩爾級別的核黃素濃度.在本實驗中,外源核黃素標準品和內源核黃素樣品的熒光發射峰對比如圖2所示.
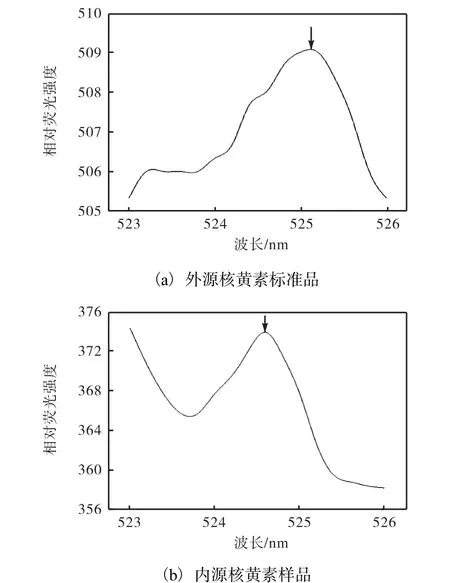
圖2 外源核黃素標準品和內源核黃素樣品熒光發射峰對比Fig. 2 Comparison of fluorescence emission peak between exogenous riboflavin standard and endogenous riboflavin sample
外源核黃素標準品的熒光發射峰大約在525nm處,內源核黃素樣品的熒光發射峰在524.5nm左右.此外,實驗同時測定了無生物培養基中的核黃素熒光發射峰,結果顯示培養基不含有核黃素.這表明培養液中核黃素熒光發射峰是由于菌株LQ25分泌產生的.由此通過測定525nm處的熒光發射強度,表示菌株培養過程中產生的核黃素含量.
2.3 不同培養時間下核黃素分泌量變化
菌株LQ25生長與核黃素分泌量隨時間的變化如圖3所示.培養0~10h為菌株生長遲緩期,最大菌體密度A600為0.26±0.01,在此期間未測出核黃素的熒光發射峰;培養10~15h為菌株對數生長期,最大菌體密度A600為1.32±0.06,核黃素的相對熒光強度最高可達11.30±2.00;培養15~35h為菌株生長穩定期,最大菌體密度A600為1.41±0.02,核黃素的相對熒光強度在培養20h時達到最高,為49.50±3.92;培養35h后為菌體的衰退期,菌體密度A600降低,核黃素的相對熒光強度逐漸降低并于40h后熒光發射峰消失.
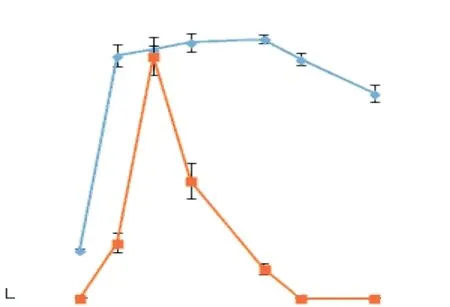
圖3 菌株LQ25生長與核黃素分泌隨時間的變化Fig. 3 Growth and secretion curve of riboflavin of strain LQ25
由此可見,菌體生長狀態和核黃素分泌關系密切,菌株LQ25在旺盛生長時期分泌核黃素,這有利于電子傳遞合成ATP用于自身生長,隨著菌體生長減緩,電子傳遞過程減弱,分泌核黃素也減少.Baron等[26]發現突變體Shewanella oneidensisMR-1(保留編碼核黃素基因)在無外源核黃素的培養條件下仍能檢測到存在電子轉移,然后使用循環伏安法確定核黃素添加前后的菌液電位均在同一電位處,以上結果表明這種電子轉移的產生是由菌株自身分泌核黃素導致的.周雨行等[27]研究菌株Shewanella oneidensis的氧化還原特征峰強度變化,其峰強度經歷了由弱增強再減弱的過程,這表明微生物的生長導致大量核黃素產生,電子傳遞速率加快;當培養基中的物質逐漸耗盡時,微生物的生長活性減弱并進入生長后期,電子傳遞過程被削弱,因此氧化還原峰強度開始減小.Song等[28]比較Pachysolen tannophilus的生長和核黃素分泌隨時間變化的關系,認為菌株P. tannophilus主要在對數生長期分泌核黃素,這與本實驗菌株LQ25的分泌規律相似.Jain等[29]發現菌株Shewanella loihicaPV-4在一定時間內,隨著孵育時間的增加,培養液中核黃素的相對峰值強度呈現逐漸增加的趨勢.Tian等[30]研究發現微生物燃料電池中的蠟樣芽胞桿菌(Bacillus cereus)DIF1和赤紅球菌(Rhodococcus ruber)DIF2在生長到對數期之前,核黃素濃度不斷增加,對數生長期后核黃素濃度又會降低.
大多數細菌可自行分泌核黃素,并且能將核黃素轉化為FMN和黃素腺嘌呤二核苷酸(FAD),FMN和核黃素可被分泌到胞外,作為電子穿梭體發揮功能,其濃度高低表征著細胞的生長狀態,而FAD主要存在于胞內,可作為細胞裂解的指標[30].由菌株LQ25的生長曲線可知,在培養的前20h,菌株LQ25大量分泌的核黃素用于胞外電子傳遞以供給生長,此后由于培養基中營養物質等的消耗及生長環境中有害分泌物的積累,導致菌株逐漸走向衰亡,因此推測菌株LQ25分泌的核黃素在培養20h后逐漸分解.此外,實驗未采用避光的黑暗培養,長時間的光照也會促使菌株LQ25分泌的核黃素降解[26].
2.4 異化鐵培養條件下核黃素分泌量變化
以氫氧化鐵為電子受體,對菌株LQ25核黃素分泌量的影響進行研究,結果如圖4所示.
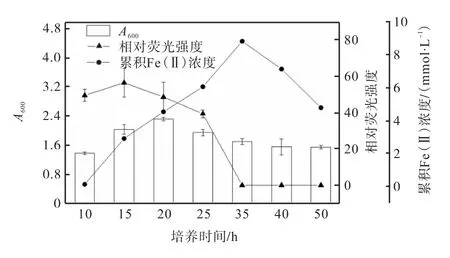
圖4 菌株LQ25生長、核黃素分泌及累積Fe(Ⅱ)濃度隨時間的變化Fig. 4 Changes of growth,secretion of riboflavin and Fe(Ⅱ) concentration of strain LQ25 with time
由圖4可知:培養前10h,菌株LQ25經歷快速繁殖的對數生長期,在此階段核黃素分泌逐漸增加;10h之后進入穩定生長期,20h時菌體密度A600達到最大,為2.32±0.05,15h時培養液中核黃素的相對熒光強度達到最高,為56.23±7.93;20h后菌株開始衰退,菌體密度A600降低,核黃素的相對熒光強度逐漸降低并于35h后熒光發射峰消失.菌株LQ25在培養過程中分泌積累的核黃素呈現逐漸增強再減弱的變化.在對照組(無氫氧化鐵添加)條件下培養20h時,菌株LQ25中核黃素含量才達到峰值,20~25h降低51.43%,25~30h降低36.43%;實驗組條件下,菌株LQ25分泌積累的核黃素最高值提前至15h,15~20h降低13.98%,20~25h降低16.32%,25~35h降低39.41%.
對比實驗組和對照組的核黃素相對熒光強度最高值,實驗組的是對照組的1.14倍,實驗組中氫氧化鐵可能作為電子受體促進了菌體分泌核黃素.Li等[22]對菌株Anoxybacter fermentansDY22613T培養液的高效液相色譜分析發現,核黃素確實在對數期產生,添加氫氧化鐵組相比不添加組發酵產生的核黃素濃度高 2倍.Liu等[31]的研究結果顯示,在3.8μmol/L苯存在下,微生物不僅保持了完整的細胞形態,并且60h還原Fe(Ⅲ)形成Fe(Ⅱ)的量是無苯條件下的2倍,微生物對Fe(Ⅲ)還原的促進歸因于苯誘導的細胞膜通透性的增加,促進了胞外電子傳遞和核黃素作為電子穿梭因子或輔因子的分泌和釋放.
菌株LQ25還原Fe(Ⅲ)并不是與生長同時進行的,培養前10h生長旺盛,但幾乎不進行Fe(Ⅲ)還原;培養10~35h時,菌株LQ25大量進行Fe(Ⅲ)還原,35h時培養液中累積的Fe(Ⅱ)濃度達到最高值(8.79±0.01)mmol/L;35h后培養液中累積的Fe(Ⅱ)濃度逐漸減少,由此可見Fe(Ⅲ)的還原過程主要是在菌株生長的后期.
相比對照組(無氫氧化鐵添加),菌株LQ25在35h達到生長高峰,氫氧化鐵的加入使得菌株LQ25在20h就達到菌體密度最大值,且此刻菌體密度是未添加氫氧化鐵的3.27倍.宋文杰等[32]在腐敗希瓦氏菌(Shewanella putrefaciens)的培養基中加入檸檬酸鐵,實驗結果顯示Fe(Ⅱ)濃度與其生物活性存在極顯著的正相關關系,表明Fe(Ⅲ)還原與微生物的生長耦合在一起.劉洪艷等[33]發現在菌株Klebsiellasp. KB52的生長過程中,無論添加不可溶性電子受體氫氧化鐵還是添加可溶性電子受體檸檬酸鐵,菌株KB52的細胞生長均高于未添加電子受體的對照組.
菌體分泌核黃素和還原Fe(Ⅲ)密切相關,核黃素的分泌能達到最大積累量主要是在菌體培養前期,還原Fe(Ⅲ)這一過程主要是在培養后期進行.這可能是由于核黃素作為電子穿梭體,將菌體通過分解葡萄糖等營養物質獲得的電子從胞內轉移至胞外,轉移到胞外的電子可用于不溶性氫氧化鐵的還原,從而使得培養基中會在菌體培養的后期大量積累Fe(Ⅱ).Dereven’kov等[34]在水鈷胺素(H2OCbl)和NADH的混合物中添加的核黃素顯著加速了Cbl(Ⅱ)的積累,并且還原速率與核黃素濃度呈線性關系,證明了核黃素對NADH向水合鈷胺電子轉移的催化作用.周雨行等[27]在探究S. oneidensis的鐵硫還原過程時發現,核黃素的加入將菌株的鐵硫轉化能力提高了3倍,從而推測核黃素是作為電子穿梭體參與到菌株的電子傳遞過程中,并將電子從乙酸鹽呈遞給單質硫和黃鉀鐵礬.Zhou等[35]在S. oneidensisMR-1降解磺胺甲惡唑(SMX)的過程中加入了不同濃度的核黃素,其最大降解率能達到95.3%,從核黃素介導的SMX降解和鐵還原的總體性能看,SMX的降解率隨著鐵還原的加強而逐漸增加.
2.5 外源核黃素對菌株LQ25異化鐵還原性質分析
外源核黃素對菌株LQ25異化鐵還原性質分析結果如圖5所示.培養20h,菌株LQ25的菌體密度相比對照組(無氫氧化鐵添加)的菌體密度無顯著變化(P>0.05);培養25h,菌株LQ25累積Fe(Ⅱ)濃度為(9.05±0.02)mmol/L,并且隨著培養時間的延長,菌株LQ25累積Fe(Ⅱ)濃度還將持續上升.
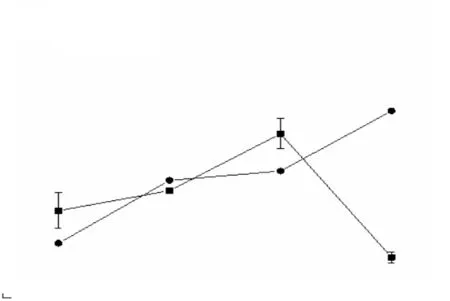
圖5 外源核黃素對菌株LQ25異化鐵還原性質分析Fig. 5 Dissimilated iron reduction properties of strain LQ25 by riboflavin
外源核黃素對菌株LQ25的生長幾乎無影響,但能促進菌株LQ25進行異化鐵還原.Yarlagadda等[36]也證明外源電子穿梭體對菌株Clostridiumsp. BC1的生長幾乎沒有影響.List等[37]分析不同來源的電子穿梭體對菌株丙酮丁醇梭菌(Clostridium acetobutylicum)的異化鐵還原性的影響,結果表明外源蒽醌-2-磺酸(AQS)和內源核黃素均能增強菌株的異化鐵還原能力,這與本實驗的研究結果相似.
3 結 語
(1)外源核黃素可以促進菌株LQ25的異化鐵還原能力,當核黃素質量濃度為100mg/L時,異化鐵還原能力最高,相比對照組提高了63.26%.
(2)在設定的培養時間內,通過熒光分光光度法測定核黃素,菌株LQ25具有分泌核黃素的能力,最高相對熒光強度可達56.23±7.93.
(3)菌株LQ25核黃素分泌量受到培養時間、Fe(Ⅲ)濃度等因素的影響.目前對呼吸型異化鐵還原細菌胞外電子傳遞機制的研究較為深入,相比之下,發酵型異化鐵還原細菌胞外電子傳遞機制還有待進一步的揭示.本研究結果為豐富發酵型異化鐵還原細菌胞外電子傳遞機制提供了理論支持.

