西昌市某奶牛場犢牛腹瀉的病原學檢測
李 昊,周可磊,唐國強,陳世云,彭艷伶
(1.西昌學院動物科學學院,四川 西昌 615013;2.四川省涼山州動物疫病預防控制中心,四川 西昌 615050;3.四川省西昌市農業農村局,四川 西昌 615000)
犢牛腹瀉一年四季均可發生,尤其以冬季和早春多發,且3 周齡以內的犢牛更容易發生[1]。導致犢牛腹瀉的主要病因分病毒性、細菌性、寄生蟲性和營養性,病毒感染是引起腹瀉的重要原因且易引起系統損傷和免疫抑制,導致犢牛生產性能下降甚至死亡[2]。近年來,我國各個地區對犢牛腹瀉的流行病學調查都有很多報道[3-5],然而,針對四川省涼山州西昌市犢牛腹瀉的病原調查未見報道。本次采集西昌市某奶牛場22 頭有臨床腹瀉癥狀的犢牛腹瀉糞便樣本,對常見的重要病原進行檢測,以摸清犢牛腹瀉的病原種類和流行規律,為西昌市犢牛腹瀉防控提供參考依據。
1 發病情況
該奶牛場于2020年先后進行了口蹄疫、牛出敗、牛病毒性腹瀉/黏膜病病毒(BVDV)-牛傳染性鼻氣管炎(IBR)二聯滅活苗的免疫,飼喂經巴氏消殺的抗生奶、代乳粉、誘食料。現有犢牛135頭(未斷奶犢牛83頭),2021年1月犢牛發生腹瀉(腹瀉主要發生于30 日齡前,個別2 日齡也出現腹瀉),現場調查腹瀉犢牛22 頭,發病率達16.30%。主訴該場發病率最高達40%,死亡率為10%。腹瀉發生后,采用恩諾沙星注射液(肌注0.025 mL/kg)、磺胺間甲氧嘧啶注射液(肌注0.2~0.3 mL/kg)、土霉素片(內服15 mg/kg)進行治療,但效果不佳。
2 材料和方法
2.1 樣本采集 2021 年1 月對該奶牛場22 頭腹瀉犢牛逐一采集糞便樣本,隨后冷藏運輸并儲存在-80 ℃。
BCoV、BRV、BVDV、BNoV、NeV、BPV、BToV及大腸桿菌、沙門氏菌、巴氏桿菌等陽性毒(菌)株均由西南民族大學動物醫學實驗室提供。
2.2 主要試劑及儀器 Trizol 試劑RNAiso Plus(Code No.9109)、反轉錄試劑盒PrimeScriptTMRT Reagent Kit(Code No.RR037A)、TaKaRa Ex Taq 酶、TB Green Premix Ex Taq Ⅱ、Premix Ex TaqTM(Probe qPCR)、6×DNA Loading Buffer、DL2000 DNA Marker、pMDTM19-T 克隆載體、感受態細胞E.coli DH5α Competent Cells等購于寶生物工程(大連)有限公司;膠回收試劑盒Gel Extraction Kit D2500 和質粒提取試劑盒Plasmid Mini Kit I 購于Omega Bio-Tek 公司;氯仿、蛋白酶K、異戊醇、SDS(10%濃度)、STE等DNA提取常規試劑由西南民族大學動物醫學實驗室保存。儀器:紫外分光光度計Cary 50 Probe(Vatian 公司,美國);凝膠成像系統Doc2000(Bio-Rad 公司,美國);高速冷凍離心機TGL-16(蜀科公司,中國)。
2.3 核酸提取 取適量的糞便與滅菌PBS 緩沖液(pH 7.2)按1∶5的比例制成混懸液,置于-80 ℃超低溫中反復凍融3次,于4 ℃臺式高速冷凍醫用離心機中以8 500 r/min離心10 min,取其上清液再用0.22 μm 微孔徑過濾器過濾,過濾好的混懸液取300 μL 嚴格按照TrizolTMReagent 試劑盒說明書的方法提取樣本總RNA,全程在4 ℃下操作(旨在保證所提取的核酸不被降解),提取的總RNA嚴格按照PrimeScriptTMRT Master Mix 試劑盒說明書的方法反轉錄成cDNA,置于-20 ℃冰箱中備用。另取過濾好的混懸液300 μL 加入STE 500 μL、SDS 和PKA 各20 μL 后水浴1~3 h 進行DNA 提取,提取后的細菌DNA 保存于4 ℃冰箱中備用。
2.4 細菌和病毒的PCR 和RT-PCR 檢測 運用PCR和RT-PCR方法進行檢測,所用引物均由上海生工生物科技有限公司合成,詳細序列見表1。

表1 引物序列信息
3 結果
由表2、表3 可見,大腸桿菌、沙門氏菌、巴氏桿菌均未檢出;22 份糞便樣本均檢測到了BVDV(100%);BNoV 陽性樣本有16 份(72.73%);NeV陽性樣本有12 份(54.54%);BRV 陽性樣本有8份(36.36%);BPV 陽性樣本有4 份(18.18);BCoV陽性樣本有1 份(4.54%);BToV 陽性樣本有1份(4.54%)。BVDV 感染率達100%,說明該牛場BVDV 感染呈廣泛流行,BNoV 和NeV 感染率次之。
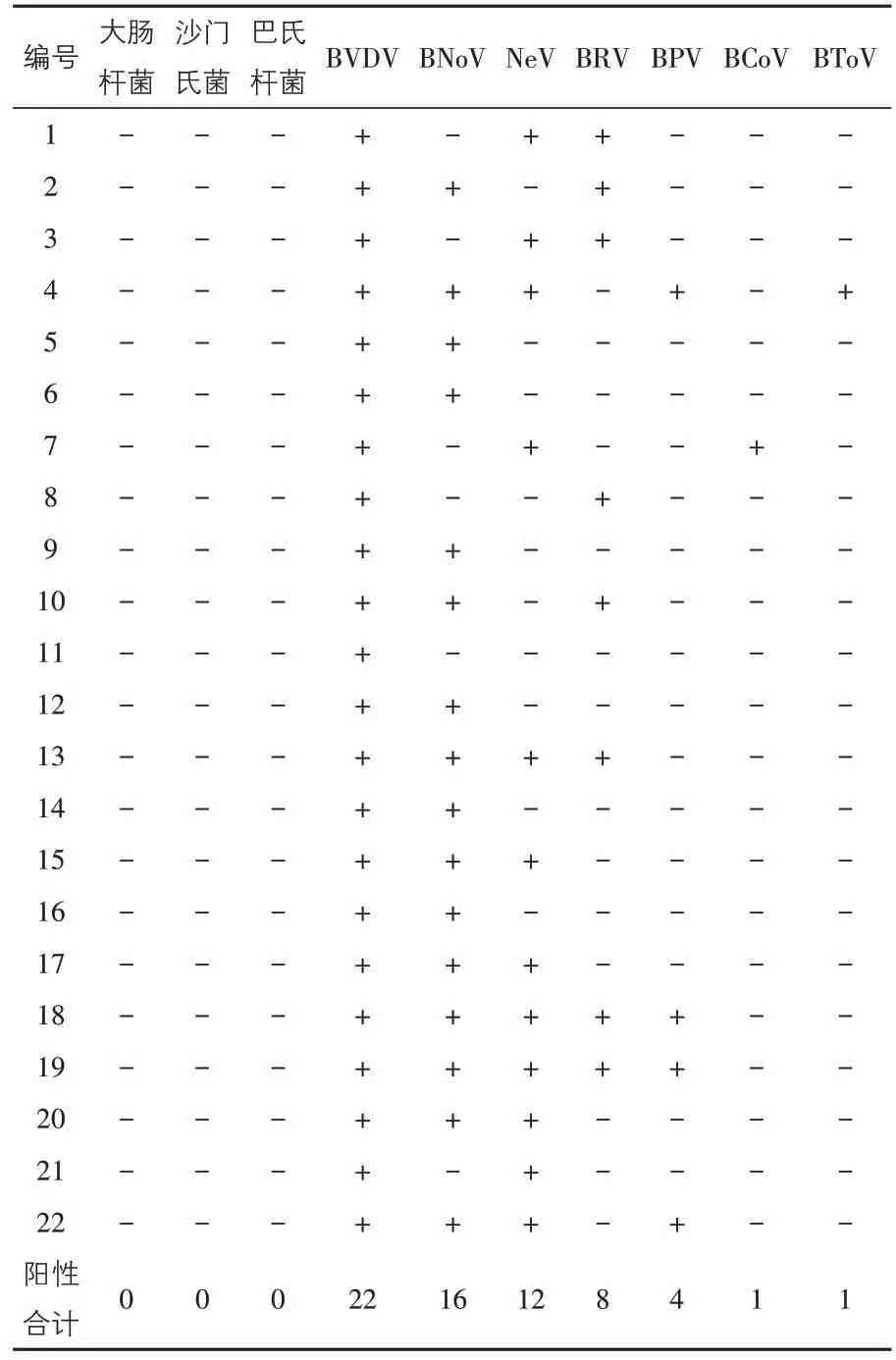
表2 犢牛糞便樣本檢測結果

表3 犢牛糞便樣本陽性率檢測情況
檢測結果表明,22 份犢牛糞便樣本中除1 份樣本只感染1種病毒外,其余21份樣本均為混合感染,感染率高達95.45%。其中,有3 份樣本感染了5種病毒(13.64%),有2份樣本感染了4種病毒(9.09%),有8份樣本感染了3種病毒(36.36%),其余8份樣本感染了2種病毒(36.36%)。
4 討論
病毒感染是引起犢牛腹瀉的重要原因,這些病毒主要有牛輪狀病毒(BRV)、牛冠狀病毒(BCoV)、紐布病毒(NeV)、牛諾如病毒(BNoV)、牛病毒性腹瀉/黏膜病病毒(BVDV)、牛細小病毒(BPV)和牛環曲病毒(BToV)等。其中,BRV、BCoV、BVDV 能導致70%以上的新生犢牛發病,且死亡率高達50%,給養牛產業帶來了巨大的經濟損失[3]。細菌如大腸桿菌(E.coli)、沙門氏菌(Salmonella)、巴氏桿菌(Pasteurella)等也可引起犢牛腹瀉。大腸桿菌、沙門氏菌、輪狀病毒和冠狀病毒等病原還是重要的人畜共患病病原[6-8],可能對地區公共衛生安全造成嚴重威脅。
本試驗對22 份犢牛腹瀉糞便樣本進行了PCR 和RT-PCR 檢測,結果細菌性病原并未檢測到,可能與該場犢牛群使用了抗生素藥物有關;檢 出BVDV、BNoV、NeV、BRV、BPV、BCoV 和BToV 的陽性率分別為:100%、72.73%、54.54%、36.36%、18.18%、4.54%和4.54%。本結果表明,該場發生的犢牛腹瀉由多種病毒混合感染所致,感染率達95.45%,這與美國之前的報道相似[9]。犢牛群中BVDV 感染率最高,達100%,BNoV和NeV 陽性率分別為72.73%、54.54%,表明BVDV、BNoV 和NeV 是該奶牛場犢牛腹瀉的主要病原。此外,BRV 和BCoV 屬于人畜共患病病原[8],在防控BRV 和BCoV 的同時,應當做好飼養員自身的生物安全防護,防止出現公共衛生事件。
依照BVDV 的病毒基因序列差異,將其分為BVDV-1(Pestivirus A)、BVDV-2(Pestivirus B)和BVDV-3(Pestivirus H、HoBi-like Pestivirus and atypical ruminant Pestivirus),并且BVDV-1和BVDV-2 還包含不同的亞型[10]。全球范圍內主要流行的2 個亞型為BVDV-1a 和BVDV-1b。有文獻報道,BVDV-1b是我國牛群最優勢流行毒株,且難以防控[11]。該奶牛場使用了BVDV-IBR二聯滅活苗,感染率仍然高達100%,猜測可能與感染毒株的基因型不一致所致。現在國內外BVD 滅活疫苗大多數針對于BVDV-1 型,雖然BVDV-1型滅活疫苗免疫牛群后產生的抗體能與BVDV-2型產生部分交叉免疫,但對抵御BVDV-2 型強毒株的能力卻不得而知[12],對BVDV-3 型的免疫力尚未見報道。所以該場感染的BVDV屬于哪一個基因型,需作進一步研究。
近年來,BNoV、NeV、BToV 作為新發腹瀉病原,嚴重危害了我國牛群的健康,也越來越受到關注。王玥琳等[13]采用RT-PCR方法檢測了我國5個省12個奶牛場的BNoV感染情況,結果顯示糞便樣本中BNoV的檢出率達25.81%。郭紫晶等[14]采用RT-PCR方法檢測了我國6個省18個奶牛場的NeV感染情況,結果顯示糞便樣本中NeV的檢出率高達48.1%。Li Hao等[15]采用RT-PCR方法檢測了我國4個省5個奶牛場的BToV感染情況,結果顯示糞便樣本中BToV 的檢出率達21.73%。這些都表明BNoV、NeV、BToV作為我國新發病原已經在國內廣泛流行。本次檢測結果表明,BNoV、NeV和BToV存在于該奶牛場中,一方面可能是由于管理人員對新發病原的了解重視程度低,在奶牛引種過程中未對其檢測;另一方面可能是由于人為因素造成了交叉感染,造成多種腸道病毒協同作用,引起患病牛群腹瀉病情加重,進而對犢牛腹瀉的診斷和控制難度大大增加。因此,在養牛生產中,建議將這些新發腹瀉病原納入日常檢測范圍。

