基于三代高通量測序技術的不同養殖環境下日本醫蛭微生物多樣性研究△
柴曉昕,甘奇超,趙瑞亭,史景彥,郭平牯,袁淵,馬莉*
1.首都醫科大學 中醫藥學院,北京 100069;2.重慶多普泰制藥股份有限公司,重慶 400800
水蛭作為一種傳統動物類中藥,具有破血、逐瘀、通經之效[1],日本醫蛭Hirudo nipponicaWhitman為《中華人民共和國藥典》2020 年版收錄品種,具有極大的藥用價值。目前,由于人類過度捕捉及農藥化肥的使用,日本醫蛭野生資源銳減。因此日本醫蛭養殖行業逐漸興起并不斷擴大。
人工養殖水蛭過程的關鍵技術包括環境水質[2-5]、養殖密度[5-7]、水體溫度[2,6-7]、飼喂血液類型[8-9]等。其中水源作為日本醫蛭生存生活的主要條件,將直接影響其生長。地下水是現有內陸水產養殖的重要水源之一[10],但資源有限、開采有難度,目前已有養殖戶采用符合養殖標準的自來水試養日本醫蛭,但水源改變是否會對水蛭養殖產生影響尚缺乏報道。
水蛭的生物學特性及其藥用價值使得其體內的微生物廣受關注。水蛭體內的微生物經過長期共同進化,最終形成復雜且呈動態平衡的微生物群落,對水蛭的健康具有極其重要的意義[11]。水蛭的消化系統十分完善,但存在于消化道內的消化酶是相當稀少的[12]。有研究發現,日本醫蛭進行消化作用是靠與其共生的蛭假單孢桿菌Pseudomonas hirudins,通過培養基接種實驗證實,該共生菌不僅可分解蛋白質和脂肪,還可抑制其他細菌,從而保持水蛭嗉囊中的血液不會腐敗[13-14]。一些有益微生物能夠在動物體腸道內定植并生長繁殖,維持腸道菌群的高水平穩定,預防腸道疾病。隨著微生物鑒定技術的不斷發展,因16S rDNA基因測序技術可以從遺傳物質和分子水平上對微生物進行鑒定,其穩定性和特異性獲得普遍認可,越來越多地應用于微生物鑒定中[15]。基于此,本研究從日本醫蛭肌肉及腸道的細菌多樣性角度入手,采用PacBio 三代高通量測序技術,對自來水養殖與地下水養殖的日本醫蛭取樣,對比2 種水質環境下水蛭的微生物多樣性,評估自來水養殖水蛭的可行性。
1 材料
1.1 樣品
新鮮日本醫蛭樣本采集于重慶市多普泰水蛭養殖基地(N28°56′52.29″,E106°55′53.31″),平均個體質量1.36~1.50 g。由北京協和醫學院藥用植物研究所石林春副研究員鑒定為日本醫蛭Hirudo nipponicaWhitman。
1.2 試劑與儀器
D3146 細菌DNA 提取試劑盒(廣州美基生物科技有限公司);NanoDrop One 型超微量分光光度計(Thermo Fisher Scientific公司)。
2 方法
2.1 樣本采集及處理方法
水蛭養殖于聚乙烯塑料箱中,以新鮮豬血為餌料,養殖用水分別為自來水和地下水,水溫為(26±1)℃,pH 為7.0±0.3,保證養殖箱內常流水,且每24 h 全部換水1 次。其中,自來水經充分曝氣除氯后使用,地下水直接抽提使用。
經過為期90 d 的試驗養殖,以自來水養殖水蛭為實驗組,地下水養殖水蛭為對照組,將日本醫蛭速凍處死后,還軟30 min。在無菌狀態下使用無菌解剖刀和鑷子進行解剖。先分離腸道組織,并用濾紙將其中的血液吸盡后放入凍存管中,自來水組樣本編號為B1,地下水組樣本編號為B2。后分離肌肉組織,用滅菌剪刀、解剖刀切取約1 cm2的組織塊,將組織塊放入凍存管中,自來水組樣本編號為M1,地下水組樣本編號為M2。樣品液氮速凍,置于-80 ℃冰箱保存備用。為保證樣本均一性,每只水蛭均在同一部位進行取樣,且同一取樣點只取1 次,每組重復3次。
2.2 微生物總DNA 提取及聚合酶鏈式反應(PCR)擴增
各樣品經液氮研磨后將粉末分別置于無菌離心管中,利用微生物DNA 提取試劑盒提取樣品基因組DNA。檢測DNA純度和質量濃度。使用引物為27F:5′-AGRGTTYGATYMTGGCTCAG-3′和1492R:5′-RGYTACCTTGTTACGACTT-3′,擴增16S rRNA 基因 V1~V9 高變區[16],根據 16S Amplification SMRTbell?文庫制備流程獲得測序文庫,并在PacBio Sequel Ⅱ平臺上對該文庫進行測序[17]。建庫及高通量測序在廣東美格基因科技有限公司完成。
2.3 數據優化及統計分析
根據各樣本的Barcode 序列,使用Limma 1.9.0軟件從下機數據中拆分出各樣品數據,經過CCS 3.4.1 軟件校正過濾掉過長或過短、subread 數過少的序列,得到Raw reads。最后進行引物切除、簡單重復序列(SSR)去除和嵌合體去除,得到Clean fastq。采用UPARSE usearch 10軟件對所有樣品過濾后的數據按照97%的相似性水平聚類成操作分類單元(OTU)[18]。然后進行多樣性分析,采用QIIME 1.9.1軟件計算Chao1、Shannon和Simpson等α多樣性指數,評估單個樣品中的物種豐富度和多樣性;用QIIME 1.9.1 軟件計 算Bray-curtis、Weighted Unifrac 和Unweighted Unifrac 距離等β多樣性指數,通過非度量多維尺度法(NMDS)對比不同樣本組間群落多樣性差異;通過統計相對豐度超過1%的物種,分析樣本群落結構及關注的物種;利用相似性分析(ANOSIM)檢驗不同養殖組樣本間差異是否有統計學意義。
3 結果與分析
3.1 微生物群落多樣性分析
通過對2 種環境中養殖的日本醫蛭肌肉及腸道組織樣本(M1、M2、B1 和B2)16S rDNA 基因V1~V9(全長)區域進行擴增后測序,共得到69 368 條高質量DNA 序列,長度分布在1412~1443 bp,符合16S rDNA基因的V1~V9區序列長度,共包含83 個OTU。所有日本醫蛭樣本的Shannon 指數稀釋曲線均趨于平緩,表明測序深度已覆蓋水蛭菌群的絕大部分物種(圖1)。

圖1 日本醫蛭樣本的Shannon指數稀釋曲線
對不同樣品在97%一致性閾值下進行α多樣性分析,采用Chao1 指數、Shannon 指數、Simpson 指數綜合表征物種多樣性。其中Chao1 指數常用于反映樣品中群落的豐富度,Chao1 指數值越大,說明物種數量越多;Shannon 指數及Simpson 指數綜合評估群落中物種的豐富度和均勻度,Shannon 指數越大,說明群落具有越大的多樣性;Simpson 指數越大,說明群落具有越大的多樣性(計算隨機取樣時取到不同物種的概率)。如表1 所示,與自來水養殖的水蛭樣品相比,地下水養殖水蛭的肌肉及腸道樣本均具有更多的物種數量且群落具有更大的多樣性。
表1 水蛭樣品的α多樣性指數分析(, n=3)
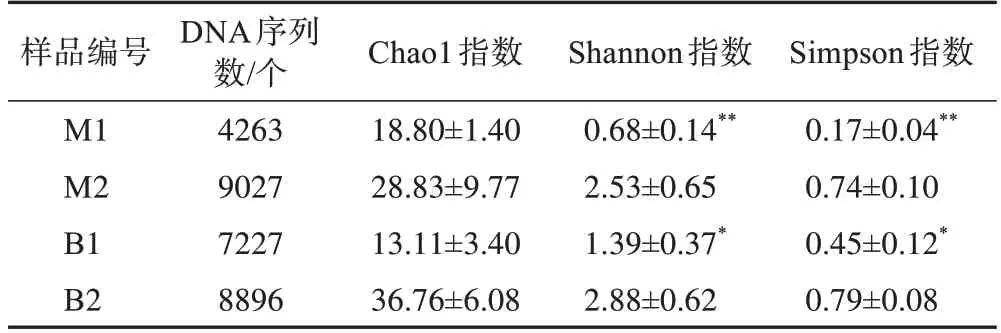
表1 水蛭樣品的α多樣性指數分析(, n=3)
注:不同養殖組同一類組織樣本比較,*P<0.05,**P<0.01。
為克服主坐標分析(PcoA)等基于線性模型的排序方法的缺點,選用NMDS 反映水蛭肌肉和腸道組織細菌群落的β多樣性。從NMDS 分布圖(圖2)可以看出,日本醫蛭肌肉組M1 內的樣品間距離更近,微生物群落也更加相似;腸道組B1 和B2 有部分重疊,排列在左上側。NMDS分析的stress為0.1,可認為排序結果相對可靠。
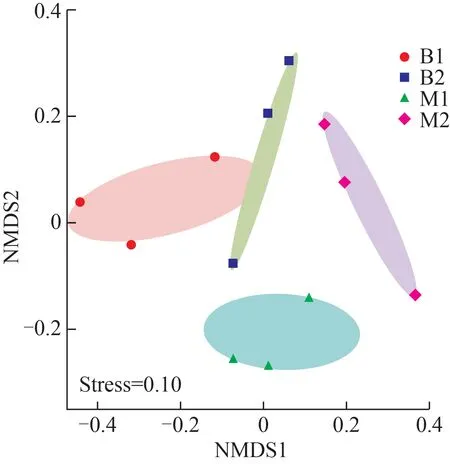
圖2 日本醫蛭樣品微生物群落NMDS排序
3.2 日本醫蛭肌肉及腸道樣本的細菌群落結構
4組樣本中的細菌共鑒定出8個門、13個綱、25個目、46 個科、48 個屬。在此基礎上,在不同分類水平上分別提取序列信息,計算各物種的相對豐度。選取相對豐度在1%以上的物種繪制條形圖,反映不同樣本在不同分類水平上的細菌組成(圖3)。在門水平上,4 組日本醫蛭樣本中的優勢門為變形菌門(Proteobacteria)、擬桿菌門(Bacteroidetes)、厚壁菌門(Firmicutes)及梭桿菌門(Fusobacteria)。在屬水平上,M1、M2、B1、B2中所占比例最高的分別為氨基桿菌屬(Aminobacter)、Elstera、Morganella及黏液菌屬(Mucinivorans)。
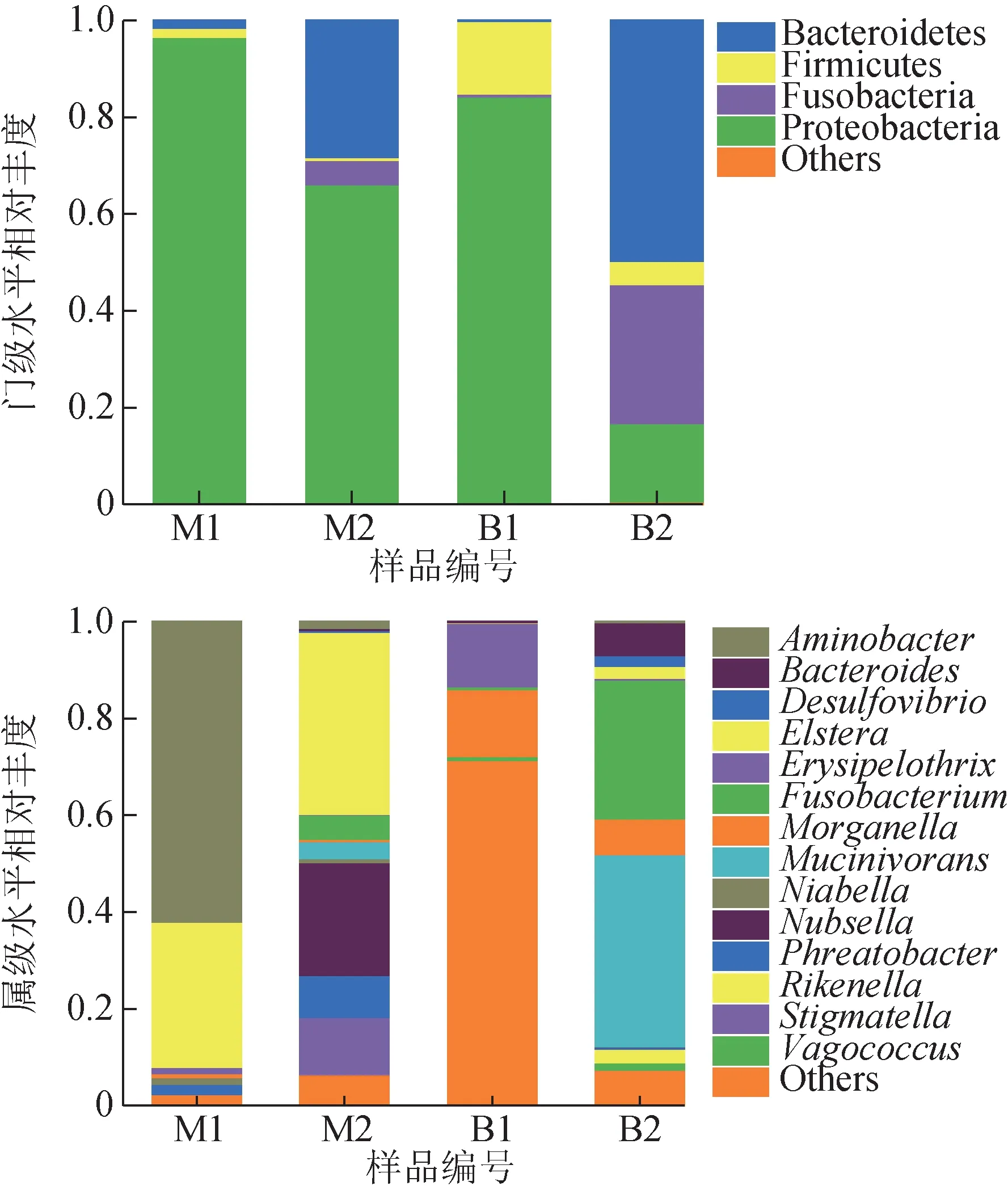
圖3 日本醫蛭樣本的細菌群落結構
屬水平的聚類熱圖(圖4)表明,地下水養殖組肌肉與腸道聚為一簇,自來水養殖組肌肉與腸道聚為一簇。結合圖3~4,與M1、B1 相比,M2、B2的細菌豐度和多樣性均發生變化,表現出更為豐富的細菌群落結構。其中,黏液菌屬(Mucinivorans)、梭桿菌屬(Fusobacterium)、擬桿菌屬(Bacteroides)等有潛在致病風險的菌屬相對豐度在自來水養殖組中明顯低于地下水養殖組。
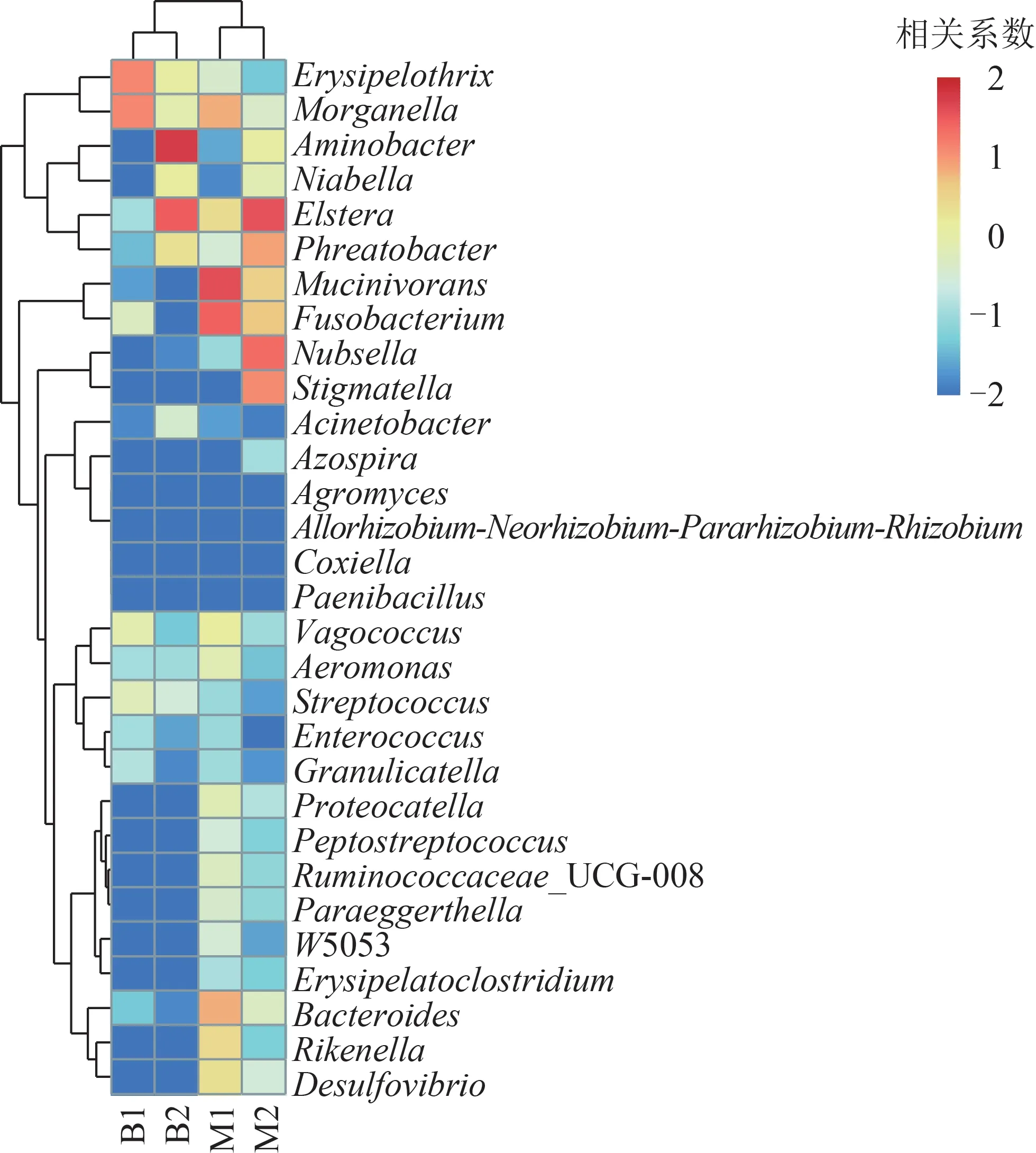
圖4 日本醫蛭樣品屬水平的分層聚類熱圖
采用Anosim 對不同養殖組醫蛭同類組織樣本間的群落結構的差異進行分析,結果顯示,肌肉樣本組間R=0.481,P=0.200,腸道樣本組間R=1.000,P=0.333,提示不同養殖組的同類組織樣本間差異無統計學意義。
4 討論
基于水蛭的生活習性及養殖成本,人工養殖過程中的水環境對提高日本醫蛭的產量尤為重要。本研究應用地下水與除氯的自來水對水蛭開展90 d 的養殖,水蛭生長狀況均良好。與地下水養殖的水蛭相比,除氯自來水養殖的水蛭微生物群落表現出更小的多樣性,但差異無統計學意義,因此認為采用自來水開展水蛭養殖工作是可行的。自來水是指通過汲取江河湖泊及地下水、地表水,由自來水廠經過沉淀、消毒、濾過等工藝流程的處理,生產出來的符合相應標準的供人們生活生產使用的水,水質穩定且資源相對易得,對養殖戶來說成本也較低,可考慮將其充分曝氣除氯后,作為地下水替換資源進行水蛭養殖。
水蛭體內的微生物在長期的進化過程中和水蛭形成共生關系。共生是物種進化的重要驅動力。因此研究藥用水蛭的共生體具有重要意義[19]。本研究中,除氯自來水養殖組日本醫蛭的肌肉及腸道樣本的優勢菌屬分別為氨基桿菌屬(Aminobacter)和Morganella。其中,Aminobacter來源主要為土壤環境,在受污染的土壤或水環境中有很強的應用潛力。該菌屬中目前已知有3 種微生物,即ASI1、ASI2 和MSH1。這3 種微生物能夠將農藥代謝物2,6-二氯苯甲酰胺(BAM)礦化成CO2、NH4+和Cl-,將BAM 作為唯一的碳源、氮源和能源[20]。Morganella屬于腸桿菌科的Proteeae屬,積累的數據表明,其可引起多種感染,如敗血癥、膿腫、尿袋綜合癥、絨毛膜羊膜炎和蜂窩織炎。這種細菌通常會導致某些感染患者的高病死率。但也有研究認為其是不尋常的機會病原體,主要引起術后傷口和尿路感染[21-22]。另一方面,在對相對豐度排名前30 的物種進行統計分析時,發現其中存在的Aeromonas和Rikenella為目前已知的2 種水蛭共生菌[23]。Aeromonas是革蘭陰性兼性厭氧菌[24],可產生大量的出口水解酶,幫助水蛭消化道內的營養物質分解,并且對攝入的動物血液具有殺菌作用。Tasiemski等[25]研究發現,水蛭與Aeromonas均可產生抗生素類物質,這些物質為其提供了針對侵入性細菌的相互保護,并且有助于水蛭腸道菌群的穩態,這種免疫優勢是水蛭與Aeromonas間有穩定的進化關聯的強有力證據。Whitaker 等[26]研究發現,如果從水蛭消化系統的共生天然菌群中去除了Aeromonas,則可能會產生更具毒性的細菌,影響水蛭的健康。Rikenella是專性厭氧菌,是擬桿菌屬的成員,該物種傾向于在食血生物的胃腸道中定殖。有研究認為其對物種的進化適應和消化道生態系統具有一定的生理貢獻[27]。但其在胃腸道內發揮的作用還未明確[28]。有研究指出Rikenella是腸道內具有保護性功能的菌群,小鼠灌胃嘔吐毒素(DON)可使腸道Parabacterodies和Mucispirilla炎癥敏感菌群及有益菌Rikenella的豐度降低,進而引起腸道炎癥發生,導致腸道損傷同時危害機體健康[29]。Ott 等[30]認為Rikenella在宿主的腸胃中與Aeromonas具有協同作用,對Aeromonas的維持和增殖起到保護作用,而同時Aeromonas可減少氧氣供應,從而使厭氧的Rikenella得以棲息。
隨著日本醫蛭養殖業的發展,人工養殖過程中日本醫蛭的疾病爆發也越來越頻繁。雖然傳統化學藥物和抗生素療效顯著,但大多都會在動物體內有殘留,尤其長期使用還將導致耐藥菌滋生,給后期食品、藥品的使用帶來安全隱患。從共生菌、有益微生物等角度出發研制的微生態制劑不僅能夠抑制有害細菌、調節動物腸道微生態環境,還能提高水產動物的品質和產量,已有部分養殖戶開始投入使用。張彬等[31]研究比較了硝化細菌T1、光合細菌T2和EM 復合菌T3 對菲牛蛭養殖水體的凈化效果,結果表明這3 種有益微生物制劑均有顯著增加水體溶氧量及降低氨氮、亞硝態氮、化學耗氧量的效應,達到水體凈化作用,其中以EM 復合菌的凈化效果最佳。張濤等[32]研究發現,新鮮豬血飼料輔以一定量的嗜水氣單胞菌可以在一定密度下降低日本醫蛭的病死率。劉飛等[33]研究發現,在餌料中適當加入糞腸球菌和丁酸梭菌也可以降低日本醫蛭的病死率。因此,在日本醫蛭的人工養殖過程中,建議擴大對日本醫蛭的有益微生物的研究,研制微生態制劑,提高日本醫蛭的產量。

